Что такое синдромом хатчинсона гилфорда детская прогерия

Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 марта 2020; проверки требуют 4 правки.
Прогери́я (др.-греч. προσ- — сверх, γέρων — старик) — один из редчайших генетических дефектов. При прогерии возникают изменения кожи и внутренних органов, которые обусловлены преждевременным старением организма. Классифицируют детскую прогерию (синдром Гетчинсона (Хатчинсона) — Гилфорда) и прогерию взрослых (синдром Вернера).
Британский врач Джонатан Хатчинсон в 1886 г. впервые описал случай преждевременного старения у шестилетнего мальчика, которое проявлялось атрофией кожи и её придатков[1][2]. В дальнейшем его соотечественник и коллега Гастингс Гилфорд, изучив клинико-морфологические особенности этой патологии, ввел термин «прогерия».[2] Прогерию взрослых описал немецкий врач Карл Вильгельм Отто Вернер, который еще будучи студентом-медиком наблюдал этот синдром у четырех сиблингов в возрасте около 30 лет и задокументировал эти наблюдения в кандидатской диссертации в 1904 году.
В мире зафиксировано не более 350 случаев прогерии, в числе которых 13-летняя Адалия Роуз (Adalia Rose),18-летняя Ашанти Элиотт-Смит, а также 22-летняя Онталаметсе Фалатсе (Ontlametse Phalatse) из городка Хеброн неподалеку от Йоханнесбурга, являющаяся единственной больной прогерией представительницей негроидной расы. Широкую известность в мире получили страдавший прогерией и скончавшийся 5 июня 2011 года Леон Бота, диджей и исполнитель xип-хопa, который вел видеоблог на YouTube[3], а также американский мотивационный спикер Сэм Бернс,умерший 10 января 2014 года в возрасте 17 лет и Хэйли Окинс, умершая 2 апреля 2015 года в возрасте 17 лет
У детей[править | править код]
Причина детской прогерии — мутации гена LMNA, кодирующего ламин А. Ламины — белки, из которых выстроен особый слой оболочки клеточного ядра. В большинстве случаев прогерия встречается спорадически, в нескольких семьях зарегистрирована у сибсов, в том числе от кровнородственных браков, что свидетельствует о возможности аутосомно-рецессивного типа наследования. В клетках кожи больных обнаружены нарушения репарации ДНК и клонирования фибробластов, а также атрофические изменения эпидермиса и дермы, исчезновение подкожной клетчатки.
Хотя детская прогерия может быть врождённой, у большинства больных клинические признаки проявляются обычно на 2—3-м году жизни. Резко замедляется рост ребёнка, отмечаются атрофические изменения дермы, подкожной клетчатки, особенно на лице, конечностях. Кожа истончается, становится сухой, морщинистой, на туловище могут быть склеродермоподобные очаги, участки гиперпигментации. Сквозь истонченную кожу просвечивают вены. Внешний вид больного: большая голова, лобные бугры выступают над маленьким заостренным («птичьим») лицом с клювовидным носом, нижняя челюсть недоразвита. Наблюдаются также атрофия мышц, дистрофические процессы в зубах, волосах и ногтях; отмечаются изменения костно-суставного аппарата, миокарда, гипоплазия половых органов, нарушение жирового обмена, помутнение хрусталика, атеросклероз.
Средняя продолжительность жизни при детской прогерии — 13 лет. Большинство источников указывают возраст смерти от 7 до 27 лет, при этом случаи достижения совершеннолетия очень редки. Известны только два случая пациентов, переживших 27-летний рубеж — японец, описанный Огихарой и другими в 1986 году и проживший 45 лет [4] и Тиффани Ведекинд которой 41 год и она считается самой пожилой из всех пациентов, у которых диагностировали синдром «Бенджамина Баттона».
У взрослых[править | править код]
Прогерия взрослых имеет аутосомно-рецессивный тип наследования. Дефектный ген — WRN (ген АТФ-зависимой хеликазы). Предполагается связь процесса с нарушением репарации ДНК, обмена соединительной ткани.
Гистологическая картина: уплощение эпидермиса, гомогенизация и склероз соединительной ткани, атрофия подкожной клетчатки с замещением её соединительнотканными волокнами. Клинически заболевание проявляется в период полового созревания. Отмечаются замедленный рост, симптомы гипогонадизма. Обычно на третьем десятилетии жизни у больного седеют и выпадают волосы, развивается катаракта, постепенно истончается кожа и атрофируется подкожная клетчатка на лице и конечностях, вследствие чего руки и особенно ноги становятся тонкими. Появляются очаги склеродермоподобного уплотнения, дисхромии, наиболее выраженные в дистальных отделах конечностей и на лице, что наряду с тонким клювовидным носом, суженным ротовым отверстием придает ему маскообразность. На местах, подвергающихся давлению, развиваются гиперкератоз, хронические плохо заживающие трофические язвы. Обнаруживаются остеопороз, метастатическая кальцификация мягких тканей, реже остеомиелит. Часто наблюдается сахарный диабет, признаки которого, как и симптомы раннего генерализованного атеросклероза, обычно выявляются у больных в возрасте 30—40 лет; возможны злокачественные новообразования (например, рак кожи, саркома, аденокарцинома).
Диагноз устанавливают на основании клинической картины. Дифференциальный диагноз проводят с врожденной пойкилодермией, склеродермией. Лечение симптоматическое, в основном направлено на профилактику атеросклеротических осложнений, устранение сахарного диабета, трофических язв. Оно проводится терапевтом, эндокринологом или другим специалистом в зависимости от превалирующих клинических симптомов. Прогноз для выздоровления неблагоприятный; большинство больных погибает от атеросклеротических осложнений и злокачественных новообразований. Профилактика не разработана.
Старение[править | править код]
Установлено, что тяжёлая форма прогерии человека (синдром Хатчинсона — Гилфорда) связана с молекулярными изменениями, характерными для нормального старения, среди них геномная нестабильность, уменьшение длины теломер и нарушение гомеостаза стволовых клеток. Эти данные вместе с генетическими исследованиями продолжительности жизни привели к гипотезе, согласно которой при синдромах прогерии ускоряется ряд патологических изменений, которые, как правило, управляют обычным процессом старения[5].
Примечания[править | править код]
Литература[править | править код]
- Фёдорова Е. В. О врождённой прогерии. — 1980. — Т. 4. — С. 66. — (Педиатрия).
Источник
Синдром преждевременного старения – редчайшая аномалия генетической природы. Частота встречаемости патологии – 1:4000000. В мире зарегистрировано только около 80 изученных случаев, что усложняет поиск эффективных методов лечения. Синдром прогерия (от древнегреческих слов «сверх» и «старик») имеет неустановленное происхождение. Морфологические формы болезни – детская и взрослая, характеризуются рядом отличий.
Причины аномалии
Синдром быстрого старения имеет генетическое происхождение, но механизм развития патологии у взрослых и детей различный.
Факторы развития болезни в детском возрасте
Подобная аномалия, развивающаяся в раннем периоде (по достижении возраста одного-двух лет) имеет название синдром Хатчинсона-Гилфорда по имени врачей, впервые описавших независимо друг от друга с интервалом в 10 лет детское заболевание. Труды специалистов датируются девяностыми годами девятнадцатого века. За более чем 100 лет медики не сделали прорыва в изучении и лечении патологии.
Причина болезни у детей – стойкое изменение генома, затрагивающее носитель наследственности, кодирующий ламин А. Фибриллярный белок – структурная единица, выстилающая слой оболочки ядра клетки. Вследствие мутации клетки теряют способность к нормальному делению, что вызывает ряд нарушений и приводит к преждевременному износу органов.
Предполагается возможность аутосомно-рецессивного наследования. Теория такой передачи основана на случаях развития аномалии у детей, рожденных от родителей, состоящих в близкородственных связях.

Причины развития аномалии у взрослых
Если аутосомно-рецессивная передача признака при болезни у детей только предполагается, патология взрослых, доказано, имеет именно этот тип наследования.
Условия развития болезни – сбой обменных процессов, происходящих в соединительной ткани. Клетки этой ткани активно делятся, а поскольку они продуцируют предшественники коллагена, этот фибриллярный белок разрастается. Продуцирование мукополисахаридов снижается. Такие изменения приводят к нарушению клеточного обмена, что провоцирует патологические процессы.
Аномалия у взрослых вызвана стойким изменением в гене WRN, участвующем в механизмах восстановления, исправления химических повреждений и разрывов в молекулах дезоксирибонуклеиновой кислоты, выполняющем функцию расщепления двойной спирали ДНК на одноцепочные молекулы.
Существует предположение о том, что к возникновению дефекта гена может привести радиационное воздействие на организм матери, однако такая гипотеза не имеет чёткого обоснования, предполагается также случайность мутации.
К возможным факторам развития относят экологическую обстановку, образ жизни.
Симптоматика
Как разнятся причины и факторы развития болезни у взрослых и детей, так и во многом различаются проявления синдрома у разных возрастных категорий.
У детей
Синдром Гетчинсона (Хатчинсона)-Гилфорда может проявиться в возрасте до года, но чаще обнаруживается у детей от одного до трёх лет.
Внешние проявления аномалии таковы:
- Непропорциональные размеры частей черепа. Лицевая часть значительно уменьшена, мозговой отдел патологически увеличен.
- Деформация зубов в связи с их ростом в 2 ряда: молочные, в соответствии с возрастом, ещё не выпали, постоянные при синдроме старения у детей появляются раньше времени.
- Недоразвитая нижняя челюсть.
- Низкий рост, карликовость.
- Кожа тонкая, сухая, морщинистая, особенно это касается лица, шеи и конечностей.
- Выступающие сквозь тонкую прозрачную кожу вены.
- Ранняя потеря ресниц, бровей, облысение волосистой части головы, седина.
- Характерные черты лица: заострённый клювоподобный нос, выступающие лобные бугры.
Кроме внешних признаков, болезнь проявляется поражением органов, их ранним износом, общим истощением организма. Внутренние проявления, выражающиеся в недомоганиях и определяемые путём дополнительных обследований:
- ранний атеросклероз;
- нарушения мозгового кровообращения;
- инсульты;
- инфаркты;
- разрастание миокарда с появлением рубцовых изменений;
- утрата костной тканью минералов и солей, как следствие,частые переломы костей;
- контрактура суставов – сложность в сгибании и разгибании;
- остеопорозы;
- атрофия мышц;
- снижение остроты зрения, вызываемое катарактой;
- недоразвитие половых органов;
- отклонения в липидном обмене.
Организм ребёнка претерпевает изменения, характерные для людей пожилого возраста, при этом в интеллектуальном и психоэмоциональном развитии такие дети не уступают здоровым сверстникам.
Продолжительность жизни обычно не превышает 14 лет, однако известен случай, когда пациент с диагностированным синдромом дожил до 27. Летальные исходы наступают чаще всего на фоне инфарктов, инсультов.
У взрослых
Синдром раннего старения у взрослых носит название болезнь Вернера по имени немецкого врача, описавшего в начале двадцатого века симптомокомплекс, присущий пациентам. Первые признаки аномалии отмечаются в период полового созревания, при этом патология быстро прогрессирует. На фото, сделанных с интервалом в один год, невозможно узнать человека, и внешние изменения – лишь малая часть преждевременных преобразований.

Существенное отличие заболевания взрослых от детской прогерии – то, что болезнь затрагивает умственное развитие, интеллектуальные способности резко снижаются.
К внешним проявлениям патологии относятся:
- Снижение веса, замедление (остановка) процессов роста.
- Поседение волос.
- Выпадение ресниц, бровей, предшествующее облысению головы. Истончение волос.
- Бледность и истончение кожных покровов.
- Сужение ротового отверстия.
- Смещение вперёд глазного яблока.
- Появление морщин, пигментных пятен на кожных покровах.
- Просвечивание сосудов сквозь кожу.
- Атрофия подкожной клетчатки приводит к утончению верхних и нижних конечностей.
- Высокий и хриплый голос.
- Деформация ногтевой пластины («часовые стёкла»).
К внутренним признакам болезни относят разнообразные поражения органов, приводящие к множественным дисфункциям. Наиболее выражены следующие симптомы синдрома:
- Истончение подкожно-жировой клетчатки, в результате чего она замещается волокнами соединительной ткани.
- Ухудшение зрения, обусловленное помутнением хрусталика.
- Потеря слуха – от частичной до полной.
- Снижение когнитивных способностей: проблемы с концентрацией внимания, памятью.
- Утолщение миокарда.
- Атеросклероз сосудов.
- Снижение иммунитета вследствие недостаточного продуцирования антител.
- Нарушения в работе репродуктивной системы: ранний климакс у женщин, гипогонадизм у мужчин, приводящий к половой дисфункции.
- Тугоподвижность суставов, остеопорозы, остеоартрозы, гнойно-некротические процессы в костях и прилежащих мягких тканях.
- Нарушения в работе сальных и потовых желез.
- Сахарный диабет.
- Злокачественные новообразования костной, мышечной, хрящевой, жировой тканей, кожных покровов, аденокарциномы.
Взрослые пациенты с диагностированным синдромом при своевременном лечении могут дожить до сорока лет, но редко переступают этот возрастной порог.
Необходимая диагностика
Поскольку синдром характеризуется чётко выраженной внешней картиной, диагностика предполагает проведение осмотра и сбор данных анамнеза пациента и его родственников, чего бывает достаточно для постановки диагноза.
Для определения сопутствующих заболеваний, обусловленных развитием основной патологии, используются следующие методы:
- Анализы крови – могут показать повышенное содержание холестерина при атеросклерозе, высокую концентрацию сахара при диабете.
- Ультразвуковое исследование показывает аномалии сердечно-сосудистой системы.
- Рентгенологическое исследование визуализирует проблемы костной ткани.
- Компьютерная и магнитно-резонансная томография показывают нарушения мозгового кровообращения, патологии костной системы, визуализируют опухоли.
Современные методы лечения
До недавнего времени считалось, что прогерия неизлечима. Проводилась симптоматическая терапия, призванная улучшить качество жизни человека и несколько продлить продолжительность жизни.
Недавние исследования, проведённые в США, и опробование нового препарата дают возможность предполагать, что учёные всё же изобретут средства, которые позволят вылечить заболевание.
В детскую больницу Бостона были приглашены пациенты юного возраста с диагностированной аномалией. Под постоянным контролем медиков и регулярным мониторингом состояния всех систем организма дети принимали новый препарат на основе ингибитора фарнезилтрансферазы.
Результаты обследований показали стабилизацию состояния сердечно-сосудистой и костной систем, улучшение самочувствия пациентов. Ожидается, что из категории смертельных заболевание перейдёт в разряд трудноизлечимых. В данный момент клинические испытания продолжаются, учёные пытаются усовершенствовать лекарственное средство.
Пока такого препарата, который бы мог эффективно справиться с патологией, не изобрели. Пациенты с диагностированным синдромом рассчитывают на замедленное старение, что позволит не только улучшить качество жизни, но и увеличить ее продолжительность. Обеспечить это врачи могут посредством симптоматического лечения, основными направлениями которого являются:
- Терапия атеросклеротических изменений – используются статины.
- Профилактика инфарктов и инсультов – применяется ацетилсалициловая кислота.
- Устранение сахарного диабета – проводится посредством гипогликемических средств.
- Лечение новообразований – хирургические методы, сопутствующая терапия.
- Коррекция отставания в физическом развитии – гормональные препараты.
- Заживление трофических язв – производят, используя средства, заживляющие и стимулирующие кровообращение.
Кроме медикаментозной терапии, пациентам назначают массаж, бальнеотерапию, рефлексотерапию, различные физиопроцедуры для активизации обменных процессов, нормализации кровообращения, повышения мышечного тонуса и так далее.
Синдром преждевременного старения на сегодняшний день поддаётся лишь симптоматической терапии, в то время как специфического лечения для него не существует.
Загрузка…
Источник
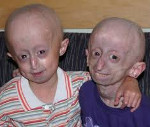
Прогерия – редкое генетическое заболевание, характеризующееся преждевременным старением организма, соответствующими изменениями внутренних органов. Проявляется гиперпигментацией, истончением и утратой эластичности кожи, поседением и выпадением волос, увеличением размеров черепа, уменьшением его лицевой части, экзофтальмом, развитием атеросклероза сосудов, инфаркта и фиброза миокарда, остеопороза, сахарного диабета, формированием злокачественных опухолей. Диагностика основана на сборе клинических данных, лабораторном исследовании ДНК. Лечение направлено на устранение симптомов заболевания: профилактику и терапию атеросклероза, инфаркта миокарда, диабета, остеопороза, рака.
Общие сведения
Термин «прогерия» в переводе с древнегреческого языка означает «преждевременное старение». Детская форма прогерии называется синдромом Хатчинсона-Гилфорда согласно фамилиям исследователей, которые впервые независимо друг от друга описали данную патологию: британский врач Дж. Хатчинсон – в 1889 году, его соотечественник Х. Гилфорд – в 1897 году. Взрослая форма носит название «синдром Вернера», так как в 1904 году немецкий врач О. Вернер первым официально наблюдал симптомы старения у подростков 14-19 лет. Оба варианта болезни являются крайне редкими. Распространенность детской прогерии составляет 1 случай на 7-8 млн. человек, с момента начала исследований патологии выявлено около 150 больных детей. Взрослая прогерия встречается чаще, средние эпидемиологические показатели – 1 больной на 100 тыс. населения.

Прогерия
Причины прогерии
В основе заболевания лежит генетическая мутация. Причиной детского типа прогерии является дефект гена LMNA, который кодирует особый белок ламин A, выстраивающий оболочку ядра клетки. Как правило, мутация происходит спорадически – во время созревания половых клеток у родителей или при зачатии. Однако исследователи выявили несколько случаев патологии у родных братьев и сестер, часть из которых входила в семьи с близкородственными браками. Это свидетельствует о возможности наследования мутации по аутосомно-рецессивному типу (родители являются носителями дефектного гена, но не болеют и способны к деторождению).
Прогерия взрослых – наследственное заболевание. Оно развивается при наличии дефекта в гене RECQL2, который ответственен за производство белка WRN, поддерживающего стабильность генома, целостность и структуру ДНК. Передача мутации происходит аутосомно-рецессивным способом, болезнь проявляется у людей, получивших два дефектных гена в одной аллели (от матери и от отца).
Патогенез
При детском варианте прогерии генетический дефект приводит к нарушению синтеза структурно правильного белка ламина А, образующего внутренний каркас ядерной оболочки. В результате мутации налаживается производство укороченного белка-предшественника преламина А, а строение созревшего конечного белка отличается от нормального. Молекулы белка встраиваются в ядерную мембрану, изменяют ее форму и повышают хрупкость. Ядро не может сохранять свою целостность, клетка гибнет раньше времени.
При болезни Вернера возникает недостаточность WRN-белка, определяется генетически детерминированная нестабильность хромосом. Их структура очень часто изменяется спонтанно или под воздействием некоторых факторов. В итоге ухудшается способность клеток к делению, пролиферативный потенциал становится в 3-5 раз меньше, чем должен быть в норме. В 10 раз увеличивается частота спонтанных мутаций, аномально укорачиваются теломеры – концевые участки хромосом, защищающие гены от повреждений.
Симптомы прогерии
Прогерия Хатчинсона дебютирует после периода нормального развития в возрасте от 6 месяцев до 2 лет. Изменяется внешность детей: замедляется рост, увеличиваются размеры черепа, но лицевая часть остается маленькой, нижняя челюсть – недоразвитой. Формируется клювовидный тонкий нос и экзофтальм (выпячивание глаз). Тотально выпадают волосы – на голове и теле, ресницы и брови. При алопеции разрушаются волосяные фолликулы, поэтому дальнейший рост волос становится невозможным. На волосистой части головы выбухают вены. Дерма и подкожная клетчатка подвергаются атрофическим изменениям: кожа истончается, иссушается, покрывается морщинами. Развивается липодистрофия – заметное снижение количества подкожного жира. Относительно сохранным он остается на щеках и лобке.
На туловище образуются склеродермоподобные очаги – уплотнения в нижней части живота, на ягодицах и бедрах. На открытых участках кожи появляются пигментные пятна. Ногти недоразвитые, ломкие, утолщенные, округло выпуклые – имеют форму «часовых стекол». К 2 годам развивается фиброз органов и околосуставных тканей. Пассивные движения в локтевых и коленных суставах ограничены (контрактуры), формируется характерное положение костей ног – «поза всадника». Скелет подвергается гипоплазии, дисплазии и дегенеративным изменениям. Молочные и постоянные зубы прорезываются с опозданием, частично отсутствуют, скученные, искривленные, подвержены кариесу. К 5-6 годам диагностируется атеросклероз сосудов, сердечные шумы, гипертрофия левого желудочка, помутнение хрусталика, резистентность к инсулину. Половые органы остаются недоразвитыми. Уровень умственного развития обычно выше, чем у сверстников.
Клинические проявления синдрома Вернера обнаруживаются с 14 до 18 лет. Подросток начинает отставать в росте, его волосы седеют и выпадают. К 20 годам пациенты лысеют. Кожа лица и конечностей бледнеет, истончается, натягивается. Под ней видна сеть кровеносных сосудов. Мышечная и жировая ткани атрофируются, руки и ноги становятся непропорционально тонкими, кожа над суставными выступами изъязвляется. К 30 годам появляется катаракта, голос слабеет и хрипнет, на ногах образуются язвы, на подошвах – мозоли, сосудистые звездочки, кератоз. Внешний вид пациентов специфичен: низкий рост, лунообразное лицо, выступающий подбородок, суженное ротовое отверстие, псевдоэкзофтальм.
Сальные и потовые железы атрофируются. Костно-суставные изменения включают метастатическую кальцификацию, явления генерализованного остеопороза, эрозивных остеоартритов, ограниченную подвижность и деформацию пальцев рук, сгибательные контрактуры, боли в конечностях, артрит и остеомиелит. Отмечаются атеросклеротические изменения сосудов, медленно прогрессирует катаракта, снижаются интеллектуальные способности. После 30 лет проявляются эндокринные заболевания – сахарный диабет, гипогонадизм, тиреопатии. У 5-10% больных обнаруживаются злокачественные опухоли различных органов, костей и кожи. Причиной смерти становится онкопатология или тяжелое сердечно-сосудистое заболевание.
Диагностика
Диагноз прогерии устанавливается на основании клинико-анамнестических данных. В зависимости от имеющейся симптоматики в диагностике могут принимать участие эндокринологи, неврологи, дерматологи, терапевты, врачи-генетики. Детскую и взрослую прогерию необходимо дифференцировать с системной склеродермией, пойкилодермией, синдромом Ротмунда-Томсона, синдромом Видемана-Раутенштрауха. К основным методам обследования больных относятся:
- Опрос. В ходе беседы врачи уточняют время появления симптомов, их выраженность, степень физической и социальной дезадаптации, наличие периода обычного развития (6-24 месяца при детской форме, 14-20 лет – при взрослой). Собирают данные семейного и генеалогического анамнеза, выявляя генетическую патологию или ее отсутствие в роду.
- Осмотр. Специалисты оценивают неврологический статус, пассивную и активную подвижность суставов, костные деформации, состояние кожи и подкожной клетчатки, сохранность зрения, интеллектуальных функций. Пациенты могут быть направлены на инструментальные исследования: рентгенографию костей, УЗИ и МР-томографии органов, ЭКГ, офтальмоскопию.
- Биогенетическое исследование. Выполняется анализ генетического материала методом секвенирования ДНК. Исследуются участки генов, дефекты в которых приводят к развитию прогерии. У пациентов с детской и взрослой формой болезни обнаруживаются мутации в гомозиготном и компаунд-гетерозиготном состоянии.
Лечение прогерии
Специфические методы терапии прогерии не разработаны. Медицинская помощь пациентам заключается в облегчении симптомов болезни. Проводится лечение атеросклероза, остеопороза, остеомиелита, катаракты, диабета, патологий сердца и онкологических заболеваний. Известен случай, когда состояние больного заметно улучшилось на несколько лет после операции трансплантации сердца.
Научные исследования ведутся в области генной инженерии – совершаются попытки выделить мутационный ген из ДНК и заменить его здоровым. Параллельно разрабатывается метод этиотропной терапии. Ученые из Швеции нашли способ нейтрализации дефектных молекул ламина A, которые проникают в мембрану клеточных ядер и способствуют гибели клетки. Положительные результаты получены на экспериментах с мышечной тканью крыс, на людях препарат пока не опробован. В США с 2012 года ведется изучение эффективности применения ингибитора фарнезилтрансферазы (лекарственного средства, разработанного для лечения рака). После терапии дети из экспериментальной группы чувствовали себя лучше, повысилась жесткость и эластичность артерий, плотность костей, снизились случаи транзиторных ишемических атак, сердечных патологий, утраты зрения и слуха. Продолжительность жизни увеличилась на 1,6-6 лет.
Прогноз и профилактика
В среднем больные детской прогерией доживают до 13 лет, зарегистрированы случаи смерти в 7 и 27 лет. Продолжительность жизни при взрослом типе заболевания составляет 30-40 лет. Причиной летального исхода становятся атеросклеротические осложнения и злокачественные новообразования. Профилактические меры отсутствуют. Предупредить рождение больного ребенка можно при наследственном характере болезни – при синдроме Вернера, в отдельных случаях синдрома Хатчинсона, когда патология выявлена в семье, будущие родители отнесены к группе высокого риска. Таким парам назначается медико-генетическое консультирование.
Источник
