Двс синдром при остром промиелоцитарном лейкозе

Лечение острого промиелоцитарного лейкоза (ОПЛ). Прогноз
Острый промиелоцитарный лейкоз (ОПЛ) до недавнего времени считался наиболее неблагоприятным вариантом острого миелоидного лейкоза (ОМЛ): ранняя летальность составляла 20-30%. Важность быстрой диагностики острого промиелоцитарного лейкоза (ОПЛ) обусловлена его ассоциацией с синдромом ДВС, часто приводящим к внутричерепным кровоизлияниям на фоне проведения цитостатической терапии.
Применение транс-ретиноевой кислоты (all-trans-retinoic acid, ATRA) — пример использования первого дифференцирующего агента, эффективного при лечении злокачественных заболеваний. В отличие от цитостатических препаратов, ATRA индуцирует пролиферацию патологического клона, его созревание и конечную дифференцировку. При этом полная ремиссия (ПР) достигается у 90-95% больных, причем дифференцирующая терапия лишена побочных эффектов, свойственных химиотерапии (прежде всего не развивается аплазия кроветворения).
Стабилизация и улучшение состояния пациентов достигается в течение нескольких дней. Биологический эффект ATRA не ограничивается de novo острым промиелоцитарным лейкозом (ОПЛ); при использовании препарата у больных с рецидивом заболевания после проведения химиотерапии полной ремиссии (ПР) достигается в 85-90% случаев.
Несмотря на очевидные преимущества, терапия ATRA не лишена потенциальных осложнений. У 10% больных может развиться летальный исход вследствие тромботических осложнений и развития так называемого синдрома ретиноевой кислоты, в 25% случаев возникают острый респираторный дистресс-синдром или эндотоксический шок. Для синдрома ретиноевой кислоты характерны лихорадка, одышка, появление периферических отеков с увеличением массы тела, плеврального и перикардиального выпота; гипотензия, иногда развивается почечная недостаточность.

При отсутствии лечения осложнение всегда фатально. С целью профилактики и лечения используются короткие курсы глюкокортикостероидов в высоких дозах (дексаметазон по 10 мг дважды в сутки в течение 3 и более дней).
Монотерапия ATRA не является достаточной: у большинства больных на фоне продолжающегося лечения персистирует молекулярный маркер болезни PML/RAR-a, и в течение нескольких месяцев развивается рецидив заболевания. В связи с этим на фоне индукции или в раннем постиндукционном периоде применяется химиотерапия, обычно комбинация антрациклинового антибиотика и цитарабина.
В последние годы для индукции ремиссии часто используется идарубицин в комбинации с ATRA. Больные, получающие длительную поддерживающую терапию в виде химиотерапии или альтернирующей терапии ATRA в сочетании с цитостатическими препаратами, имеют более высокую длительную безрецидивную выживаемость. Это является принципиальным отличием от других форм ОМЛ, при которых проведение поддерживающей терапии после интенсивной консолидации обычно не улучшает показатели выживаемости.
Несмотря на впечатляющие результаты, достигнутые после введения в практику ATRA, у 40% больных острым промиелоцитарным лейкозом (ОПЛ) развивается рецидив. Достижение второй полной ремиссии (ПР) у таких пациентов, так же как и при других вариантах ОМЛ, является сложной задачей. При раннем рецидиве (в течение 6-12 месяцев) больные, как правило, резистентны к ретиноидам. При достижении второй полной ремиссии (ПР) единственным шансом на излечение может быть интенсификация в виде аллогенной или аутологичной миелотрансплантации.
Внедрение в клиническую практику ATRA настолько улучшило результаты терапии, что в последние годы острый промиелоцитарный лейкоз (ОПЛ) расценивается как наиболее прогностически благоприятный вариант острого миелоидного лейкоза (ОМЛ) (при комбинации ATRA и химиотерапии 5-летняя безрецидивная выживаемость достигает 50-60%).
– Также рекомендуем “Принципы лечения острого лимфобластного лейкоза (ОЛЛ)”
Оглавление темы “Лечение острых лейкозов”:
- Стадии течения острого лейкоза – критерии
- Профилактика и лечение инфекционных осложнений острого лейкоза. Лечение инфекций при лейкозе
- Переливание крови при остром лейкозе – гемокомпонентная терапия
- Лечение метаболических нарушений при остром лейкозе – форсированный диурез
- Прогноз лечения острого миелоидного лейкоза – прогностические факторы
- С чего начать лечение острого миелоидного лейкоза? – индукционная терапия
- Постремиссионная терапия острого миелоидного лейкоза – трансплантация костного мозга
- Лечение рецидива острого миелоидного лейкоза – эффективность схем
- Лечение острого промиелоцитарного лейкоза (ОПЛ). Прогноз
- Острый лимфобластный лейкоз у детей: диагностика, лечение
- Принципы лечения острого лимфобластного лейкоза (ОЛЛ)
Источник
Нарушения гемостаза при остром промиелоцитарном лейкозе (ОПЛ) – диагностика, лечение
Из всех видов острых лейкозов наиболее тяжелые и рано возникающие нарушения гемостаза наблюдаются при остром промиелоцитарном лейкозе (ОПЛ). До сравнительно недавнего времени, до внедрения в практику лечения острого промиелоцитарного лейкоза (ОПЛ) полностью трансретиноевой кислоты (ATRA), ранняя летальность больных преимущественно от профузных кровотечений, связанных с ДВС-синдромом, составляла 62 %.
Подмечено, что указанный синдром был выражен у больных в тем большей степени, чем значительнее у них бластоз и гиперлейкоцитоз и при микрогранулярном ОПЛ (M3v), что сделало очевидной прямую связь геморрагически-тромботического синдрома при остром промиелоцитарном лейкозе (ОПЛ) с действием прокоагулянтов и протеаз, продуцируемых лейкозными клетками.
Эта концепция получила подтверждение после внедрения в практику ATRA-терапии, в результате которой ранняя летальность от геморрагии при остром промиелоцитарном лейкозе (ОПЛ) резко снизилась, а выживаемость больных при комбинированной ATRA и цитостатической терапии, используемой для индукции ремиссии, достигла почти 90%. Было установлено, что вызываемое ATRA «дозревание» бластных клеток ведет к ослаблению их тромбопластических и протеолитических свойств, уменьшению как тромбинемии, так и эндотелиоза, к нарастанию гемостатических свойств тромбоцитов и ослаблению повреждающего действия лейкоцитов на стенки микрососудов.
Таким образом, изучение динамики нарушений гемостаза в процессе ATRA-терапии подтвердило причинную связь ДВС-синдрома и геморрагии при лейкозах с эффектами бластных клеток на разные звенья этой системы и показало, что устранение бластоза ликвидирует большую часть этих нарушений.
Вместе с тем в процессе этих наблюдений выявились некоторые новые, ранее неизвестные нарушения гемостаза у больных лейкозами.
Заместительная терапия в период индукции ремиссии у больных острым промиелоцитарным лейкозом в зависимости от варианта индукционного лечения
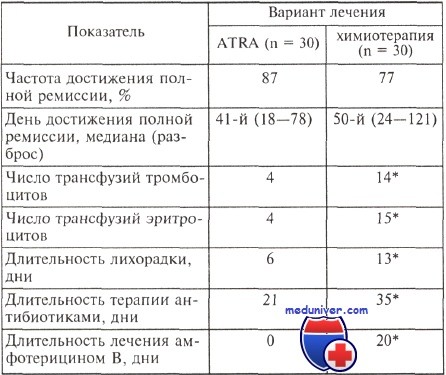
* Статистически значимые различия
Тромботические осложнения при ATRA-терапии острого промиелоцитарного лейкоза (ОПЛ)
Вскоре после внедрения в практику лечения больных острым промиелоцитарным лейкозом (ОПЛ) ATRA-терапии было подмечено, что в процессе такого лечения наряду с ослаблением или исчезновением геморрагического синдрома появляется наклонность к развитию тромбозов магистральных вен и сосудов внутренних органов.
До применения ATRA этот тромбоэмболический синдром при остром промиелоцитарном лейкозе практически никогда не развивался. Следовательно, в процессе дозревания бластных клеток под влиянием ATRA у больных острым промиелоцитарным лейкозом возрастает свойственная всем онкологическим заболеваниям наклонность к тромбоэмболиям, т. е. происходит трансформация ДВС-синдрома в обычный онкотромботический процесс.
Это подсказало необходимость подключения к терапии больных после купирования геморрагического синдрома введений в профилактических дозах низкомолекулярного гепарина — фраксипарина или фрагмина, поскольку эти два препарата отличаются наименьшей геморрагичностью.
Установлено также, что особенно часты тромботические осложнения у тех больных, у которых в процессе лечения возникает так называемый ATRA-синдром.
ATRA-синдром и нарушение гемостаза
У части больных острым промиелоцитарным лейкозом в течение первых 2—3 нед применения ATRA возникает своеобразный патологический процесс — ATRA-синдром. Он характеризуется лихорадкой, одышкой, тромбоцитопенией и спонтанной гиперагрегацией тромбоцитов, острым респираторным дистресс-синдромом, наличием инфильтратов в легких, плевроперикардиальным выпотом, развитием отеков, а в ряде случаев острой почечной недостаточности.
Этот синдром сопровождается выраженным гиперлейкоцитозом и значительным внутрисосудистым гемолизом. Не исключено, что ATRA-синдром является одним из вариантов тромботической тромбоцитопенической пурпуры.
– Также рекомендуем “Синдром тромботической тромбоцитопенической пурпуры (ТТП-синдром) – дифференциация с ДВС-синдромом”
Далее рекомендуем для ознакомления следующие статьи:
- Длительность лечения цитокинами (Г-КСФ, ГМ-КСФ) – время начала терапии
- Цитокины (ИЛ-11, агонисты рецепторов Mpl, ФРРМ) в лечении тромбоцитопении – эффективность
- Анемия при опухолях (онкологических заболеваниях) – причины, механизмы развития
- Лечение анемии при опухолях (онкологических заболеваниях) – эффективность эритропоэтина
- Нарушения гемостаза при опухолях крови – эндотелиоз
- Нарушения тромбоцитарного гемостаза при опухолях крови – причины тромбоцитопении
- Нарушения гемостаза при остром промиелоцитарном лейкозе (ОПЛ) – диагностика, лечение
- Синдром тромботической тромбоцитопенической пурпуры (ТТП-синдром) – дифференциация с ДВС-синдромом
- Трансплантационный веноокклюзионный синдром (ВОС) – диагностика, лечение
- Диагностика нарушений гемостаза – коагулограмма
Источник
Лечение молекулярных рецидивов острого промиелоцитарного лейкоза (ОПЛ)
Подходы к лечению молекулярных рецидивов при острого промиелоцитарного лейкоза разработаны мало. Итальянские ученые, например, предлагают использовать химиотерапию в сочетании с ATRA при повторном выявлении в течение короткого периода транскрипта RML-RARa.
Так, из 14 больных, у которых был определен молекулярный рецидив, у 12 достигнута повторная молекулярная ремиссия, причем у 7 на фоне применения ATRA в течение 30 дней. Всем больным после курса ATRA проводили химиотерапию: четыре однодневных курса цитарабина в высоких дозах (1 г/м2) в сочетании с митоксантроном (6 мг/м2).
Безрецидивная выживаемость в течение 2 лет этих 14 больных составила 92 % по сравнению с 44 % у 37 больных, которым осуществляли аналогичную терапию в гематологическом рецидиве. Эффективность ATRA, принимаемой в течение 30 дней, у больных с молекулярным рецидивом острого промиелоцитарного лейкоза отметили и английские исследователи. Они сообщили о достижении повторной молекулярной ремиссии у 2 больных с молекулярным рецидивом после аутологичной ТКМ.
Достижение ремиссии у больных с острым промиелоцитарным лейкозом и выживаемость
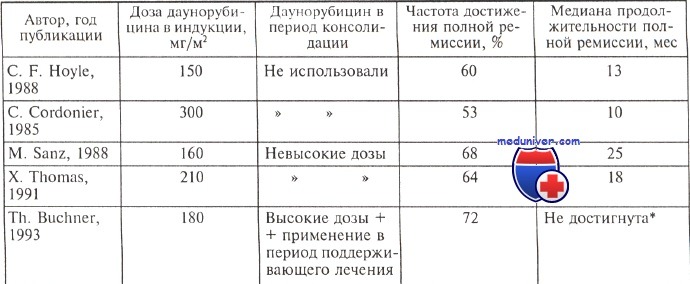
Вероятность сохранения полной ремиссии в течение 5 лет составила 53 %
Других способов лечения молекулярных рецидивов острого промиелоцитарного лейкоза в доступной нам литературе мы не нашли. Отечественными специалистами предложен новый биологический способ воздействия на минимальную остаточную болезнь при остром промиелоцитарном лейкозе: применение ИФН-а в сочетании с ATRA (ATRA 45 мг/м2 1-5-й день, ИФН-а 3 000 000 ME в 1, 2, 3-й день).
В ходе исследования эффективности нового метода лечения сформированы следующие группы: больные с молекулярным рецидивом (4); больные с персистенцией остаточной опухолевой популяции клеток после проведенного лечения (2); больные в период поддержания молекулярной ремиссии после химиотерапии малого объема (2). Полученные данные свидетельствуют о том, что лечение ИФН-a в сочетании с ATRA оказывает отчетливый эффект, т. е. позволяет без применения цитостатических воздействий индуцировать молекулярные ремиссии при остром промиелоцитарном лейкозе и длительно их поддерживать.
Число наблюдений очень невелико (8 больных), поэтому требуется четкий повторный контроль молекулярного эффекта исследуемых препаратов. Возможно, указанный подход следует использовать только у больных без факторов риска. В тех случаях, когда они присутствуют и невозможно выполнить трансплантацию аутологичных или аллогенных гемопоэтических клеток, следует чередовать курсы химиотерапии и лечение ИФН-a в сочетании с ATRA.
– Также рекомендуем “Трансплантация костного мозга при остром миелоидном лейкозе – эффективность”
Оглавление темы “Лечение острого миелоидного лейкоза”:
- Побочные эффекты ATRA терапии – ретиноидный синдром
- Современные принципы ATRA терапии острого промиелоцитарного лейкоза (ОПЛ)
- Современные схемы химиотерапии острого промиелоцитарного лейкоза (ОПЛ)
- Триоксид мышьяка в лечении острого промиелоцитарного лейкоза (ОПЛ) – эффективность, побочные эффекты
- Механизмы действия триоксида мышьяка при остром промиелоцитарном лейкозе (ОПЛ)
- Критерии молекулярной ремиссии при остром промиелоцитарном лейкозе (ОПЛ)
- Лечение молекулярных рецидивов острого промиелоцитарного лейкоза (ОПЛ)
- Трансплантация костного мозга при остром миелоидном лейкозе – эффективность
- Лечение рецидивов острого миелоидного лейкоза – принципы
- Новые методы лечения острых лейкозов
Источник
Характеристика острого промиелоцитарного лейкоза М3 – иммунофенотипПервые работы по цитохимической характеристике бластных клеток при острых лейкозах появились в начале 60-х годов. В этот период исследователи открыли возможность дифференцировать бластные элементы при остром лейкозе не только по их морфологическим, но и по физиологическим (цитохимия) признакам. Классическим цитохимическим признаком опухолевых клеток при остром промиелоцитарном лейкозе является очень яркая реакция на миелопероксидазу (МРО), судановый черный (SBB), хлорацетатэстеразу. Первое в нашей стране и очень подробное описание этих признаков приведено А. И. Воробьевым и соавт. в 1968 г. Авторы представили результаты цитохимического исследования бластных клеток 11 больных острым промиелоцитарным лейкозом. Опухолевые клетки при остром промиелоцитарном лейкозе (ОПЛ) имеют довольно характерный иммунофенотип. Определяются экспрессия антигенов CD13 и CD33 и позитивная реакция с антителами к миелопероксидазе. Маркеры ранних стадий дифференцировки клеток гранулоцитарного ростка CD34 и HLA-DR, которые экспрессируются на бластных клетках при других вариантах ОМЛ, при остром промиелоцитарном лейкозе обычно не выявляются. Практически всегда при остром промиелоцитарном лейкозе (ОПЛ) позитивной бывает реакция с антителами к антигену CD9, причем при других формах этот маркер не определяется. К сожалению, эти антитела редко включаются в диагностическую панель. Редко, но иногда определяется экспрессия моноцитоидных маркеров CD11b и CD14, при этом не выявляется корреляции с цитохимическими реакциями на моноцитоидную линию (неспецифическая эстераза). Также иногда могут быть обнаружены другие маркеры моноцитоидной дифференцировки, например CD64, очень редко CD65 или CD117. Антиген CD11a, который экспрессируется практически на клетках всех ОМЛ, при ОПЛ не выявляется.
Проведены исследования по изучению экспрессии лимфоидных маркеров CD7 и CD2. Оказалось, что CD7-антиген всегда бывает отрицательным, a CD2-антиген в ряде случаев положительным. Более того, некоторые исследователи предлагают выделять в качестве отдельной формы тот вариант ОПЛ, при котором выявляется экспрессия CD2. Интересно, что существует ассоциация в экспрессии между CD2 и CD34. Так, итальянские ученые при анализе иммунофенотипа бластных клеток у 114 больных ОПЛ выделили две группы пациентов: на бластных клетках определяется и CD34, и CD2 (n = 66) или не определяется экспрессия (n = 20). Позитивной экспрессией для CD34 считалось обнаружение более 10 % клеток, экспрессирующих CD34, для CD2 — более 20 %. У 28 пациентов определялась разнородная экспрессия этих антигенов. При сопоставлении клинических, лабораторных, цитогенетических данных с указанным иммунофенотипом были выявлены четкие корреляции. При позитивной экспрессии CD2 и CD34 число лейкоцитов в дебюте было больше (11,8 • 109/л против 1,8 • 109/л), число тромбоцитов меньше (19,5 • 109/л и 27,5 • 109/л соответственно), процент бластных клеток в крови был выше (88 и 18 %), чаще определялся bcr3-тип транскрипта PML-RARа. Характерным явилось и то, что значимость различий сохранялась по этим параметрам и при исключении микрогранулярного варианта ОПЛ. Пока не получены результаты об эффективности современной терапии описанного иммунофенотипического варианта ОПЛ, поэтому трудно трактовать прогностическую значимость данного феномена. Несколько групп исследователей выявили значительные различия в выживаемости и вероятности развития рецидивов у больных ОПЛ, если на бластных клетках определяется экспрессия CD56. Результаты исследования итальянских ученых GIMEMA больных ОПЛ с очевидностью доказывают, что экспрессия CD56 является отрицательным прогностическим признаком. Экспрессия считается положительной, если 20 % и более бластных клеток экспрессируют указанный антиген. Из 100 пациентов у 15 % был выявлен данный маркер. Не найдено различий ни по полу, ни по возрасту, ни по числу лейкоцитов и тромбоцитов в дебюте заболевания, ни по клинике ДВС, содержанию гемоглобина и фибриногена. Продолжительность ремиссии и общая выживаемость этих пациентов была существенно ниже, чем у тех, у кого экспрессия CD56 не выявлялась. Другие авторы подтверждают данную информацию: если экспрессия CD56 есть, рецидив развивается у 71,4 % пациентов, если нет — у 12 %, что сказывается соответственно на общей выживаемости и медиане продолжительности ремиссии. Интересно, что эти различия получены только для ОПЛ или ОМЛ с t(8;21), а при других вариантах ОМЛ они не выявляются. – Также рекомендуем “Эпидемиология острого промиелоцитарного лейкоза – частота встречаемости” Оглавление темы “Острые лейкозы”:
|
Источник