Двс синдром в акушерстве протокол рк
ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания крови) – это нарушение в функционировании системы гемостаза, которое проявляется в первую очередь усиленным формированием тромбов в мелких сосудах.
Данная патология является актуальной для самых разных областей медицины. Диагностикой и лечением ДВС-синдрома занимаются акушеры, реаниматологи, хирурги. Встречается патология как у взрослых, так и у детей, в том числе, новорожденных. Зачастую коагулопатии (нарушения в процессе свертывания крови) имеют врожденный характер, но могут развиваться в течение жизни. ДВС-синдром у новорожденных является одной из форм коагулопатии.
Механизм развития нарушения достаточно сложен, патология может иметь множество симптомов. По этой причине врачи сталкиваются с определенными трудностями при постановке диагноза. ДВС-синдром имеет свойство усугублять течение иных заболеваний, но самостоятельной болезнью при этом не является.
Содержание:
- Тромбоз: когда норма, а когда отклонение?
- ДВС-синдром – каковы причины?
- ДВС-синдром: стадии и формы
- Симптомы ДВС-синдрома
- Диагностика ДВС-синдрома
- Лечение ДВС-синдрома
Тромбоз: когда норма, а когда отклонение?
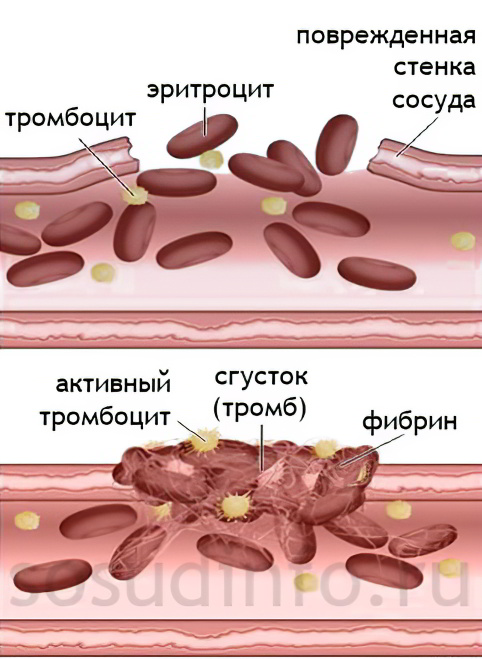
На протяжении всей жизни человек получает различные травмы, начиная от незначительных царапин и заканчивая серьезными ранениями. Организм имеет собственный механизм защиты, направленный на остановку крови. Для этого в поврежденной области она начинает сворачиваться, формируя тромб.
В целом, организм обладает двумя системами, имеющими кардинальное противоположное предназначение. Одна система называется свертывающей, а вторая противосвертывающей. Если они работают без каких-либо нарушений, то в организме поддерживается баланс. При возникновении угрожающей ситуации, например, при травме, кровь сворачивается, препятствуя массивному кровотечению. При отсутствии каких-либо повреждений кровь находится в жидком состоянии.
Чтобы в месте повреждения сосуда сформировался тромб, организм должен запустить множество сложнейших реакций. В них принимает участие белок под названием фибриноген, который присутствует в плазме крови, а также тромбоциты, фактор свертывания и различные ферменты. В результате, образовавшийся сгусток закрывает дефект на сосудистой стенке и не дает крови изливаться наружу.
Если повреждения сосуда не произошло, то кровь по сосудам циркулирует в жидком состоянии, не давая тромбам формироваться. За это отвечают антитромботические механизмы, которые осуществляются благодаря веществам, имеющим название антикоагулянты. Они включают в себя белки плазмы, эндогенный гепарин и протеолитические ферменты. Если фибриноген начинает скапливаться в том или ином месте сосуда, то быстрый ток крови «разбивает» его и тромб не образуется. Этот механизм носит название фибринолиза. В нем также участвуют ферменты, которые продуцируют лейкоциты, тромбоциты и иные клетки крови. Мелкие частицы фибрина в дальнейшем просто будут уничтожены макрофагами и лейкоцитами.
Если происходит сбой в тех или иных системах гемостаза, либо у человека развивается какое-либо заболевание, механизмы, регулирующие работу свертывающей и противосвертывающей системы, дают сбой. При этом в организме начинают формироваться тромбы, повышается риск развития массивного кровотечения. Именно такие нарушения лежат в основе развития ДВС-синдрома. Они являются крайне опасными для здоровья человека и несут в себе угрозу жизни.
ДВС-синдром – каковы причины?

ДВС-синдром – это не заболевание, а следствие тех или иных нарушений в организме.
Поэтому на его развитие оказывают влияние ряд состояний:
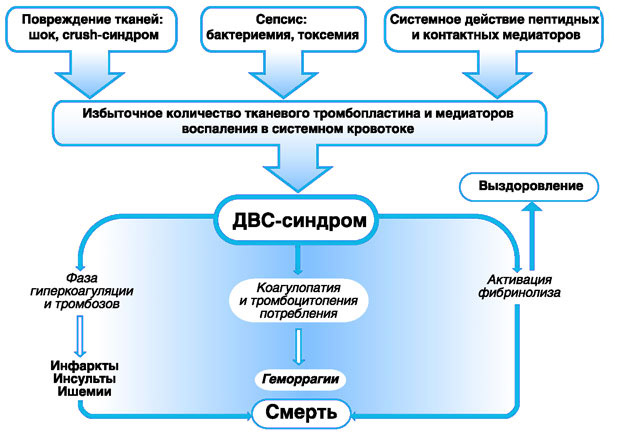
Инфекционные заболевания, сопровождающиеся сепсисом, либо тяжелое течение вирусной или бактериальной инфекции.
Шок любой этиологии: на фоне полученной травмы, на фоне отравления организма, на фоне инфекции.
Состояние, граничащее с летальным исходом – клиническая смерть.
Операции по поводу трансплантации органов, по поводу установки протеза клапана сердца. Серьезные травмы.
Нахождение человека на аппарате исукственного кровообращения во время проведения операции.
Раковые поражения внутренних органов. В плане развития ДВС-синдрома особую опасность представляют лейкозы.
В акушерской практике ДВС-синдром развивается на фоне массивного кровотечения во время родов, при ранней отслойке плаценты, при эмболии околоплодными водами.
Во время беременности ДВС-синдром может сопутствовать тяжелому токсикозу, резус-конфликту, внематочной беременности и не только.
Болезни сердечно-сосудистой системы.
Воспаления внутренних органов, сопровождающиеся нагноением.
ДВС-синдром может развиться при клинической смерти, при проведении реанимационных мероприятий. На фоне терминальных состояний ДВС-синдром либо развивается, либо разовьется в ближайшее время, если не будут предприняты определенные терапевтические меры.
У здорового новорожденного ребенка, который появился в положенные сроки, ДВС-синдром диагностируют очень редко. Он может сопутствовать гипоксии новорожденных, имеющей тяжелое течение, нарушениям в работе органов дыхания, эмболии околоплодными водами. В последнем случае симптомы ДВС-синдрома будут диагностированы как у женщины, так и у ребенка.
К наследственным коагулопатиям относят гемофилию и болезнь Виллебранда. При этом у ребенка наблюдается усиленная кровоточивость. Тромбогеморрагический синдром у детей диагностируют очень редко. Спровоцировать его могут инфекционные заболевания и тяжелые травмы.
ДВС-синдром: стадии и формы
В зависимости от того механизма, который спровоцировал развитие ДВС-синдрома, различают следующие его стадии:
Стадия гиперкоагуляции. При этом в крови увеличивается концентрация тромбопластина, который способствует ее повышенной свертываемости. В результате у человека начинают формироваться тромбы.
Коагулопатия потребления. В крови повышается уровень факторов свертывания, в ответ на это организм усиливает фибринолитическую активность, чтобы не допустить закупорки сосудов тромбами.
Гипокоагуляция. В этот период наблюдается нехватка в организме тромбоцитов, так как организм израсходовал их запасы во время предшествующих стадий. Данная ситуация приводит к тому, что кровь сворачивается плохо.
Стадия восстановления. Итак, любая серьезная травма или кровотечение, или иной поражающий фактор, влечет за собой повышенный и неконтролируемый расход тромбоцитов и иных компонентов крови, отвечающих за ее свертывание. Это вызывает их дефицит и дальнейшую гипокоагуляцию с повышенной кровоточивостью. При условии, что в этот период пациенту будет оказана качественная медицинская помощь, у него наступит фаза восстановления.
Тяжесть поражения обуславливается тем, что тромбы формируются во всех мелких сосудах, что влечет за собой поражение большинства тканей органов и систем.
В зависимости от характера симптомов ДВС-синдрома и от тяжести их течения, различают следующие его формы:
Острая форма. Длительность ДВС-синдрома в острой форме может составлять от нескольких часов до нескольких дней. Чаще всего данное нарушение сопутствует травмам, сепсису, оперативным вмешательствам, гемотрансфузии при массивных кровопотерях.
Подострая форма. Длительность этой формы ДВС-синдрома может составлять несколько недель. Она чаще всего сопутствует хроническим заболеваниям инфекционного генеза и аутоиммунным процессам.
Хроническая форма. Эта форма ДВС-синдрома может длиться на протяжении нескольких лет. Чаще всего ее диагностируют терапевты, наблюдающие пациентов с болезнями печени, почек, сердца, сосудов, а также с сахарными диабетом. По мере прогрессирования основного заболевания, будут усиливаться симптомы ДВС-синдрома.
Рецидивирующая форма.
Скрытая форма.
Иногда ДВС-синдром может развиваться буквально в течение нескольких минут. Такую форму патологии называют молниеносной. Чаще всего с таким вариантом ДВС-синдрома сталкиваются врачи акушерской практики.
Симптомы ДВС-синдрома
Если ДВС-синдром имеет подострое или хроническое течение, то диагностировать его по симптомам может быть весьма проблематично. Острая фаза, напротив, сопровождается выраженными клиническими проявлениями, которые выражаются кожными высыпаниями и усиленным кровотечением. При этом выставить диагноз не составляет труда.

Так как на фоне ДВС-синдрома тромбы формируются в мелких сосудах, то пострадают в первую очередь такие органы, как: печень, легкие, кожа и головной мозг. Именно в них капиллярная сетка развита сильнее, чем в остальных органах. Прогноз на восстановление зависит от тяжести течения ДВС-синдрома.
К основным симптомам, позволяющим заподозрить ДВС-синдром, относят:
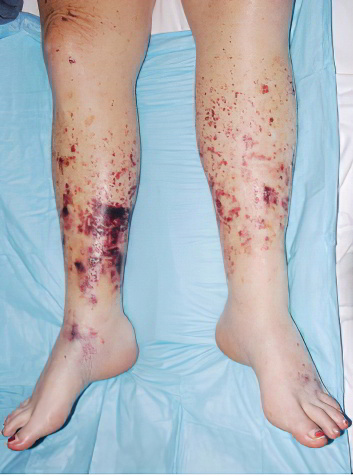
Появление геморрагической сыпи на коже. Возможно возникновение очагов некроза на лице, на руках и ногах.
Одышка. Она возникает в результате поражения легких. По мере нарастания дыхательной недостаточности возможна остановка дыхания с отеком легких.
Накопление фибрина в мелких сосудах почек приводит к сбоям в их работе, вплоть до развития почечной недостаточности. Это проявляется задержкой мочи и нарушением электролитного баланса в организме.
Неврологические расстройства являются следствием поражения головного мозга.
Также для ДВС-синдрома характерно появление носовых кровотечений, маточных кровотечений, появление гематом в области мягких тканей и внутренних органов.
Если рассматривать симптомы ДВС-синдрома в целом, то они сводится к появлению тромбозов и кровоизлияний, а также к нарушениям в работе большинства органов, которые являются жизнеобеспечивающими.
Диагностика ДВС-синдрома
Диагностика ДВС-синдрома невозможна только на основании его клинических проявлений. Выполнение лабораторных исследований является обязательным диагностическим мероприятий. Они дают возможность не только подтвердить наличие ДВС-синдрома, но также определить его стадию и форму.
Базовым методом исследования является коагулограмма крови, которая дает возможность обнаружить уменьшение количества тромбоцитов, рост фибриногена (на начальной стадии развития патологии) или его падение (на последующих этапах развития ДВС-синдрома). Также коагулограмма позволит определить увеличение времени свертывания крови и прочие нарушения.
Если человек погиб, то возможно проведение посмертной диагностики ДВС-синдрома. Для этого его ткани отправляют на гистологическое исследование. В них будут обнаружены форменные элементы крови, которые скапливаются в капиллярах, а также тромбы, закупоривающие их. Внутренние органы человека подвергаются множественным кровоизлияниям, покрыты участками некроза.
При подозрении на ДВС-синдром, необходимо контролировать показатели крови, так как на начальных стадиях развития патологии они могут быть в пределах нормы. Также нужно следить за нарушениями электролитного баланса в организме, за уровнем мочевины и креатинина в крови, за диурезом и pH крови.
Лечение ДВС-синдрома
Единой схемы, которую можно было бы применять для лечения любой формы ДВС-синдрома, просто не существует. Однако опираясь на стадии развития патологического процесса, врачи разработали определенные подходы к проведению терапии.
Для начала следует установить причину ДВС-синдрома.
В зависимости от этого, могут быть реализованы следующие подходы:
Назначение антибиотиков, если ДВС-синдром развивается на фоне гнойных состояний.
Восполнение крови при массивной кровопотере.
Стабилизация работы сердца и сосудов, артериального давления при развитии шокового состояния.
Оказание адекватной акушерской помощи.
Проведение обезболивания при развитии шока на фоне травмы или иных повреждений.
Чтобы устранить симптомы и проявления ДВС-синдрома, необходимо проводить следующую терапию:
Лечение антикоагулянтами. С этой целью чаще всего используют Гепарин, который позволяет нормализовать процессы свертывания крови, не дает формироваться тромбам, ускоряет процесс их растворения. В результате, работа органов и тканей нормализуется.
Назначение фибринолитиков и антифибринолитиков, что зависит от стадии ДВС-синдрома. Чтобы восполнить нехватку факторов свертываемости крови, пациенту назначают инфузионную терапию. Для этого используют замороженную плазму. Ее можно вводить с Гепарином, с препаратом Гордокс или Контрикал, которые препятствуют процессам гиперкоагуляции.
Улучшение текучести крови, назначение лекарственных средств для нормализации микроциркуляции крови в сосудах. Для достижения этих целей используют Аспирин, Трентал, Курантил и реологические растворы, например, Волювен и Реополиглюкин.
Проведение экстракорпоральной детоксикации. При этом пациенту проводят гемодиализ, плазмаферез, цитаферез.
Иногда решение о выборе терапевтической схемы приходится принимать очень быстро, так как на спасение жизни человека имеются считанные секунды. Обязательно нужно учитывать стадию развития ДВС-синдрома, так как в одно время показаны одни препараты, а в другой момент времени они могут быть категорически противопоказаны. Параллельно следует контролировать состояние свертывающей системы крови, ее электролитный и кислотно-щелочной баланс.
Также нельзя допускать, чтобы человек терпел боль, нужно проводить противошоковые мероприятия. На первой стадии развития патологического состояния пациенту вводят Гепарин.
В реанимацию доставляют всех больных, у которых имеется риск развития тромбогеморрагического синдрома, либо он уже диагностирован. Если этот синдром достиг 3 стадии, то вероятность летального исхода составляет 70%. Хроническое течение тромбогеморрагического синдрома всегда завершается гибелью больного.
Чтобы не допустить развития ДВС-синдрома, нужно своевременно его диагностировать и подбирать адекватную ситуации терапию. Чем раньше будет нормализован гемостаз, тем быстрее человек восстановится.
Видео: лекция А.И. Воробьева о ДВС-синдроме:

Автор статьи: Шутов Максим Евгеньевич | Гематолог
Образование:
В 2013 году закончен Курский государственный медицинский университет и получен диплом «Лечебное дело». Спустя 2 года окончена ординатура по специальности «Онкология». В 2016 году пройдена аспирантура в Национальном медико-хирургическом центре имени Н. И. Пирогова.
Наши авторы
Источник
Тяжелое и крайне тяжелое течение заболеваний. Тяжелым течение инфекции считается при частоте дыхательных движений более 30 в мин., или SpO2 менее 93%, или PaO2 /FiO2 менее 300 мм рт.ст. Следует иметь ввиду отсутствие прямой корреляции одышки и напряжения показателей кислорода в крови. Обнаружение прогрессирования рентгенологических изменений в легких, типичных для вирусного поражения, по данным рентгенографии или КТ, в виде увеличение распространенности выявленных до 50% и более объема легочной ткани. К возможным признакам тяжелого течения следует отнести нарушения сознания, ажитацию, нестабильную гемодинамику (снижение АД менее 90/60 мм рт.ст. (или снижение на 45-50% от исходных величин)), наличие признаков преходящей парциальной почечной недостаточности (снижение диуреза менее 20 мл/час, повышение креатинина или мочевины). К крайне тяжелому состоянию относятся все случаи развившейся органной недостаточности (необходимость респираторной поддержки, применения почечно-заместительной терапии), гемодинамический (септический) шок.
Больные с тяжелым течением заболевания и крайне тяжелым должны получать лечение в условиях стационара. При этом всем назначаются низкомолекулярные гепарины (или нефракционированный гепарин) в профилактической дозировке. Абсолютных противопоказаний для назначения такой терапии нет, исключая наличие в анамнезе побочных реакций на гепарины, в том числе – гепариновую тромбоцитопению. Эффективность назначения гепаринов оценивается как высокая. В настоящее время не установлено связи между дозами гепарина и эффективностью – такие исследования продолжаются.
У тяжелых больных нередко используется противовирусная терапия, которая может влиять на концентрацию в крови прямых оральных антикоагулянтов. Так у 12 больных с COVID19, получающих дабигатран и апиксабан и противовирусную терапию (лопинавир, ритонавир или дарунавир) в среднем концентрация антикоагулянтов была в 6,14 раза выше, чем в период до госпитализации. Это тревожное повышение уровня антикоагулянтов в плазме повышает риск кровотечений. (Direct oral anticoagulant plasma levels’ striking increase in severe COVID-19 respiratory syndrome patients treated with antiviral agents: The Cremona experience; Sophie Testa at al)
Антикоагулянтная терапия оценивается в целом как эффективная даже у больных, получающих ИВЛ. Так I. Paranjpe at al ретроспективно проанализировали результаты лечения 395 пациентов с инфекцией ковид19, получавших ИВЛ. В группе получавших антикоагулянты летальность составила 29,1% с медианной выживаемостью 21 день тогда как в группе не получавших антикоагулянты летальность составила 62,7% с медианной выживаемостью 9 дней (Association of Treatment Dose Anticoagulation with In-Hospital Survival Among Hospitalized Patients with COVID-19 I. Paranjpe, V. Fuster).
Вместе с тем, хорошо известно о гепаринорезистентности при ДВС-синдроме: про нее пишут многие авторы, подразумевая, впрочем разные ее проявления – от клинической неэффективности до банального отсуствия влияния на хронометрические показатели свертывания крови. При этом рекомендуется увеличивать дозу гепарина до лечебной под контролем хронометрических показателей коагуляции. Однако, еще в 70-е годы ХХ столетия было показано, что изолированная гепаринотерапия малоэффективна и должна сочетаться с трансфузиями свежезамороженной плазмы. СЗП переливается в дозе 500-700 мл ежедневно (или, по другим данным – 10-20 мл/кг) на протяжении 2-4 дней с учетом центрального венозного давления и не допуская перегрузки кровотока. Введение СЗП должно быть струйным, так как оно направлено на изменение баланса в системе гемостаза. Трансфузии СЗП показаны всем тяжелым и крайне-тяжелым пациентам, но, возможно, надо начинать вводить СЗП и в более ранние стадии заболевания.
Введение СЗП в больших объемах показано при выраженном геморрагическом синдроме с выраженными кровотечениями – носовыми, желудочно-кишечными, маточными. В этом случае объем вводимой плазмы может составлять несколько литров. Плазма вводится быстро, иногда – под давлением до остановки кровотечения. Возможно использование для остановки кровотечения активированного фактора VIIa, однако это не подкреплено надежными клиническими исследованиями, такое применение не указано в инструкции к препарату.
Снижение активности системной воспалительной реакции – «цитокинового шторма» является одной из актуальных проблем лечения пациентов с COVID–19, поскольку этот процесс запускает патофизиологические механизмы коагуляционного каскада и повреждения легких [Canada.ca. 2019 novel coronavirus: Symptoms and treatment The official website of the Governmentof Canada]. Международные и национальные рекомендации отдают приоритет в лечении данного проявления COVID-19 иммунодепрессантам из группы моноклональных антител (тоцилизумаб и сарилумаб), в качестве препаратов второго ряда возможно применение ингибиторов ИЛ-1 [Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Временные методические рекомендации. Версия 7 (3.06.2020).]. У пациентов со средне-тяжелым течением коронавирусной инфекции рассматривается возможность применения ингибиторов янус-киназ (барицитиниб и тофацитиниб) – в качестве дополнительной терапии.
В тоже время международные рекомендации не рекомендуют рутинное применение ГКС, обосновывая эту рекомендацию отсутствием положительного эффекта от применения ГКС при ведении больных с другими вирусными поражениями легких [Auyeung T.W., Lee J.S., Lai W., etal. The use of corticosteroid as treatment in SARS was associated with adverse outcomes: a retrospective cohort study. J. Inf. Secur., 51 (2005), pp. 98-102.] [Ho J.C., Ooi G.C., Mok T.Y., et al. High-dose pulse versus nonpulse corticosteroid regimens in severe acute respiratory syndrome. Am. J. Respir. Crit. Care Med., 168 (2003), p. 1449-1456] вследствие увеличения периода вирусной нагрузки и летальности. Однако, этот вывод основывается на результатах ведения больных с гриппом, SARS-CoV и MERS-CoV, что неприменимо к инфекции, вызванной SARS-CoV-2. Вероятно, низкий эффект ГКС, наблюдающийся в ранних наблюдениях при ведении пациентов с COVID19 связан с применением низких доз метилпреднизолона.
Рекомендуется использовать пульс-терапию метилпреднизолоном по 500 мг в сутки в/в в течение 2-3 дней (на курс 1-1,5 г метилпреднизолона в/в) с целью снижения активности системной воспалительной реакции у больных со средне-тяжелым и тяжелым течением новой коронавирусной инфекции [Глюкокортикостероиды при COVID-19. Наш опыт и новый взгляд на ведение больных. Информационное письмо МАСРМ]. Привлечение данного метода позволяет остановить процесс, «удержать» пациента на самом важном этапе – когда достаточным уровнем респираторной поддержки является оксигенотерапия с потоком 5-10 л/мин. На фоне применения ГКС улучшаются показатели газообмена, отмечается уменьшение степени выраженности коагуляционных нарушений, что также способствует восстановлению оксигенирующей функции легких.
Упреждающая противовоспалительная терапия должна быть рассмотрена при сохраняющейся лихорадке выше 38-39°С в течение 5-7 дней при наличии, как минимум, одного из следующих критериев: 1) появление признаков дыхательной недостаточности (снижение SpO2 ниже 90% при дыхании атмосферным воздухом и др.); 2) прогрессирующее поражение легких по результатам КТ; 3) повышение уровня СРБ выше 50 мг/л; 4) повышение уровня ферритина > 500 нг/мл; 5) уровень ИЛ-6 > 30 пк/мл. У пациентов с длительной лихорадкой и прогрессирующими изменениями в легких на уровне КТ 1-2 без дыхательной недостаточности рекомендованы дексаметазон 12 мг в сутки в течение 3 – х дней. У больных с длительной лихорадкой и прогрессирующим поражением легких на уровне КТ 3-4 с признаками дыхательной недостаточности, уровнем СРБ более 50 мг/л рекомендовано использование моноклональных антител (тоцилизумаб, сарилумаб) или более высоких доз ГКС – пульс-терапия метилпреднизолоном 500 мг в сутки в течение 2-3 дней [Зайцев А.А., Чернов С.А., Стец В.В., с соавт. Алгоритмы ведения пациентов с новой коронавирусной инфекцией COVID-19 в стационаре. (Методические рекомендации). М.: ГВКГ имени Н.Н. Бурденко 2020, 16 с.].
Плазмаферез показан широкому кругу больных с тяжелым течением вирусного заболевания. Показания к плазмаферезу:
- cохраняющаяся лихорадка выше 38-39°С в течение 5-7 дней,
- появление на фоне стабильного течения болезни или нарастание признаков дыхательной недостаточности на фоне проводимой терапии,
- быстропрогрессирующее поражение легких по результатам КТ,
- нарастание уровня СРБ, нарастание уровня D-димера, уровень фибриногена выше 8 г/л, продолжающийся рост уровня растворимых комплексов фибрин-мономеров,
- неэффективность проводимой антикоагулянтной терапии по хронометрическим параметрам (гепаринорезистентность) не смотря на трансфузии СЗП,
- появление или нарастание полиорганной недостаточности,
- отсутствие положительной динамики в разрешении нарушенной функции органов, в том числе – дыхательной системы, почек,
- проявления васкулита, в том числе – с поражением нервной системы (некротическая энцефалопатия),
- гемодинамический (септический) шок.
Сообщения об эффективности плазмафереза при тяжелом течении вирусной респираторной инфекции носят характер сообщений о случаях лечения. Так об эффективности плазмафереза сообщает Adeli, S. H., et al. (Using therapeutic plasma exchange as a rescue therapy in CoVID-19 patients: a case series. Pol Arch Intern Med.): у 8 пациентов с COVID-19 не наблюдалось уменьшения выраженности симптомов (гипоксемии), не смотря на проводимую комплексную терапию, включавшую глюкокртикостероиды по 4 мг дексаметазона в сутки. Всем больным методом фильтрации удаляли 2 литра плазмы с замещением СЗП, альбумином и физиологическим раствором. Первый пациент умер, что авторы сообщения связали с поздним началом плазмафереза. Эффективность у 7 пациентов расценили как очень высокую: серез 2недели у 5 пациентов не было никаких проблем, и 2 пациента получали лишь лекарства от гипергликемии. Авторы расценили плазмаферез как спасительное лечение.
Вот выдержка из Методических рекомендаций «Анестезиолого-реанимационное обеспечение пациентов с новой коронавирусной инфекцией COVID-19» (апрель 2020): «233. У пациентов с НКИ COVID-19 при наличии признаков гемофагоцитарного синдрома, ДВС синдрома, тромботической микроангиопатии рекомендуется рассмотреть использование плазмообмена с замещением свежезамороженной донорской плазмой (СЗП), а при отсутствии достаточного объема СЗП – плазмообмена с плазмосорбцией.
Комментарий. Плазмообмен – плазмаферез с объемом эксфузии плазмы > 70% объема циркулирующей плазмы. Диагноз вторичного гемофагоцитарного синдрома может быть поставлен на основе шкалы HSores, имеющей чувствительность 93%, специфичность 86%. Вторичный гемофагоцитарный синдром (синоним синдром активации макрофагов) характеризуется молниеносной гиперцитокинемией, вызывающей полиорганную недостаточность. Около 50% больных имеют поражение легких, включая острый респираторный дистресс-синдром (основная причина смерти пациентов с коронавирусной инфекцией), около 30% – поражение почек. Использование плазмообмена в настоящее время включено в клинические рекомендации по лечению НКИ COVID-19 в ряде стран (Китай, США и др.), входит в рекомендации Американского общества афереза 2019 года, подтвержденные публикациями, при лечении гемофагоциатрного синдрома и тромботических микроангиопатий. Имеются отдельные исследования об использовании плазмообмена в комплексном лечении диссеминированных вирусных инфекций, в том числе при пандемии гриппа H1N1.
234. У пациентов с НКИ COVID-19 рекомендуется рассмотреть применение плазмообмена до развития выраженных органных дисфункций.
Комментарии. При наличии возможностей с целью повышения удаления факторов патогенеза, селективности и безопасности вместо плазмообмена могут быть выполнены селективная плазмофильтрация или каскадная плазмофильтрация. При селективной плазмофильтрации более эффективно удаляются цитокины (интерлейкин 6) и небольшие белки с молекулярной массой меньше 60 кДа, при каскадной плазмофильтрации – крупные молекулы (С-реактивный белок, ферритин и др.), бактерии, вирусы и вирус-содержащие частицы»
Нужно отметить, что новелла плазмафереза в целом никак не увязана в данных рекомендациях с новеллой ДВС-синдрома, хотя он упоминается в перечислении показаний. Применение изолированной гепаринотерапии увязана с гиперокоагуляцией и гиперфибриногенемией, что является ошибкой с позиции патогенеза развития патологии. Именно представления о патогенезе ДВС-синдрома как о результате тяжелого эндотелиоза с микротромбозом, вызванный чрезмерной продукцией мультимеров фактора Виллебранда из-за эндотелиопатии и относительной недостаточностью ADAMTS13, является обоснованием мнения, что единственным доступным антимикротромботическим режимом является плазмаферез. Максимально раннее вмешательство с использованием плазмафереза является единственным потенциально эффективным средством для спасения жизней. В противном случае, после того, как пациент укоренится в искусственной вентиляции легких с перегрузкой объемом после внутривенного введения жидкости, выздоровление от ОРДС может стать проблематичным даже с применением плазмафереза.
Существует несколько методик проведения плазмафереза. В условиях массового поступления и отсутствия необходимого оборудования допустимо применение отстаивание забранной у больного крови в контейнере (объем – 500 мл) в течение 1 часа, с удалением супернатанта путем механического выдавливания контейнера любым плоским предметом (в отсутствие плазмаэкстрактора). Таким образом за несколько часов «ручным плазмаферезом» можно удалить до 700-1000 мл плазмы. Аналогично можно подвесить контейнер с кровью и удалить супернатант, используя силу гравитации и механизм сифона. Этот метод называется «ручным плазмаферезом».
Чаще используют метод плазмафереза с использованием центрифуг – прерывистый плазмаферез. В этом случае седиментация эритроцитов происходит обычно за 10 минут. Имеются специальные центрифужные сепараторы, позволяющие удалять плазму в непрерывном режиме и в большем объеме. Имеются технологии фильтрационного плазмафереза, где сепарация плазмы происходит на специальных полу-проницаемых мембранах с высокой порозностью.
Применение малообъемных процедур плазмафереза (менее 750 мл) при серьезной патологии привело к серьезной дискредитации направления в целом. Вместе с тем считается (и это подкреплено математическими расчетами), что удаление одномоментно более 1200-1500 мл циркулирующей плазмы не приносит дополнительного клинического эффекта. Вместе с тем, показана эффективность проведения двукратного в течение суток плазмафереза при сепсисе в относительно небольших объемах (750-900 мл), когда после первой процедуры происходит разблокирование микроциркуляции и дренирование тканей, а повторная процедура позволяет удалить появившиеся в кровотоке патологические продукты.
При проведении плазмафереза не менее половины удаленного объема плазмы больного должно быть заменено свежезамороженной донорской плазмой.
Источник
