Фармакотерапия болевого синдрома в онкологии
23 апреля 2019 г.
Просмотров: 2249
Согласно определению Международной ассоциации по изучению боли (IASP), к хронической относят боль, которая сохраняется более 3 месяцев. Это достаточно типичная ситуация для онкологического больного. При прогрессировании опухолевого процесса хроническая боль отягощает жизнь пациента и окружающих его людей, представляет серьезную медицинскую и социальную проблему. У онкологических пациентов болевые ощущения не являются временными или преходящими, в них нет биологической целесообразности, они не играют защитной роли. Возникшая у онкологического пациента боль ведет к дезадаптации, к ненормальному восприятию болевых импульсов и сопровождается различными нарушениями функции центральной нервной системы (ЦНС).
Клиническая картина болевого синдрома зависит от локализации очага поражения, патогенетического типа боли, индивидуального порога болевой чувствительности, предшествующего болевого опыта.
Этиология
Выделяют следующие основные причины хронической боли у онкологических больных:
- боль, вызванная самой опухолью (поражение костей, мягких тканей, кожи, внутренних органов, органов пищеварительной системы, окклюзия сосудов и др.);
- боль при осложнениях опухолевого процесса (патологический перелом, некроз, изъязвление, воспаление, инфицирование тканей и органов, тромбозы);
- боль при паранеопластических синдромах (артро-, нейро- и миопатии);
- боль как следствие астенизации (пролежни, трофические язвы, запор);
- боль, обусловленная противоопухолевым лечением:
- при осложнениях хирургического лечения рака (фантомная боль, боли при спайках, рубцах, отеках);
- при осложнениях химиотерапии (мукозиты, полинейропатия, генерализованная миалгия, асептический некроз, артралгии);
- при реакциях и осложнениях лучевой терапии (поражение кожи и слизистых оболочек, костей, фиброз, неврит, плексит, миелопатия и др.).
Типы боли и механизм их развития
Выделяют три патогенетических типа боли: ноцицептивный, нейропатический и психогенный. При ноцицептивном типе боли происходит раздражение специфических периферических болевых рецепторов (ноцицепторов), которые расположены во всех органах и тканях: в коже, слизистых оболочках, стенках полых органов, капсулах паренхиматозных органов, в костях и надкостнице.
Повреждения, сопровождающие опухоли, приводят к деструкции клеточных мембран, в результате этого запускается цепь гистохимических реакций с высвобождением тканевых альгогенов, к числу которых в настоящее время относят более 30 различных субстанций. Важнейшими из них принято считать простагландин Е2 (ПГЕ2), гистамин, серотонин и другие биоактивные вещества. В патологическом очаге также активны альгогены, поступающие из плазмы. К ним относятся брадикинин и каллидин. Как плазменные, так и тканевые альгогены взаимодействуют с соответствующими структурами на поверхности болевых рецепторов,резко повышая их чувствительность.
Особенность формирования ноцицептивной боли при онкологическом процессе — способность болевых рецепторов активироваться не только при взаимодействии с воспалительными альгогенами, но и при воздействии на них специфических опухолевых факторов, что способствует усилению потока болевых импульсов. При этом ноцицепторы взаимодействуют как с продуктами метаболизма опухолевых клеток, так и с факторами повреждения или воспаления тканей. На ноцицепторы при онкологической боли воздействуют внеклеточные ионы водорода Н+, эндотелин 1, интерлейкины разных типов и фактор некроза опухоли.
В результате этих разнообразных и частых воздействий генерируются болевые импульсы. По афферентным нервным волокнам болевой импульс поступает в задние рога спинного мозга, откуда по спиноталамическому тракту — в вышележащие отделы ЦНС, ядра таламуса. В дальнейшем вся сенсорная болевая информация поступает в нейроны серого вещества проекционных зон коры больших полушарий, где происходят ее обобщение, обработка и анализ (перцепция), после чего организм осознает боль и степень опасности произошедшего повреждения.
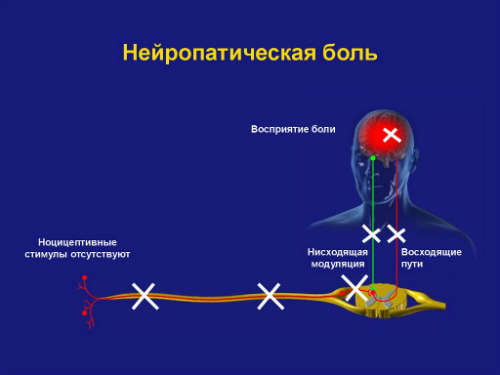
Нейропатическая боль имеет принципиальное отличие от ноцицептивной в механизмах формирования. Нейропатическая боль у онкологических пациентов может возникать как результат повреждений на разных уровнях нервной системы — от периферических нервов до нейронов коры головного мозга.
При повреждении головного или спинного мозга развивается центральная нейропатическая боль. При повреждениях структур периферической нервной системы (корешков спинномозговых нервов, нервных сплетений, периферических нервов) развивается периферическая нейропатическая боль.
Нейропатическая боль у онкологических пациентов часто гетерогенна, так как может иметь одновременно несколько причин, например, компрессия нервов (79%), деафферентационное повреждение нервов (16%), симпатически усиленная боль (5%). Симпатически усиленная боль — каузалгия, которая проявляется локальной вазодилатацией, гипертермией, повышенным потоотделением, трофическими расстройствами, извращенными сенсорными реакциями.
Опухоли, неудержимо разрастаясь в объеме, способны сдавливать структуры периферической нервной системы либо прорастать непосредственно в нервные сплетения, корешки и ветви периферических нервов, вызывая боль, нарушая сенсорную и моторную функции. Длительно существующая опухолевая компрессия, как и инфильтрация нервных структур, приводит к повреждению волокон нерва, вызывая дегенеративные изменения и деафферентацию (централизацию) боли.
Нейропатическая боль у онкологического больного может сопровождаться разнообразной неврологической симптоматикой, в которой присутствуют симптомы усиления чувствительности: жгучая или простреливающая боль высокой интенсивности, гиперестезия, гипералгезия, боль в ответ на неболевое раздражение (аллодиния), симптомы выпадения или ослабления сенсорных ощущений.
Психогенная боль возникает в ответ на индивидуальное эмоционально значимое переживание (депрессия, стресс, страх, истерия, бред, боли, галлюцинации и т.п.). Эти эмоциональные проявления могут вызывать изменения в симпато-адреналовой системе, системе выработки гипофизарных гормонов, что ведет к дисбалансу в работе висцеральных систем.
Лекарственная терапия хронической онкологической боли
Основным методом симптоматического лечения хронической боли онкологического генеза является системная фармакотерапия. Принципы медикаментозного лечения хронической боли включают следующие основные положения:
- подход к назначению лечения должен быть индивидуализированным;
- выбор препарата осуществляется в зависимости от патофизиологического типа и ее интенсивности;
- лечение осуществляется «по восходящей» в соответствии с «анальгетической лестницей ВОЗ»;
- преимущество отдается неинвазивным путям введения препаратов (пероральному и трансдермальному) и соответствующим лекарственным формам анальгетиков;
- препараты следует назначать в фиксированное время суток, «по часам», а не «по требованию»;
- препараты следует назначать в адекватных дозах;
- необходимо предотвращать развитие нежелательных эффектов и бороться с ними при их возникновении.
При лечении ноцицептивной боли ВОЗ рекомендует трехступенчатую схему использования анальгетиков («анальгетическую лестницу ВОЗ»). На первой ступени обезболивания, при наличии слабой боли, назначают препараты неопиоидного ряда, ненаркотические анальгетики (парацетамол,метамизол) или НПВП. При усилении боли и недостаточной эффективности ненаркотических анальгетиков и НПВП к ним добавляют сначала слабые (трамадол, кодеин, дигидрокодеин), а затем сильные опиоиды (бупренорфин, морфин, оксикодон, фентанил). Также при наличии тех или иных симптомов или при развитии нежелательных явлений от применения анальгетиков в терапию включаются адъювантные средства.
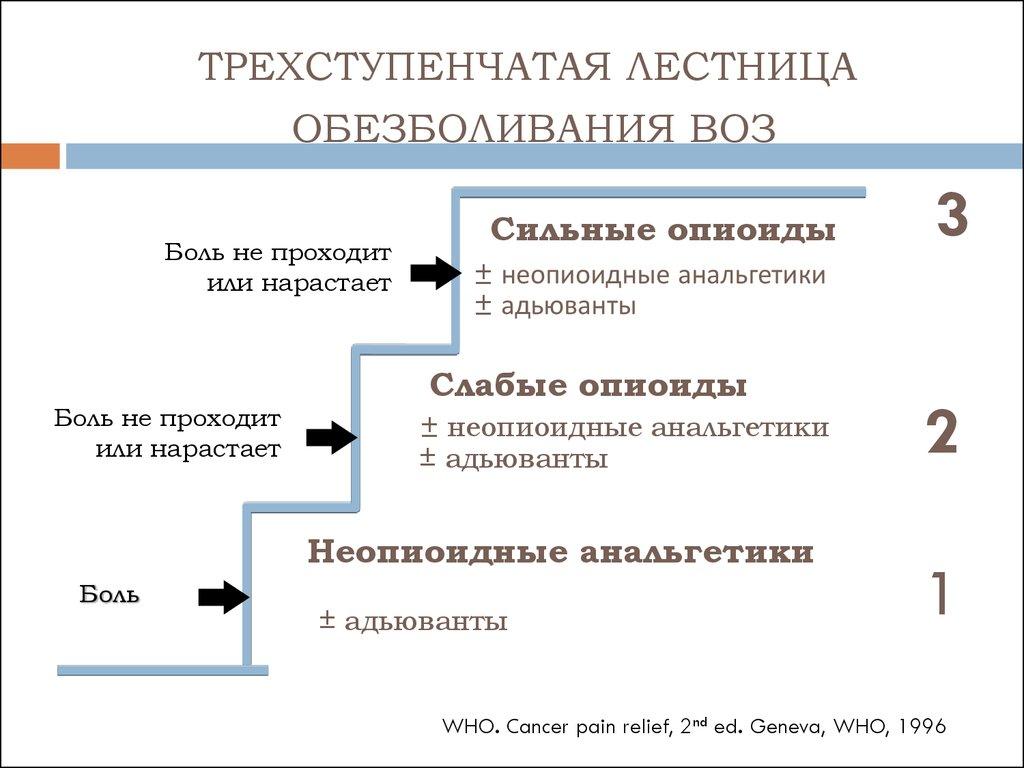
«Анальгетическая лестница ВОЗ»
1-я ступень НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
2-я ступень СЛАБЫЙ ОПИАТ + НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
3-я ступень СИЛЬНОДЕЙСТВУЮЩИЙ ОПИАТ + НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
В целом такая тактика лечения хронической боли позволяет достичь удовлетворительного обезболивания у 77-90% онкологических больных. В России зарегистрированы основные лекарственные препараты как из группы НПВП, так и из группы опиоидов для лечения хронической боли, рекомендуемые ВОЗ.
По мнению экспертов ВОЗ, для длительной терапии хронической боли анальгетики следует использовать в удобных для пациентов неинвазивных формах, предназначенных для введения: внутрь, трансбуккально, подъязычно, трансдермально, ректально.
Для длительной плановой терапии предпочтительны в лекарственные формы продленного действия (депо-формы).
К 1-й ступени «лестницы обезболивания» ВОЗ относят препараты из группы ненаркотических анальгетиков (парацетамол, метамизол) и препараты из группы НПВП (кеторолак, диклофенак, кетопрофен, лорноксикам, нимесулид, мелоксикам, целекоксиб).
Применение НПВП показано на всех этапах терапии боли у онкологических больных. У больных с опухолями и/или метастазами, поражающими мягкие ткани и кости, всегда развивается выраженное перифокальное воспаление. В начале 70-х годов ХХ века было установлено, что болеутоляющее, жаропонижающее и противовоспалительное действие НПВП обусловлено подавлением синтеза простагландинов. НПВП снижают продукцию простагландинов за счет ингибирования фермента циклооксигеназы (ЦОГ).

На сегодня выделяют три изоформы ЦОГ. Считают, что избирательное угнетение ЦОГ-2 приводит к подавлению воспаления и боли. В то же время сохранение активности ЦОГ-1 определяет репаративные процессы в желудке, кровоток в почках. Было отмечено, что парацетамол и метамизол слабо влияют на синтез простагландинов в периферических тканях, но подавляют продукцию простагландинов в ЦНС. В последние годы появились сведения о том, что в ЦНС имеется третий, отличный от первых двух тип ЦОГ, названный ЦОГ-3. Ингибирование ЦОГ-3 головного мозга сопровождается подавлением боли и снижением температуры тела при лихорадке.
Все НПВП могут вызывать осложнения со стороны желудочно-кишечного тракта (ЖКТ): диспепсию, язвы, кровотечения и перфорацию верхних и нижних отделов ЖКТ, железодефицитную анемию.
Все НПВП могут вызывать осложнения со стороны сердечно-сосудистой системы (ССС): дестабилизацию артериальной гипертензиии сердечной недостаточности, повышают риск «кардиоваскулярных катастроф» (инфаркт миокарда, ишемический инсульт) и летальности.
Все НПВП могут оказывать негативное влияние на функцию почек и печени (особенно при наличии заболеваний последних), а в ряде случаев вызывать серьезные нефро- и гепатотоксические реакции.
Препараты группы противопоказаны при эрозивно-язвенных поражениях желудочно-кишечного тракта (ЖКТ) в стадии обострения, состояниях гипокоагуляции (в том числе при гемофилии, геморрагическом диатезе, тромбоцитопении), при бронхиальной астме, тяжелой хронической сердечной недостаточности, гиповолемии, тяжелой почечной и печеночной недостаточности, состояниях, сопровождающихся гиперкалиемией, могут вызвать обострение и осложнения воспалительных заболеваний кишечника (ВЗК).
НПВП могут вызывать кожные реакции и бронхоспазм. Риск развития осложнений со стороны указанных органов и систем существенно отличается при использовании различных НПВП. Для предотвращения осложнений необходим учет факторов риска и выбор наиболее безопасного НПВП.
Для снижения риска развития НПВП гастропатии необходимо дополнительное назначение препаратов из группы ингибиторов протонной помпы и применение низких доз аспирина для снижения риска кардиоваскулярных осложнений. В настоящее время НПВП классифицируются по степени селективности ингибирующей активности в отношении разных изоформ ЦОГ.
В клинике «Медицина 24/7» работает круглосуточный хоспис для онкологических больных. Весь коллектив клиники работает на то, чтобы продлить жизнь человека и устранить болезненные симптомы. Наши врачи назначают и проводят паллиативное лечение для облегчения состояния пациента, а также подбирают наиболее подходящую схему обезболивания. Наши медсестры и санитарки готовы обеспечить достойный уход пациенту на терминальной стадии рака.
Литература:
- Исакова М.Е. Болевой синдром в онкологии. — М.: Практическая медицина, 2011. — 384 с.
- Каприн А.Д., Абузарова Г.Р., Хороненко В.Э. и др. Фармакотерапия хронического болевого синдрома у онкологических пациентов. Медицинская технология. — М.: МНИОИим. П.А. Герцена, 2015. — 48 с.
- Машфорт М.Л., Купер М.Г., Кохен М.Л. и др. Боль и аналгезия. Руководство для практикующих врачей / Перевод сангл. А.Н. Редькин; ред. рус. изд. Бунятян А.А., НасоновЕ.Л., Никода В.В. — М.: Литтерра, 2004. — 488 с.
- Новиков Г.А., Осипова Н.А. Лечение хронической боли онкологического генеза: учебное пособие. Москва. — 83 с.
- Новиков Г.А. Контроль симптомов в паллиативной медицине. — М.: ГЭОТАР-Медиа, 2013. — 248 с.
- Осипова Н.А., Абузарова Г.Р., Петрова В.В. Принципы клинического применения наркотических и ненаркотических аналгетических средств при острой и хронической боли. Методические указания. Практическое руководство для врачей. М., 2005. — 79 с.
- Штрибель Х.В. Терапия хронической боли. Практическое руководство / Пер. с нем.; ред. Осипова Н.А., ДаниловаА.Б., Осипова В.В. — М.: ГЭОТАР-Медиа, 2005. — 303 с.
- Ahmedzai S.H., Leppert W., Janecki M., Pakosz A., LomaxM., Duerr H., Hopp M.
- Long-term safety and efficacy of oxycodone/naloxoneprolonged-release tablets in patients with moderate-to-severechronic cancer pain. Support Care Cancer. 2015 Mar; 23 (3):823-30.
- Caraceni A., Hanks G., Kaasa S. et al. Use of opioid analgesicsin the treatment of cancer pain: evidence-basedrecommendations from the EAPC // Lancet Oncol. 2012 Feb;13 (2): e 58-68.
- Mystakidou K., Parpa E., Tsilika E. et al. Pain management ofcancer patients with transdermal fentanyl: a study of 1828 stepI, II, & III transfers. // J. Pain. 2004; 5: 119–13212. Skaer T.L. Transdermal opioids for cancer pain. // HealthQual. Life Outcomes. 2006 Mar 31; 4: 2413. World Health Organization. Cancer pain relief: with a guide toopioid availability. 2. Geneva: WHO; 1996.14. Zech D.F., Grond S., Lynch J., Hertel D., Lehmann K.A.Validation of World Health Organization guidelines forcancer pain relief: A 10-year prospective study. Pain. 1995;63: 65–76.
Источник: Научно-практический журнал «Паллиативная медицина и реабилитация» № 1. 2018.
Источник
Зачастую первым и единственным симптомом онкологических заболеваний является боль. Она причиняет пациенту мучения, снижает качество жизни, приводит к депрессивным расстройствам, суицидальным намерениям и действиям.
Борьба с болевым синдромом — актуальная проблема в онкологии. Для того чтобы эффективно справиться с болью, врач должен правильно оценить ее причины, характер, интенсивность.
В Европейской клинике направление медицины боли развито очень хорошо. Наши врачи применяют все доступные методы, в том числе инновационные.
Трехступенчатая система коррекции болевого синдрома
Основным методом лечения боли в онкологии является медикаментозная терапия. В практике работы Европейской клиники используется трехступенчатая система обезболивания из ненаркотических и наркотических анальгетиков, которая позволяет эффективно купировать болевой синдром и держать его под контролем. Мы учитываем рекомендации Всемирного института боли (FIPP WIP, USA), Европейской Федерации Международной Ассоциации Изучения Боли (EF IASP).
Метод заключается в последовательном применении анальгетиков возрастающей силы действия в сочетании с адъювантной терапией по мере увеличения интенсивности боли. Важным принципом является начало фармакотерапии немедленно при появлении первых же признаков боли, пока не развилась сложная цепная реакция, которая приводит к хроническому болевому синдрому. Переход на более сильное обезболивающее производится, когда все препараты предыдущей ступени неэффективны в своих максимальных дозировках.
- На первой ступени при легкой боли эффективны нестероидные противовоспалительные средства (НПВСП).
- На второй ступени при умеренной боли применяются препараты, которые содержат комбинацию слабых опиатов и ненаркотических анальгетиков. К первым относят дионин, трамадол, промедол, проседол, трамал. Чаще всего применяется трамадол из-за высокой эффективности и удобства применения.
- На третьей ступени при сильной боли назначаются наркотические анальгетики: бупренорфин, морфин, фентанил, омнопон.
На любом этапе противоболевой терапии анальгетики необходимо принимать постоянно по часам. Доза корректируется с учетом вида и интенсивности болевых ощущений. Если препарат становится неэффективным, желательно заменить его на альтернативное средство аналогичной силы, но рекомендовать его пациенту, как более мощное.
В качестве анальгетиков часто применяют кортикостероиды — препараты гормонов коры надпочечников. Они оказывают мощное противовоспалительное действие, особенно важное при болях, вызванных компрессией нерва, при головной боли, обусловленной внутричерепной гипертензией, а также костных болях.
Анестезиолог-реаниматолог Вадим Сергеевич Соловьев об опиоидных анальгетиках:
Наши врачи следуют принципам терапии боли, провозглашенным ВОЗ:
- «Через рот» (перорально) — означает, что следует исключить все инъекционные формы анальгетиков, проводить терапию с использованием неинвазивных лекарственных форм (таблетки, капсулы, сиропы, трансдермальные терапевтические системы, ректальные формы препаратов и т. д.).
- «По часам» — анальгетики следует назначать регулярно по схеме, в соответствии с длительностью эффекта препарата, не дожидаясь развития сильной боли, исключая возможность «прорывов» боли.
- «По восходящей» — подбор препаратов для обезболивания осуществляется от неопиоидных анальгетиков при слабой боли, «мягкими» опиоидами при умеренной боли и сильными опиоидными анальгетиками при сильной боли, по мере нарастания интенсивности боли, в соответствии с «лестницей обезболивания ВОЗ»
- «Индивидуальный подход» — предполагает необходимость «индивидуального» подбора анальгетика и основан на селективном выборе наиболее эффективного анальгетика в нужной дозе с наименьшими побочными эффектами для каждого конкретного пациента с учетом особенностей его физического состояния.
- «С вниманием к деталям» — предполагает учет особенностей и деталей каждого пациента, безусловно, назначение ко-анальгетиков и адъювантных средств, по мере возникновения необходимости в них, проведение мониторинга за больными.
Как облегчить боль: описание этапов трехступенчатой схемы
Терапия «слабой боли»
Пациенту назначают неопиоидные анальгетики: НПВС (Ибупрофен, Диклофенак, Кетопрофен и пр.), Парацетамол. При выборе препарата учитываются токсичность для печени и почек, присущие всем неопиоидным анальгетикам, а также токсичность для желудка неселективных НПВС, риски со стороны сердечно-сосудистой системы при применении селективных НПВС. Применение препаратов первой линии целесообразно сопровождать адъювантной и симптоматической терапией: блокаторы ионной помпы, кортикостероиды, спазмолитики, бензодиазепины, антигистаминные препараты и др.
Терапия «умеренной» боли
Пероральный путь введения препаратов является предпочтительным, если пациент может принимать препараты через рот. Для пациентов со слабой или умеренно выраженной болью, у которых адекватный контроль боли не достигается регулярным пероральным приемом парацетамола или нестероидных противовоспалительных препаратов, добавление опиоидного анальгетика может обеспечить достижение эффективного обезболивания без неблагоприятных побочных эффектов. В качестве альтернативы возможно использование низких доз опиоидных анальгетиков (например, морфина, ТТС фентанила).
Терапия «сильной» боли
Если боль интенсивная, и опиоидный анальгетик в сочетании с НПВС или Парацетамолом неэффективен, следует начинать терапию сильными опиоидными анальгетиками. Если они были назначены при умеренной боли, нужно повышать дозу препарата до эффективной. Зарегистрированными пролонгированными формами сильных опиоидных анальгетиков в нашей стране и используемых в нашей клинике являются: морфин в капсулах и в таблетках, ТТС фентанила.
Как часто возникает боль при раке?
Боль возникает у 30% больных раком, которые получают лечение, и у 60–90% больных в связи с прогрессированием болезни. Основные источники возникновения боли при раке:
- собственно рак (45–90%);
- сопутствующие воспалительные реакции, приводящие к спазму гладкой мускулатуры (11–25%);
- боль в области послеоперационной ране после хирургического вмешательства (5–16%);
- сопутствующая патология, например, поражения суставов, артрит (6–11%), невралгия (5–15%).
Болевые синдромы при раке группируют:
- По происхождению болевого потока: висцеральные, соматические, невропатические, психогенные.
- По качественной субъективной оценке: жгучие, колющие, режущие, сверлящие, пульсирующие.
- По интенсивности: оценивают по специальным шкалам.
- По продолжительности: острые и хронические.
- По локализации: абдоминальные, кардиалгии, люмбалгии, мышечно-суставные и другие.
В связи со значительными различиями механизмов возникновения болевых ощущений, не существует универсального анальгетика для купирования всех видов болевых синдромов. Лечение всегда должно быть индивидуальным.
В чем причина неудач в лечении боли?
В силу отсутствия специальной подготовки по лечению боли даже у онкологов, а также в силу восприятия рака как инкурабельного заболевания, даже врачи-специалисты зачастую не осознают, что болью при раке можно управлять.
У 80–90% пациентов боль можно полностью ликвидировать, а у остальных ее интенсивность можно значительно ослабить. Для этого врачу необходимо учитывать каждый из источников и механизмов боли для подбора адекватной обезболивающей терапии при раке.
В клинической практике мы постоянно сталкиваемся с типичными ошибками при лечении болевого синдрома: неоправданно ранним назначением наркотических анальгетиков, применение чрезмерных дозировок препаратов, несоблюдение режима назначения анальгетиков.
Технологии управления хроническими болевыми синдромами
Европейская клиника оснащена всем необходимым оборудованием, включая индивидуальные носимые помпы, аппараты для дозированного введения. Клиника имеет требуемые законодательством Российской Федерации лицензии и разрешения. У нас функционирует хорошо оснащенное отделение терапии болевых синдромов, в нем работают врачи-специалисты в области медицины боли.

Воспользуйтесь быстрыми ссылками, чтобы узнать об интересующем вас методе обезболивания:
- Обезболивающие пластыри
- Спинальная анестезия
- Эпидуральная анестезия
- Катетеризационные методики
- Нейролизис через ЖКТ при помощи эндосонографии
- Введение препаратов в миофасциальные триггерные пункты
- Фасциальные блокады и блокады нервов и сплетений
- Радиочастотная абляция
- Нейрохирургические вмешательства
- Анальгезия, контролируемая пациентом (PCA)
Обезболивание при раке 4 стадии позволяет значительно улучшить качество жизни пациента, уменьшить, а в большинстве случаев предотвратить страдания. Это помогает подарить неизлечимому больному дополнительное время, в течение которого он может активно общаться с родными и близкими, провести последние дни жизни без мучительных симптомов.
Обезболивающие пластыри
Это способ трансдермального введения препарата. Пластырь содержит четыре слоя: защитная полиэфирная пленка, резервуар с действующим веществом (например, с фентанилом), мембрана, корректирующая интенсивность выделения и липкий слой. Пластырь можно наклеить в любом месте. Фентанил высвобождается постепенно на протяжении 3 суток. Действие наступает уже через 12 часов, после удаления концентрация лекарственного вещества в крови медленно снижается. Дозировка может быть разная, ее подбирают индивидуально. Пластырь назначают, как правило, в самом начале третьей ступени обезболивания при онкологии.
Спинальная анестезия
При спинальной анестезии лекарство вводят в спинномозговой канал, субарахноидально. Это приводит к временному «выключению» тактильной и болевой чувствительности. Введение требует от врача определенного опыта. В качестве средств для обезболивания используют местные анестетики и опиоидные анальгетики. Эффект длительный и выраженный. В основном используется при оперативных вмешательствах, при острой, невыносимой боли, имеет ряд побочных эффектов на сердечно-сосудистую, дыхательную системы.
Эпидуральная анестезия
Более щадящий по сравнению с предыдущим метод. Лекарство вводят в пространство, где формируются спинномозговые нервы. Препараты аналогичны спинальной анестезии. Эпидуральная анестезия используется, чтобы на долгое время снять боль, когда оральный и парентеральный методы введения уже не приносят результатов.
Катетеризационные методики
Катетеризационные методики позволяют обеспечивать длительное качественное обезболивание. Внедрение постановки порт-систем в эпидуральное и субарахноидальное пространство с применением местных, наркотических и адъювантных препаратов позволяют на продолжительное время избавится от болевого синдрома и снизить применение других анальгетиков, имеющих свои побочные эффекты.
Нейролизис через ЖКТ при помощи эндосонографии
Нейролизис (невролиз) — это процесс разрушения ноцицептивного (болевого) нервного пути.
Одним из наиболее эффективных методов является нейролизис чревного (солнечного) сплетения, которое располагается в забрюшинном пространстве в верхнем отделе живота и осуществляет иннервацию органов брюшной полости: желудка, печени, желчевыводящих путей, поджелудочной железы, селезенки, почек, надпочечников, толстого и тонкого кишечника до селезеночного изгиба.
Введение анальгетика происходит трансгастрально — через ЖКТ, точность обеспечивает эндоскопический ультразвуковой контроль. Такие методы местного обезболивания применяются, к примеру, при раке поджелудочной железы с эффективностью до 90%. Обезболивающий эффект способен сохраняться более нескольких месяцев, в то время как наркотические анальгетики классическим способом пришлось бы вводить постоянно.
Введение препаратов в миофасциальные триггерные пункты
Миофасциальный болевой синдром выражается в спазме мышц и появлении в напряженных мышцах болезненных уплотнений. Они называются триггерными точками и болезненны при нажатии. Инъекции в триггерную зону снимают боль и улучшают подвижность участка тела. Цель инъекций в триггерные точки — «разорвать» болевой круг «боль-спазм-боль». Ими с успехом лечат спазмы множества групп мышц, особенно в области рук, ног, поясничного отдела и шеи, головы. Часто используют в качестве дополнительной терапии при фибромиалгиях и головных болях напряжения.
Фасциальные блокады и блокады нервов и сплетений
Такой же качественный эффект обеспечивают фасциальные блокады и блокады нервов и сплетений.
Блокада нерва или нервного сплетения предусматривает введение препарата около нерва, который связан с пораженным органом и вызывает боль. Процедуры периферических блокад выполняются опытными специалистами при помощи ультразвуковой навигации, что позволяет более точно вводить анальгетический препарат в необходимое место, не затрагивая и не повреждая нервные структуры.
Использование в процессе блокады гормональных препаратов позволяет устранить боль на долгое время, а многократная блокада может убрать боль на несколько месяцев. В зависимости от вида анестетика, процедуру проводят раз в год, раз в полгода или каждую неделю. Еще один плюс — минимальное количество негативных последствий.
Радиочастотная абляция
В основе этой технологии лежит выборочная термокоагуляция определенных нервов специальными электродами. Зона поражения аккуратно контролируется, позволяя воздействовать на очень небольшие участки, не повреждая расположенные рядом двигательные и чувствительные нервы. Восстановление после процедуры происходит очень быстро и почти без последствий, что позволяет пациенту вернуться к нормальной жизни.
Процедура может выполняться без госпитализации. Радиочастотное разрушение дает длительный эффект, который может длиться до года и более.
Частота развития осложнений и побочных эффектов очень мала. Если боль возобновляется, лечение может быть проведено повторно.
Пациенты с очевидными психическими нарушениями, с вторичными болями или наркотической зависимостью — это неподходящий контингент для нейродеструктивных манипуляций. Такие пациенты могут продолжать жаловаться на боли, даже если процедура проведена успешно. У пациента должен быть сформирован реалистический взгляд на исход лечения. Он должен понимать, что целью является уменьшение боли, а не полное ее устранение.
Перед нейродеструктивной процедурой обязательно проведение диагностической блокады. Хороший эффект от диагностической блокады может прогнозировать удовлетворительный результат нейродеструкции. Тем не менее, такую же диагностическую блокаду нужно повторить, по крайней мере, еще один раз, даже если ослабление боли было значительным, чтобы свести на нет эффект плацебо.
Если результат не совсем ясен, следует использовать дифференциальное блокирование. У пациентов с распространенной или мультилокальной болью результат лечения обычно не оправдывает ожидания. Пациент должен осознавать, что воздействие на один участок может не привести к достижению желаемого эффекта и, возможно, потребуется дополнительная деструкция для максимально возможного уменьшения боли.
Врачи Европейской клиники о радиочастотной аблации:
Следует избегать проведения процедуры на смешанных нервах, поскольку это может привести к потере кожной чувствительности и мышечной слабости. Деафферентационные боли могут усугубляться при деструкции поврежденного нерва. В том случае, когда боль имеет центральное происхождение (спинальная или выше), деструкция периферического нерва может вызывать увеличение болевой перцепции за счет элиминации входящего стимула. Лучшая альтернатива в этом случае — это нейроаугментация с TENS или стимуляция спинного мозга.
Нейрохирургические вмешательства
В ходе процедуры нейрохирург перерезает корешки спинномозговых или черепных нервов, по которым проходят нервные волокна. Тем самым мозг лишается возможности получать болевые сигналы. Разрезание корешков не приводит к утрате двигательной способности, однако может затруднить ее.
Анальгезия, контролируемая пациентом (PCA)
Этот вид обезболивания основан на простом правиле: пациент получает анальгетики тогда, когда он этого хочет. В основу схемы положено индивидуальное восприятие боли и необходимость приема анальгетиков. В европейских странах РСА принята в качестве стандарта постоперационного обезболивания. Метод прост и относительно безопасен. Однако пациентам необходимо проходить тщательный инструктаж.
PCA наиболее эффективна при использовании катетерных методов (эпидуральная, спинальная анестезия, блокада нервных сплетений с установкой катетера), а также порт-систем, как венозных, так и эпидуральных и интратекальных.
Обезболивающие при раке желудка
Неприятные ощущения и боли испытывают примерно 70% пациентов, страдающих раком желудка. Как правило, боль локализуется в животе, но по мере прогрессирования опухоли может возникать и в других местах: в спине, ребрах, костях. В качестве симптома паранеопластического синдрома или побочного эффекта химиотерапии могут возникать нейропатические боли.
Помимо трехступенчатой системы, для борьбы с болью и дискомфортом при раке желудка применяют бензодиазепины, антидепрессанты, препараты гормонов коры надпочечников (преднизолон, дексаметазон), снотворные, антипсихотические средства. При болях в костях и патологических переломах назначают бисфосфонаты.
Врач может провести два вида нервных блокад:
- Блокада чревного сплетения помогает справиться с болью в верхней части живота. Блокируется проведение болевых импульсов по нервам желудка, печени, поджелудочной железы, желчного пузыря, кишечника, почек.
- Блокада подчревного сплетения помогает справиться с болью в нижней части живота. Во время нее блокируют нервы нижнего отдела кишечника, мочевого пузыря, яичек, пениса, предстательной железы, матки, яичников, влагалища.
Блокаду нервных сплетений можно проводить с помощью анестетиков и препаратов, которые временно повреждают нервы. При невролизе вводят препарат, который разрушает сплетение.
Обезболивающие при раке легких
Причиной боли в грудной клетке при раке легких может быть сама опухоль или перенесенное хирургическое вмешательство. Другие возможные причины:
- Метастазы в головном мозге приводят к головным болям.
- Метастазы органов брюшной полости приводят к болям в животе.
- Метастазы в костях приводят к костным болям, патологическим переломам.
- Паранеопластический синдром приводит к нейропатическим болям в разных частях тела.
- Боли — один из побочных эффектов химиотерапии.
Помимо обезболивающих уколов при онкологии легких с НПВС и наркотическими анальгетиками, помогают другие препараты, нервные блокады, лучевая терапия, паллиативные хирургические вмешательства.
Источник
