Фармакотерапия хронического болевого синдрома у онкологических пациентов

Монография посвящена актуальным вопросам лечения боли у онкологических пациентов с учетом их особенностей в нашей стране. Отражены существующие медицинские и организационные проблемы терапии хронической боли в онкологии, изложены различные классификации, эпидемиология, патофизиология и этиопатогенез онкологической боли, детально описан невропатический тип боли в онкологии. На материале собственных исследований подробно описаны анальгетическая эффективность и переносимость всех опиоидных анальгетиков в неинвазивных формах, использовавшихся для терапии хронической боли в нашей стране до 2015 г.
Проведен сравнительный анализ с инъекционными формами опиоидов (с промедолом и трамадолом), наиболее часто применяемых в нашей стране. Отдельно исследованы эффекты антиконвульсантов последнего поколения (габапентиноидов) при невропатической боли онкологического генеза. На основе анализа проведенных исследований предложен алгоритм фармакотерапии боли в онкологической клинике, сочетающий рекомендации неврологических научных сообществ и основные подходы к лечению боли, используемые в онкологии.
Книга предназначена для широкого круга врачей, провизоров, медицинских сестер, использующих в своей работе сильнодействующие анальгетики или занимающихся терапией боли.
Глава 1. Болевые синдромы в онкологической клинической практике
1.1. Структура болевых синдромов в онкологической клинической практике
1.2. Эпидемиология онкологической боли
1.3. Патофизиологические основы возникновения боли
1.3.1. Первичная гипералгезия
1.3.2. Вторичная гипералгезия
1.3.3. Антиноцицептивные системы
1.3.4. Процесс формирования хронической боли
Глава 2. Особенности патогенеза боли при злокачественных новообразованиях
2.1. Простагландины
2.2. Эндотелины
2.3. Субстанция Р
2.4. Внеклеточные ионы водорода
2.5. Цитокины
Глава 3. Невропатические болевые синдромы
3.1. Эпидемиология невропатической боли в онкологии
3.2. Патогенез невропатической боли у онкологических больных
3.3. Виды невропатической боли
3.4. Особенности невропатической боли у онкологических пациентов .
3.4.1. Опухоли центральной нервной системы
и периферических нервов
3.4.2. Осложнения опухолевого процесса (патологические переломы, изъязвления,
лимфостаз и др.)
3.4.3. Невропатическая боль как осложнение противоопухолевого лечения
Глава 4. Современные методы диагностики и объективизации боли
Глава 5. Современные методы фармакотерапии онкологической боли
5.1. “Лестница обезболивания” Всемирной организации здравоохранения
5.2. Современные анальгетики для терапии онкологического
хронического болевого синдрома
Глава 6. Методы и материал исследования
6.1. Методы объективизации эффективности и переносимости обезболивающей терапии, использованные в исследовании
6.2. Обзор и характеристика исследуемой группы больных
6.2.1. Характеристика исследуемой группы больных
по онкологическому и болевому статусу
6.2.2. Дизайн исследования
Глава 7. Фармакотерапия хронической онкологической боли опиоидными анальгетиками. Обоснование выбора препарата исследования
7.1. Краткая характеристика препарата
7.2. Исследование эффективности и безопасности трамадола
в лекарственных формах короткого действия
7.2.1. Исходный статус пациентов недифференцированной терапии опиоидными анальгетиками короткого действия (трамадолом)
7.2.2. Результаты исследования на этапах терапии
7.2.3. Выводы по исследованию
7.3. Исследование эффективности и переносимости трамадола в таблетках продленного действия. Группа недифференцированной терапии опиоидным анальгетиком продленного действия (трамадолом)
7.3.1. Исходный статус пациентов
7.3.2. Результаты исследования на этапах терапии
7.3.3. Выводы по исследованию
7.3.4. Сравнительный анализ результатов исследования в группах, получавших препарат трамадол короткого и продленного действия
Глава 8. Исследование эффективности и переносимости тримеперидина (промедола*) в инъекциях в лечении хронической онкологической боли
8.1. Краткая характеристика препарата
8.2. Исходный статус пациентов в группе недифференцированной терапии опиоидными анальгетиками короткого действия [тримеперидином (промедолом*)]
8.2.1. Результаты исследования на этапах терапии
8.3. Выводы по результатам исследования
8.4. Анализ результатов исследования эффективности и переносимости терапии
Глава 9. Оценка эффективности и переносимости препарата
пропионилфенилэтоксиэтилпиперидина (просидола*) в буккальных таблетках
9.1. Краткая характеристика препарата
9.2. Исходный статус пациентов в группе больных, получавших пропионилфенилэтоксиэтилпиперидин (просидол*)
9.3. Результаты исследования
9.4. Выводы по результатам исследования
Глава 10. Исследование эффективности и переносимости
морфина в таблетках продленного действия. Группа
недифференцированной терапии опиоидным анальгетиком
продленного действия (морфином)
10.1. Краткая характеристика препарата морфина сульфата
в таблетках пролонгированного действия
10.2. Исходный статус пациентов
10.3. Результаты исследования на этапах терапии
10.4. Выводы по результатам исследования
10.5. Анализ результатов исследования
Глава 11. Исследование эффективности и переносимости терапии трансдермальной терапевтической системы фентанила. Группа недифференцированной терапии опиоидным анальгетиком продленного действия (фентанилом)
11.1. Краткая характеристика препарата трансдермальной
терапевтической системы фентанила
11.2. Исходный статус пациентов
11.3. Результаты исследования на этапах терапии
11.4. Выводы по исследованию
11.5. Анализ полученных данных
Глава 12. Исследование эффективности и переносимости обезболивания трансдермальной терапевтической системы бупренорфина. Группа недифференцированной терапии опиоидным анальгетиком длительного действия (бупренорфином)
12.1. Краткая характеристика препарата трансдермальной
терапевтической системы бупренорфина (транстека*)
12.2. Исходный статус пациентов
12.3. Результаты исследования на этапах терапии
12.4. Выводы по результатам исследования
12.5. Анализ результатов исследования
Глава 13. Эффективность и переносимость обезболивания при дифференцированном подходе к терапии боли с использованием антиконвульсантов последнего поколения
13.1. Обоснование выбора препаратов исследования
13.2. Краткая характеристика препарата исследования
13.3. Исходный статус пациентов
13.4. Результаты исследования на этапах терапии
13.5. Выводы по результатам исследования
13.6. Анализ полученных данных
Глава 14. Исследование эффективности и безопасности
дифференцированной обезболивающей терапии на основе
прегабалина. Группа дифференцированной терапии боли
на основе прегабалина
14.1. Краткая характеристика препарата исследования
14.2. Исходный статус пациентов
14.3. Результаты исследования на этапах терапии
14.4. Выводы по результатам исследования
14.5. Анализ результатов исследования
Глава 15. Сравнительный анализ показателей эффективности обезболивающей терапии между группами, получавшими дифференцированную и недифференцированную
терапию боли
Глава 16. Алгоритм дифференцированной диагностики и лекарственной терапии хронического болевого синдрома у онкологических больных
16.1. Рекомендации к использованию алгоритма
16.1.1. Ноцицептивная боль
16.1.2. Невропатическая боль
Источник
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Московский научно – исследовательский онкологический институт им. –
филиал федерального государственного бюджетного учреждения
«Федеральный медицинский исследовательский центр им. »
ФАРМАКОТЕРАПИЯ ХРОНИЧЕСКОГО БОЛЕВОГО СИНДРОМА
У ВЗРОСЛЫХ ПАЦИЕНТОВ ОНКОЛОГИЧЕСКОГО ПРОФИЛЯ
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
МОСКВА 2015
Московский научно – исследовательский онкологический институт им. –
филиал федерального государственного бюджетного учреждения
«Федеральный медицинский исследовательский центр им. »
125 284, Москва, 2-й Боткинский пр-д, .3.
ФАРМАКОТЕРАПИЯ ХРОНИЧЕСКОГО БОЛЕВОГО СИНДРОМА
У ВЗРОСЛЫХ ПАЦИЕНТОВ ОНКОЛОГИЧЕСКОГО ПРОФИЛЯ
«СОГЛАСОВАНО» Главный внештатный специалист по паллиативной помощи Минздрава России, главный врач ГКУЗ «Хоспис № 1 им. » Департамента здравоохранения города Москвы, к. м.н. ______________________ | «УТВЕРЖДАЮ» Генеральный директор ФГБУ «ФМИЦ им. » Минздрава России, член.-корр. РАН, профессор __________________ |
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
а
УДК
ББК 55,6
, ,
Фармакотерапия хронического болевого синдрома у взрослых пациентов онкологического профиля
Москва 2015
М.: МНИОИ им. – филиал ФГБУ «ФМИЦ им. » Минздрава России -2015.- илл.- 47с.
ISBN
В методических рекомендациях приведены правила фармакотерапии болевого синдрома у онкологических больных с учетом особенностей перечня опиоидных анальгетиков, зарегистрированных в России. В соответствии с рекомендациями Всемирной организации здравоохранения и Европейскими рекомендациями по паллиативной медицине, основным методом контроля хронического болевого синдрома является фармакотерапия на основе неинвазивных форм опиоидных анальгетиков. Она применяется амбулаторно и в стационаре независимо от стадии заболевания. Полноценный контроль боли должен осуществляться на всех этапах противоопухолевой терапии, в том числе при оказании паллиативной помощи. При соблюдении основных принципов ВОЗ фармакотерапия обеспечивает достаточный уровень обезболивания у 70–90% онкологических больных. Методические рекомендации утверждены на заседании Ученого совета МНИОИ им. – филиала ФГБУ «ФМИЦ им. » Минздрава России, протокол № 2 от 01.01.2001.
Методические рекомендации предназначены для врачей общей практики, врачей-онкологов, врачей-гематологов, врачей-терапевтов, врачей по паллиативной медицинской помощи.
Учреждение-разработчик: ФГБУ «МНИОИ им. » – филиал ФГБУ «ФНИМЦ им. » Минздрава России.
Авторы: член-корр. РАН, проф. , д. м.н. , д. м.н. , д. м.н. , проф. , проф. , проф.
Рецензенты:
Ответственный за издание: проф.
ISBN
© Коллектив авторов 2015г.
© МНИОИ им. – филиал ФГБУ «ФМИЦ им. » Минздрава России, Москва, 2015г.
Содержание
1. Введение. 25
2. Определение понятия боли, классификация и диагностика типов хронического болевого синдрома 25
3. Общие принципы терапии хронической боли в онкологии.. 210
4. Алгоритм терапии хронического болевого синдрома у взрослых онкологических больных 218
5. Контроль прорывов боли.. 232
6. Парентеральное введение анальгетиков. 233
7. Лечение нейропатической боли.. 233
8. Адъювантная терапия хронического болевого синдрома. 236
ЛИТЕРАТУРА.. 240
Приложения. 243
1. Введение
Боль является одним из основных симптомов, причиняющих страдания при злокачественных новообразованиях (ЗНО). Несмотря на выдающиеся успехи, достигнутые в диагностике и терапии опухолей, по прогнозам экспертов Всемирной Организации Здравоохранения (ВОЗ) в ближайшем обозримом будущем заболеваемость и смертность от рака будет увеличиваться, соответственно будет расти число пациентов с болевым синдромом, обусловленным опухолевым процессом.
В России насчитывается свыше 3 млн. 090 тыс. человек с установленным диагнозом ЗНО, из них ежегодно умирает около 300 тыс., и выявляется более 500 тыс. новых случаев заболевания[1]. На начальных стадиях опухолевого процесса 35–50% больных жалуются на боль, при прогрессировании ЗНО их число увеличивается до 75%, а в терминальной стадии – до 95–100%. Таким образом, число онкологических больных, нуждающихся в обезболивающей терапии, значительно превышает число умерших от ЗНО и только в нашей стране составляет не менее 433 тыс. пациентов.
У 90% онкологических больных болевой синдром связан с опухолевым процессом и его лечением, и лишь в 10% причиной боли являются сопутствующие заболевания. В 70% боль возникает из-за поражения костей, прорастания или сдавления нервных структур, обструкции протоков, сосудов и поражения слизистых, 20% болевого синдрома связано с диагностическими и лечебными процедурами (биопсия, послеоперационная боль, боль после лучевой и химиотерапии) и около 10% – с паранеопластическим процессом, пролежнями, запорами и спазмами гладкомышечных органов [2].
Право пациента на получение бесплатной медицинской помощи при хроническом болевом синдроме в РФ закреплено законодательно Федеральным законом от 01.01.2001г. «Об основах охраны здоровья граждан» в Российской Федерации». В статье 36 Закона дано определение паллиативной помощи как «комплекса медицинских вмешательств, направленных на избавление от боли и облегчение других тяжелых проявлений заболевания в целях улучшения качества жизни неизлечимо больных граждан» и условия ее оказания – «в амбулаторных условиях и стационарных условиях медицинскими работниками, прошедшими обучение по оказанию такой помощи».
2. Определение понятия боли, классификация и диагностика типов хронического болевого синдрома
Согласно определению экспертов Международной ассоциации по изучению боли: «Боль – неприятное ощущение и эмоциональное переживание, связанное с реальным или потенциальном повреждением тканей или описываемое в терминах такого повреждения» (IASP 1992 г.).
Боль является проявлением или симптомом какого-либо заболевания или состояния, поэтому при оформлении медицинской документации используется код по МКБ-10, соответствующий основному заболеванию, который может быть дополнен кодами, свидетельствующими о существовании у пациента боли. Это является важным моментом при дифференциальной диагностике сложных случаев, когда причину боли выявить сразу не удается. В разделе R52 «Боль, не классифицированная в других рубриках» по МКБ-10 определены следующие виды боли:
R52.0 – острая боль;
R52.1 – постоянная некупирующаяся боль;
R52.2 – другая постоянная боль;
R52.9 – боль неуточненная.
2.1. Патофизиология болевых синдромов. Типы болевых синдромов
Диагностика, а также последующая тактика терапии боли взаимосвязана с патофизиологической классификацией онкологической боли (табл. 1).
Таблица 1
Патофизиологическая классификация онкологической боли
Типы боли | Характеристики | Пример | Лечение |
Ноцицептивная соматическая | Локализованная, имеет четкие границы; постоянная или приступообразная, ноющая, пульсирующая, грызущая | Боль при ЗНО мягких тканей, метастатическом поражении костей, врастании опухолей | Противоопухолевая терапия, миорелаксанты, спазмолитики, НПВП, центральные анальгетики, блокады нервов |
Ноцицептивная висцеральная | Плохо локализованная, не имеет четких границ, разлитая; постоянная, ноющая, давящая, схваткообразная, спастическая; часто сопровождается тошнотой | Боль при опухолях поджелудочной железы, желудка, при гепатомегалии, при асците | |
Нейропатическая | Внезапная, стреляющая, подобная электрическому разряду, жгучая, колющая, с ощущением жара и/или онемения | Компрессия корешков, нервных сплетений или их ветвей | Противоопухолевая терапия, антиконвульсанты, антидепрессанты, центральные анальгетики, блокады нервов, нейролептики |
Онкологическая боль имеет отчасти ту же природу и те же патофизиолологические механизмы, какие формируются при воспалении и повреждении тканей. Общим является раздражение специфических болевых рецепторов – ноцицепторов, распределенных в различных органах и тканях. Особенностью формирования онкологической боли является дополнительная стимуляция болевых рецепторов не только в ответ на взаимодействие с воспалительными альгогенами, но и при специфическом воздействии опухолевых факторов, что способствует усиленному проведению потока болевых импульсов в ЦНС. Ноцицепторы взаимодействуют с продуктами метаболизма опухолевых клеток, медиаторами повреждения или воспаления, в результате изменяется биоэлектрический потенциал нейронов, которые передают болевую информацию в спинной мозг, а затем в высшие отделы ЦНС [3].
| Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 |
Источник
23 апреля 2019 г.
Просмотров: 1680
Согласно определению Международной ассоциации по изучению боли (IASP),к хронической относят боль, которая сохраняется более 3 месяцев. Это достаточно типичная ситуация для онкологического больного. При прогрессировании опухолевого процесса хроническая боль отягощает жизнь пациента и окружающих его людей, представляет серьезную медицинскую и социальную проблему. У онкологических пациентов болевые ощущения не являются временными или преходящими, в них нет биологической целесообразности, они не играют защитной роли. Возникшая у онкологического пациента боль ведет к дезадаптации, к ненормальному восприятию болевых импульсов и сопровождается различными нарушениями функции центральной нервной системы (ЦНС).
Клиническая картина болевого синдрома зависит от локализации очага поражения, патогенетического типа боли, индивидуального порога болевой чувствительности, предшествующего болевого опыта.
Этиология
Выделяют следующие основные причины хронической боли у онкологических больных:
- боль, вызванная самой опухолью (поражение костей, мягких тканей, кожи, внутренних органов, органов пищеварительной системы, окклюзия сосудов и др.);
- боль при осложнениях опухолевого процесса (патологический перелом, некроз, изъязвление, воспаление, инфицирование тканей и органов, тромбозы);
- боль при паранеопластических синдромах (артро-, нейро- и миопатии);
- боль как следствие астенизации (пролежни, трофические язвы, запор);
- боль, обусловленная противоопухолевым лечением:
- при осложнениях хирургического лечения рака (фантомная боль, боли при спайках, рубцах, отеках);
- при осложнениях химиотерапии (мукозиты, полинейропатия, генерализованная миалгия, асептический некроз, артралгии);
- при реакциях и осложнениях лучевой терапии (поражение кожи и слизистых оболочек, костей, фиброз, неврит, плексит, миелопатия и др.).
Типы боли и механизм их развития
Выделяют три патогенетических типа боли: ноцицептивный, нейропатический и психогенный. При ноцицептивном типе боли происходит раздражение специфических периферических болевых рецепторов (ноцицепторов),которые расположены во всех органах и тканях: в коже, слизистых оболочках, стенках полых органов, капсулах паренхиматозных органов, в костях и надкостнице.
Повреждения, сопровождающие опухоли, приводят к деструкции клеточных мембран, в результате этого запускается цепь гистохимических реакций с высвобождением тканевых альгогенов, к числу которых в настоящее время относят более 30 различных субстанций. Важнейшими из них принято считать простагландин Е2 (ПГЕ2),гистамин, серотонин и другие биоактивные вещества. В патологическом очаге также активны альгогены, поступающие из плазмы. К ним относятся брадикинин и каллидин. Как плазменные, так и тканевые альгогены взаимодействуют с соответствующими структурами на поверхности болевых рецепторов,резко повышая их чувствительность.
Особенность формирования ноцицептивной боли при онкологическом процессе — способность болевых рецепторов активироваться не только при взаимодействии с воспалительными альгогенами, но и при воздействии на них специфических опухолевых факторов, что способствует усилению потока болевых импульсов. При этом ноцицепторы взаимодействуют как с продуктами метаболизма опухолевых клеток, так и с факторами повреждения или воспаления тканей. На ноцицепторы при онкологической боли воздействуют внеклеточные ионы водорода Н+, эндотелин 1, интерлейкины разных типов и фактор некроза опухоли.
В результате этих разнообразных и частых воздействий генерируются болевые импульсы. По афферентным нервным волокнам болевой импульс поступает в задние рога спинного мозга, откуда по спиноталамическому тракту — в вышележащие отделы ЦНС, ядра таламуса. В дальнейшем вся сенсорная болевая информация поступает в нейроны серого вещества проекционных зон коры больших полушарий, где происходят ее обобщение, обработка и анализ (перцепция),после чего организм осознает боль и степень опасности произошедшего повреждения.
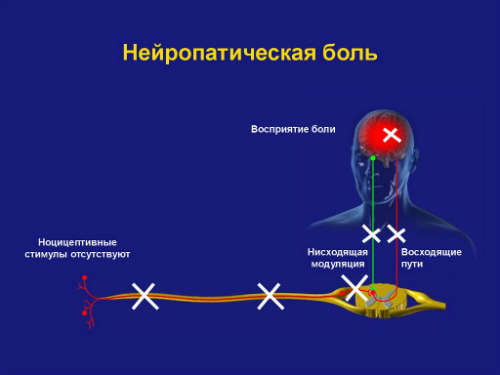
Нейропатическая боль имеет принципиальное отличие от ноцицептивной в механизмах формирования. Нейропатическая боль у онкологических пациентов может возникать как результат повреждений на разных уровнях нервной системы — от периферических нервов до нейронов коры головного мозга.
При повреждении головного или спинного мозга развивается центральная нейропатическая боль. При повреждениях структур периферической нервной системы (корешков спинномозговых нервов, нервных сплетений, периферических нервов) развивается периферическая нейропатическая боль.
Нейропатическая боль у онкологических пациентов часто гетерогенна, так как может иметь одновременно несколько причин, например, компрессия нервов (79%),деафферентационное повреждение нервов (16%),симпатически усиленная боль (5%). Симпатически усиленная боль — каузалгия, которая проявляется локальной вазодилатацией, гипертермией, повышенным потоотделением, трофическими расстройствами, извращенными сенсорными реакциями.
Опухоли, неудержимо разрастаясь в объеме, способны сдавливать структуры периферической нервной системы либо прорастать непосредственно в нервные сплетения, корешки и ветви периферических нервов, вызывая боль, нарушая сенсорную и моторную функции. Длительно существующая опухолевая компрессия, как и инфильтрация нервных структур, приводит к повреждению волокон нерва, вызывая дегенеративные изменения и деафферентацию (централизацию) боли.
Нейропатическая боль у онкологического больного может сопровождаться разнообразной неврологической симптоматикой, в которой присутствуют симптомы усиления чувствительности: жгучая или простреливающая боль высокой интенсивности, гиперестезия, гипералгезия, боль в ответ на неболевое раздражение (аллодиния),симптомы выпадения или ослабления сенсорных ощущений.
Психогенная боль возникает в ответ на индивидуальное эмоционально значимое переживание (депрессия, стресс, страх, истерия, бред, боли, галлюцинации и т.п.). Эти эмоциональные проявления могут вызывать изменения в симпато-адреналовой системе, системе выработки гипофизарных гормонов, что ведет к дисбалансу в работе висцеральных систем.
Лекарственная терапия хронической онкологической боли
Основным методом симптоматического лечения хронической боли онкологического генеза является системная фармакотерапия. Принципы медикаментозного лечения хронической боли включают следующие основные положения:
- подход к назначению лечения должен быть индивидуализированным;
- выбор препарата осуществляется в зависимости от патофизиологического типа и ее интенсивности;
- лечение осуществляется «по восходящей» в соответствии с «анальгетической лестницей ВОЗ»;
- преимущество отдается неинвазивным путям введения препаратов (пероральному и трансдермальному) и соответствующим лекарственным формам анальгетиков;
- препараты следует назначать в фиксированное время суток, «по часам», а не «по требованию»;
- препараты следует назначать в адекватных дозах;
- необходимо предотвращать развитие нежелательных эффектов и бороться с ними при их возникновении.
При лечении ноцицептивной боли ВОЗ рекомендует трехступенчатую схему использования анальгетиков («анальгетическую лестницу ВОЗ»). На первой ступени обезболивания, при наличии слабой боли, назначают препараты неопиоидного ряда, ненаркотические анальгетики (парацетамол,метамизол) или НПВП. При усилении боли и недостаточной эффективности ненаркотических анальгетиков и НПВП к ним добавляют сначала слабые (трамадол, кодеин, дигидрокодеин),а затем сильные опиоиды (бупренорфин, морфин, оксикодон, фентанил). Также при наличии тех или иных симптомов или при развитии нежелательных явлений от применения анальгетиков в терапию включаются адъювантные средства.
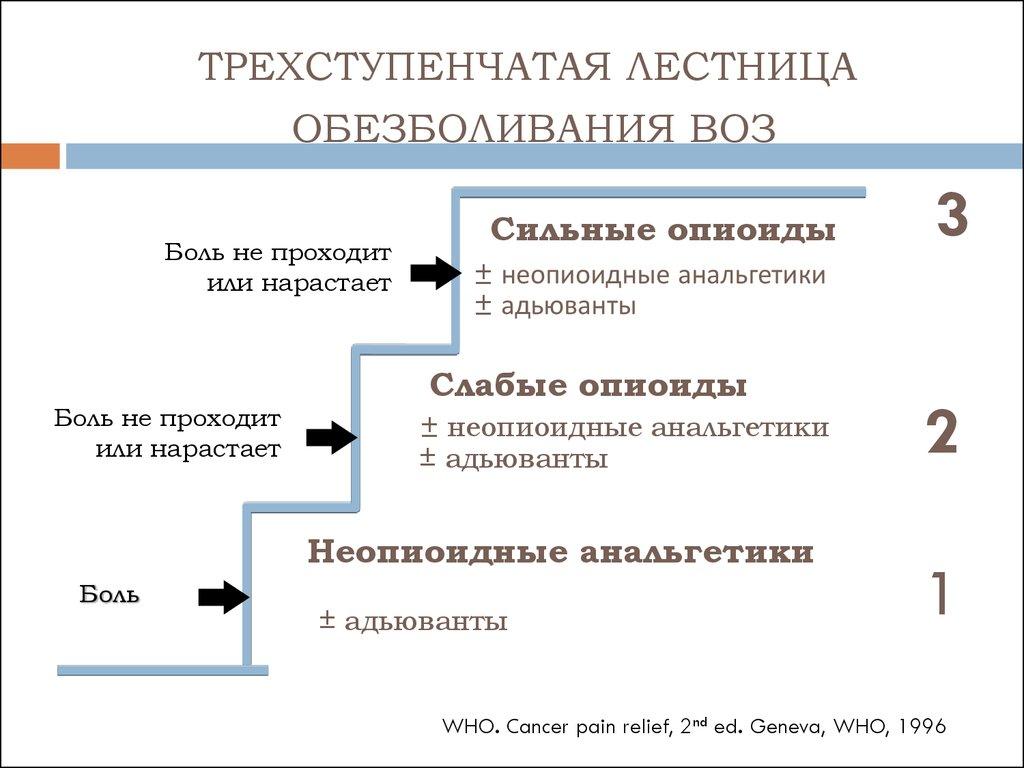
«Анальгетическая лестница ВОЗ»
1-я ступень НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
2-я ступень СЛАБЫЙ ОПИАТ + НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
3-я ступень СИЛЬНОДЕЙСТВУЮЩИЙ ОПИАТ + НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
В целом такая тактика лечения хронической боли позволяет достичь удовлетворительного обезболивания у 77-90% онкологических больных. В России зарегистрированы основные лекарственные препараты как из группы НПВП, так и из группы опиоидов для лечения хронической боли, рекомендуемые ВОЗ.
По мнению экспертов ВОЗ, для длительной терапии хронической боли анальгетики следует использовать в удобных для пациентов неинвазивных формах, предназначенных для введения: внутрь, трансбуккально, подъязычно, трансдермально, ректально.
Для длительной плановой терапии предпочтительны в лекарственные формы продленного действия (депо-формы).
К 1-й ступени «лестницы обезболивания» ВОЗ относят препараты из группы ненаркотических анальгетиков (парацетамол, метамизол) и препараты из группы НПВП (кеторолак, диклофенак, кетопрофен, лорноксикам, нимесулид, мелоксикам, целекоксиб).
Применение НПВП показано на всех этапах терапии боли у онкологических больных. У больных с опухолями и/или метастазами, поражающими мягкие ткани и кости, всегда развивается выраженное перифокальное воспаление. В начале 70-х годов ХХ века было установлено, что болеутоляющее, жаропонижающее и противовоспалительное действие НПВП обусловлено подавлением синтеза простагландинов. НПВП снижают продукцию простагландинов за счет ингибирования фермента циклооксигеназы (ЦОГ).

На сегодня выделяют три изоформы ЦОГ. Считают, что избирательное угнетение ЦОГ-2 приводит к подавлению воспаления и боли. В то же время сохранение активности ЦОГ-1 определяет репаративные процессы в желудке, кровоток в почках. Было отмечено, что парацетамол и метамизол слабо влияют на синтез простагландинов в периферических тканях, но подавляют продукцию простагландинов в ЦНС. В последние годы появились сведения о том, что в ЦНС имеется третий, отличный от первых двух тип ЦОГ, названный ЦОГ-3. Ингибирование ЦОГ-3 головного мозга сопровождается подавлением боли и снижением температуры тела при лихорадке.
Все НПВП могут вызывать осложнения со стороны желудочно-кишечного тракта (ЖКТ): диспепсию, язвы, кровотечения и перфорацию верхних и нижних отделов ЖКТ, железодефицитную анемию.
Все НПВП могут вызывать осложнения со стороны сердечно-сосудистой системы (ССС): дестабилизацию артериальной гипертензиии сердечной недостаточности, повышают риск «кардиоваскулярных катастроф» (инфаркт миокарда, ишемический инсульт) и летальности.
Все НПВП могут оказывать негативное влияние на функцию почек и печени (особенно при наличии заболеваний последних),а в ряде случаев вызывать серьезные нефро- и гепатотоксические реакции.
Препараты группы противопоказаны при эрозивно-язвенных поражениях желудочно-кишечного тракта (ЖКТ) в стадии обострения, состояниях гипокоагуляции (в том числе при гемофилии, геморрагическом диатезе, тромбоцитопении),при бронхиальной астме, тяжелой хронической сердечной недостаточности, гиповолемии, тяжелой почечной и печеночной недостаточности, состояниях, сопровождающихся гиперкалиемией, могут вызвать обострение и осложнения воспалительных заболеваний кишечника (ВЗК).
НПВП могут вызывать кожные реакции и бронхоспазм. Риск развития осложнений со стороны указанных органов и систем существенно отличается при использовании различных НПВП. Для предотвращения осложнений необходим учет факторов риска и выбор наиболее безопасного НПВП.
Для снижения риска развития НПВП гастропатии необходимо дополнительное назначение препаратов из группы ингибиторов протонной помпы и применение низких доз аспирина для снижения риска кардиоваскулярных осложнений. В настоящее время НПВП классифицируются по степени селективности ингибирующей активности в отношении разных изоформ ЦОГ.
В клинике «Медицина 24/7» работает круглосуточный хоспис для онкологических больных. Весь коллектив клиники работает на то, чтобы продлить жизнь человека и устранить болезненные симптомы. Наши врачи назначают и проводят паллиативное лечение для облегчения состояния пациента, а также подбирают наиболее подходящую схему обезболивания. Наши медсестры и санитарки готовы обеспечить достойный уход пациенту на терминальной стадии рака.
Литература:
- Исакова М.Е. Болевой синдром в онкологии. — М.: Практическая медицина, 2011. — 384 с.
- Каприн А.Д., Абузарова Г.Р., Хороненко В.Э. и др. Фармакотерапия хронического болевого синдрома у онкологических пациентов. Медицинская технология. — М.: МНИОИим. П.А. Герцена, 2015. — 48 с.
- Машфорт М.Л., Купер М.Г., Кохен М.Л. и др. Боль и аналгезия. Руководство для практикующих врачей / Перевод сангл. А.Н. Редькин; ред. рус. изд. Бунятян А.А., НасоновЕ.Л., Никода В.В. — М.: Литтерра, 2004. — 488 с.
- Новиков Г.А., Осипова Н.А. Лечение хронической боли онкологического генеза: учебное пособие. Москва. — 83 с.
- Новиков Г.А. Контроль симптомов в паллиативной медицине. — М.: ГЭОТАР-Медиа, 2013. — 248 с.
- Осипова Н.А., Абузарова Г.Р., Петрова В.В. Принципы клинического применения наркотических и ненаркотических аналгетических средств при острой и хронической боли. Методические указания. Практическое руководство для врачей. М., 2005. — 79 с.
- Штрибель Х.В. Терапия хронической боли. Практическое руководство / Пер. с нем.; ред. Осипова Н.А., ДаниловаА.Б., Осипова В.В. — М.: ГЭОТАР-Медиа, 2005. — 303 с.
- Ahmedzai S.H., Leppert W., Janecki M., Pakosz A., LomaxM., Duerr H., Hopp M.
- Long-term safety and efficacy of oxycodone/naloxoneprolonged-release tablets in patients with moderate-to-severechronic cancer pain. Support Care Cancer. 2015 Mar; 23 (3):823-30.
- Caraceni A., Hanks G., Kaasa S. et al. Use of opioid analgesicsin the treatment of cancer pain: evidence-basedrecommendations from the EAPC // Lancet Oncol. 2012 Feb;13 (2): e 58-68.
- Mystakidou K., Parpa E., Tsilika E. et al. Pain management ofcancer patients with transdermal fentanyl: a study of 1828 stepI, II, & III transfers. // J. Pain. 2004; 5: 119–13212. Skaer T.L. Transdermal opioids for cancer pain. // HealthQual. Life Outcomes. 2006 Mar 31; 4: 2413. World Health Organization. Cancer pain relief: with a guide toopioid availability. 2. Geneva: WHO; 1996.14. Zech D.F., Grond S., Lynch J., Hertel D., Lehmann K.A.Validation of World Health Organization guidelines forcancer pain relief: A 10-year prospective study. Pain. 1995;63: 65–76.
Источник: Научно-практический журнал «Паллиативная медицина и реабилитация» № 1. 2018.
Источник
