Галстян г р синдром диабетической стопы
 Для цитирования. Кисляков В.А., Оболенский В.Н., Юсупов И.А. Синдром диабетической стопы: комплексный подход к лечению // РМЖ. 2015. No 12. С. 768–770.
Для цитирования. Кисляков В.А., Оболенский В.Н., Юсупов И.А. Синдром диабетической стопы: комплексный подход к лечению // РМЖ. 2015. No 12. С. 768–770.
Распространенность и экономические аспекты
В XXI в. сахарный диабет (СД) стал ведущим неинфекционным заболеванием. Каждые 10 с в мире становится на 2 больных СД больше – это 7 млн в год. По мнению экспертов Всемирной организации здравоохранения, СД занимает 1-е место среди заболеваний, приводящих к инвалидности, и 3-е – по смертности [1–4].
Согласно исследованиям Эндокринологического научного центра (ЭНЦ), в России распространенность СД достигает 10–12 млн человек (7–8% населения страны). Наиболее высокая распространенность СД среди взрослого населения крупных городов. При этом соотношение мужчин и женщин – 1:3. В половине случаев СД 2-го типа выявляется на 5–7-м году от начала заболевания, и у 20–30% выявляются специфические осложнения: катаракта, ретинопатия, нефропатия, нейропатия, синдром диабетической стопы (СДС), ишемическая болезнь сердца, артериальная гипертония и др. [5–8].
СДС приводит к гнойно-некротическим поражениям стоп с последующей потерей нижних конечностей – к самой высокой инвалидизации. Окончательные цифры распространенности СДС в настоящее время неизвестны. Тем не менее установлено, что у 15% больных СД развиваются патологические изменения в стопах или голеностопном суставе [9–13].
В последние годы широко обсуждаются не только клинические, но и экономические, социальные аспекты профилактики и лечения СДС, методы клинико-экономического анализа и, прежде всего, учет всех затрат, связанных с лечением СДС [1, 14].
На 18-м конгрессе Международной федерации диабета (МФД) были представлены, в частности, данные о распространенности язвенных дефектов при СДС в странах Балканского региона – 7,5%. Диагноз СД впервые ставится во время хирургического вмешательства у 15–19% больных, подвергающихся ампутации. Специалисты МФД считают, что вероятная частота ампутаций при СД составляет 5–24 на 100 000 населения в год, или 6–8 на 1000 больных в год, а в эпидемиологически неблагоприятных регионах достигает 24 на 1000 больных в год. В России, согласно данным государственного регистра, эти показатели колеблются от 0,76 до 18,2 и в среднем составляют 6,4 случая на 1000 больных [3, 4, 11, 15].
Расходы на лечение СДС в развитых странах составляют около 12–15% от всех затрат на лечение СД, в развивающихся странах они могут составлять до 40% от общего объема финансовых ресурсов, выделяемых на СД. Подсчитано, что на проведение одной ампутации в зарубежных странах тратится более 10 000 долл. Общие затраты на лечение СДС в среднем составляют 13 179 долл. и меняются в зависимости от степени тяжести по классификации Wagner в пределах от 1892 долл. при I степени до 27 721 долл. при IV–V степени тяжести. Лечение СДС на фоне хронической артериальной недостаточности нижних конечностей обходится в 4,5 раза дороже, чем при сохранном периферическом кровотоке. Ежегодная стоимость лечения язвенных поражений стоп при СДС в США составляет 5 млрд долл. прямых медицинских затрат и 400 млн долл. косвенных медицинских затрат. Кроме того, в США зафиксировали, что 77% людей старше 75 лет после ампутации не способны вернуться в собственный дом и им нужна дополнительная помощь и поддержка социальных групп [8, 16–18].
Анализ работы отделения диабетической стопы ЭНЦ показал, что при своевременно начатой адекватной терапии СДС понижается риск хирургических вмешательств и тяжелых осложнений: у 98% больных с нейропатической инфицированной формой СДС можно избежать хирургического вмешательства; у 60% с нейроишемической формой – проведения ампутаций на уровне голени и бедра; у 25% с критической ишемией – предотвратить высокие ампутации на уровне бедра; на 50% уменьшить частоту образования язв стоп в группе высокого риска [4, 5, 13].
Летальность среди больных СД, перенесших высокую ампутацию конечности по поводу гангрены, в течение последующих 5 лет достигает 68%, в ближайшие 3 нед. – 22%, в течение года – 11–41%, через 3 года – 20–50%, через 5 лет – от 39–68%. Частота ипсилатеральных ампутаций через год после первой ампутации – до 24%, через 2 года – 30%, через 5 лет – 49% и контралатеральных ампутаций через год после первой ампутации – до 12%, через 2 года – 23%, через 5 лет – 28-51%. Рецидивы язв на стопах через 1, 3, 5 лет составили 44, 61, 70% соответственно. Рецидивирующие деструктивные поражения ухудшают проблемы лечения, реабилитации, социальной помощи, увеличивая экономические затраты [19–23].
Если распространенность СД, а соответственно и СДС будет увеличиваться с той же скоростью, что и сейчас, то к 2025 г. экономический ущерб составит от 213 до 396 млрд долл. в год. 75% прироста заболевания придутся на развивающиеся страны. По данным немецких исследователей, общая стоимость лечения больных СД в Германии составляет приблизительно 5 млрд. евро, а средняя стоимость лечения 1 пациента – 5000 евро в год. Ежегодные общие затраты в России на лечение нейроишемической формы СДС составляют 56,2 млн долл., при этом затраты на ампутации достигают 14,4 млн долл. [2, 5, 17].
По оценке главного экономиста Morgan Stanley Эльги Бартш, сочетание двух факторов – СД и ожирения – снизит среднегодовые темпы роста валового внутреннего продукта (ВВП) в странах Организации экономического сотрудничества и развития (ОЭСР) в 2015–2035 гг. с 2,3 до 1,8%, в странах БРИКС (Бразилия, Россия, Индия, Китай, Южно-Африканская Республика) – с 4,5 до 4,2%. Согласно прогнозам ОЭСР, среднегодовые темпы роста ВВП России составят 2,8%. При сохранении нынешнего уровня потребления сахара гражданами страны этот показатель снизится до 2%. Согласно результатам исследования, проведенного фармацевтической компанией «Ново Нордиск», «Инвестиции в лечение сахарного диабета в России», ежегодные прямые затраты, связанные с СД в России, составляют 12,5 млрд долл. США. При этом 42% объема этих средств расходуется на лечение осложнений, которые выявляются у 40–50% людей в момент постановки диагноза. Соответственно диагностика заболевания на ранних стадиях позволит российскому обществу сэкономить более 1,5 млрд долл. США из средств, выделяемых на здравоохранение [13].
Принципы терапии
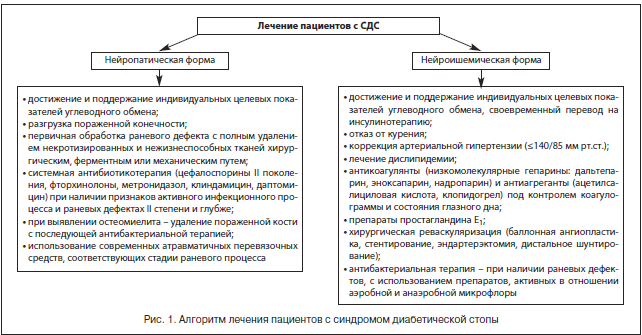
По мнению большинства авторов, в лечении пациентов с синдромом диабетической стопы должны участвовать квалифицированные эндокринолог, гнойный хирург, сосудистый хирург, ортопед, специально обученный средний медицинский персонал, а комплексное лечение должно включать общие и местные методы (рис. 1) [24–26].
Тактика комплексного лечения зависит от формы заболевания [14, 15, 18, 19, 21, 27]. Мы, как и ряд специалистов, выделяем следующие клинические формы СДС.
1. Нейропатическая форма:
– без остеоартропатии;
– с остеоартропатией – «сустав Шарко».
2. Нейроишемическая форма с учетом других характеристик.
К общим принципам терапии пациентов с СДС относятся коррекция факторов риска, компенсация углеводного обмена и поддержание целевых показателей углеводного обмена, компенсация сопутствующих заболеваний, системная антибактериальная, антитромботическая, вазопротекторная терапия в сочетании с адекватным обезболиванием.
К местным принципам лечения относятся: обеспечение полной разгрузки пораженной области с помощью разгрузочного полубашмака, индивидуальной разгрузочной повязки, костыля, сложной ортопедической обуви, кресла-каталки; контроль раневой инфекции, заключающийся в первичной обработке раны и местном лечении раны с правильным выбором повязки в зависимости от фазы течения раневого процесса; хирургическое лечение гнойно-некротического очага стопы с закрытием ран и/или формированием культи пораженной стопы при помощи реконструктивных и пластических операций; восстановление магистрального артериального кровотока в сосудах нижних конечностей.
Перспективным является применение L-лизина эсцината в комплексном лечении язвенных и гнойно-некротических поражений при СДС. Эффективность препарата объясняется его противоотечным действием, связанным со снижением проницаемости сосудистой стенки и улучшением венозного оттока. L-лизина эсцинат обладает стабилизирующим действием на мембраны клеток, снижает активность лизосомальных ферментов, принимающих непосредственное участие в воспалительном процессе. Кроме того, препарат блокирует эффекты фосфолипазы А2, которая является ключевым веществом в развитии воспалительной реакции, связанной с повреждением мембран клеток различными факторами при ишемии, инфекции и травме. Стабилизация фосфолипазы А2 способствует снижению активности простагландинов, что также приводит к уменьшению воспалительного ответа. Доказано также влияние L-лизина эсцината на такие медиаторы воспаления, как гистамин, серотонин, которые выделяются из тромбоцитов, тучных клеток и создают основу для классической воспалительной реакции. Комплексный эффект препарата L-лизина эсцината апробирован в нейрохирургической, неврологической, травматологической практике, ангиологии и флебологии [26–31].
Мы регулярно применяем L-лизина эсцинат по 10 мл в разведении на 50 мл физиологического (0,9%) раствора внутривенно капельно в течение 10 дней у пациентов с нейропатической формой СДС в послеоперационном периоде, с трофическими язвами на фоне нейропатических отеков и у больных с язвами на фоне венозной недостаточности (СЕАР 2-3). Отмечаем благоприятное течение послеоперационного периода, более раннее уменьшение отеков, снижение болевого синдрома, нейропатических болей, заживление язв. Рекомендуем применение L-лизина эсцината для лечения язвенных и гнойно-некротических поражений при СДС в амбулаторной и стационарной практике.
Заключение
СД является серьезным заболеванием, способным привести к тяжелым социально-экономическим и демографическим последствиям. Вопрос о влиянии СДС на качество жизни остается малоизученным. Неизвестны долговременные затраты, связанные с лечением рецидивов язв, проведением повторных ампутаций и увеличением расходов на социальное обслуживание. Кроме того, неучтенными остаются непрямые затраты вследствие утраты человеком из-за болезни профессиональных и социальных функций, что наносит обществу материальный и духовный ущерб.
Опыт других стран, например США, показал, что мультидисциплинарный подход, ранняя диагностика и обучение больных позволяют снизить количество язв стопы и ампутаций на 49–85% и существенно уменьшить расходы государства. Использование программ по профилактике осложнений и обучению больных СД приводит к уменьшению количества ампутаций почти в 2 раза, а экономический эффект от внедрения программ обучения составил 10 млн долл. [2, 5, 9, 11, 13, 21].
Учитывая вышеизложенное, 20 апреля 2015 г. в Кремле Президент РФ Владимир Путин подписал Закон о ратификации соглашения о сотрудничестве стран СНГ в борьбе с ростом заболеваемости сахарным диабетом [18], что в сочетании с грамотным ведением пациентов с СДС может улучшить прогноз как для этих пациентов, так и для больных СД в целом.
Источник
I. Диабетическая нейропатия (ДН) – наиболее частое осложнение сахарного диабета (СД), ведущее к поражению нижних конечностей (вопреки распространенному заблуждению о ведущей роли сосудистых осложнений). Диабетическая полинейропатия, ДПН (дистальное симметричное поражение нервных волокон, преимущественно в нижних конечностях) – самая частая форма ДН (Реже встречаются и другие формы ДН: автономная (вегетативная) нейропатия, мононейропатии (напр., парезы черепных нервов), плексопатии и др.).
II. Диагностика. Типичные ситуации:
Ситуация 1: Жалобы пациента на боли в нижних конечностях.
Характерные симптомы различных типов болей:
– Диабетическая полинейропатия: дистальные (стопы, пальцы) симметричные боли + парестезии и онемение в покое, по ночам. Устраняются массажем, движениями ног.
– Диабетическая ангиопатия (=атеросклероз артерий) нижних конечностей: боли в икрах, бедрах при ходьбе, вынуждающие остановиться (перемежающаяся хромота). Боли в положении лежа, купируемые опусканием ног (ишемия покоя).
– Заболевания суставов: боли в области суставов, «стартовые боли», возможны утренняя скованность, периартикулярный отек.
– Радикулопатии: боли по задне-наружной поверхности бедра, голени; редко симметричные, усиливаются при ходьбе и стоянии, наклоне вперед, после сна в неудобной позе.
– Хроническая венозная недостаточность: парестезии в голенях, чувство «распирания», отеки. Симптомы усиливаются при длительном стоянии.
– Локальные боли в стопах, вызванные болезненными гиперкератозами, предъязвенными изменениями (гиперкератоз с гематомой и возможным нагноением), повреждениями кожи.
Детальный осмотр стоп (включая межпальцевые промежутки) у пациента с жалобами на боли в нижних конечностях обязателен.
При СД 2 типа часто присутствуют «недиабетические» поражения нижних конечностей – сопутствующие заболевания, связанные с возрастом, избытком веса и др.
Возможно сочетание вышеназванных причин болей в ногах. Но в этом случае при формулировке диагноза каждая упомянутая причина должна быть подтверждена данными обследования.
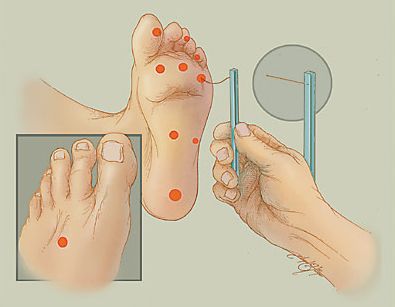
Верификация диагноза ДПН – оценка функции нервных волокон: определение вибрационной, температурной и тактильной чувствительности, в сложных случаях (редко) – электронейромиография (ЭНМГ).
Ситуация 2: Трофические язвы нижних конечностей (нейропатическая, нейро-ишемическая или ишемическая форма синдрома диабетической стопы имеет место). Диагностика основана на:
– оценке симптомов ДПН и диабетической ангиопатии;
– определении различных видов чувствительности, данных УЗДГ (исключить ишемию);
– характерных признаках нейропатической и ишемической язвы (публиковались ранее) – ссылка при необходимости.
III. Лечение диабетической нейропатии.
- Обязательное условие – достижение компенсации углеводного обмена. Переход в состояние компенсации часто полностью устраняет нейропатические боли. Сохраняющаяся декомпенсация делает лечение нейропатии неэффективным.
- В связи с повышенным риском трофических язв стоп пациентам с ДПН обязательно обучение специальным правилам ухода за ногами, при необходимости – смена обуви, изготовление ортопедической (Обучение и подбор обуви снижают риск диабетических язв в 2-4 раза – значительно больше, чем медикаментозное лечение.2).
IV. Медикаментозное лечение ДН.
- Нейротропные препараты. Цели: улучшить функцию периферических вегетативных нервных волокон, замедлить прогрессирование ДН, уменьшить симптоматику ДН.
– a-липоевая кислота: 600 мг в/в кап. 2-3 недели, далее – внутрь по 600 мг утром натощак – 2-3 мес.;
– Витамины группы В (в высоких дозах или жирорастворимые формы) – курсами по 1-2 мес (более целесообразны при сочетании ДН с алкогольной нейропатией).
- Симптоматические средства. Цель: уменьшить проявления ДПН (при выраженной симптоматике). Продолжительность лечения – до 9-12 мес. Используемые препараты представлены в таблице 1.
V. Физиотерапия, массаж – временный симптоматический эффект.
Источник
Под инфицированностью подразумевается лабораторное определение вида микрофлоры и клинические проявления воспаления.
Степень ишемии определяется по Покровскому-Фонтейну в случае наличия стенозов и окклюзий магистральных артерий.
Особое внимание необходимо уделять пациентам с атероматозом (55-64% больных с диагнозом «СД»). Атероматоз (развитие атеросклеротической бляшки) повреждает артериальные сосуды различного калибра: стенозы и окклюзии сосудов. Течение атероматоза в основном тяжёлое и имеет несколько особенностей:
- Поражаются дистальные отделы ноги (задняя и передняя большеберцовая, а тыльная артерия стопы) симметрично артериям обеих ног и на разных уровнях. Причём эти нарушения проявляются у людей более раннего возраста, по сравнению с пациентами без сахарного диабета.
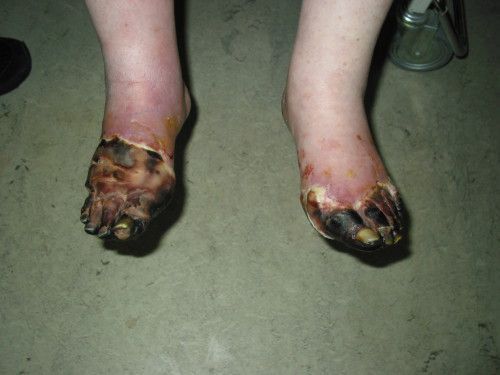
- Самостоятельно (т. е. без механического воздействия и травм или при незначительном воздействии) возникает некроз тканей и формируются трофические язвы. Это связано с тем, что в капиллярную сеть стопы через магистральные артерии кровь поступает в недостаточном количестве и при значительном нарушении микроциркуляции происходит некроз не только кожи, но и мышц, сухожилий. Результат — гангрена, причём чаще влажная чем сухая.
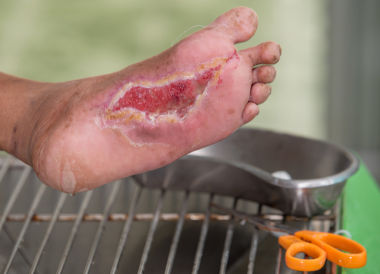
На фоне снижения чувствительности, боль от микротравм и потертостей не ощущается пациентом. Даже язва под сухим струпом на подошвенной поверхности стопы может остаться незамеченной длительное время. Дном язвы могут быть кости и сухожилия.
Самыми драматичным последствием СД и СДС является ампутация конечности на различных уровнях:
- малая ампутация — в пределах стопы;
- высокая ампутация — на уровне голени и бедра.
Также возможен летальный исход больного по причине гнойно-некротического процесса (сепсис или ТЭЛА).
Диагноз «СДС» устанавливается при первом хирургическом осмотре. Проводится дифференциальная диагностика между нейропатической и ишемической стопой.
Отсутствие боли в области язвы — один из характерных признаков нейропатической ДС.
Также необходимо отличать трофические расстройства от чувства онемения и зябкости: «носки», «чулки» до отсутствия всех видов чувствительности.
Для определения расстройства чувствительности, кроме градуированного камертона, можно использовать электронные инструменты: биотензиометр или нейротензиометр.
При триплексном сканировании артерий нижних конечностей выявляется:
- утолщение и кальциноз периферических артерий (синдром Менкеберга);
- изменение скорости кровотока — подтверждает ишемический характер СДС.
На практике достаточно описать вид тканей в области язвы на подошвенной поверхности стопы, головок плюсневых костей или ногтевых фаланг пальцев стоп.
Лечением диабетической стопы в большинстве случаев занимаются врачи-хирурги, однако также рекомендуются консультации таких врачей, как ортопед, травматолог, невролог, сосудистый хирург, дерматолог и подиатр.
На практике терапевт, эндокринолог или хирург устанавливает диагноз «Диабетическая стопа». На основании жалоб пациента, объективных и локальных данных врач назначает консультацию «узкого» специалиста и лечение.
Принципы лечения СДС:
- комплексный подход;
- отказ от самолечения;
- своевременное обращение к врачу — промедление в лечении может стать причиной ампутации или летального исхода пациента.
Недостаточно корригируемый уровень глюкозы в крови поддерживает высокую активность микроорганизмов в области язвенного дефекта, а углубление воспалительного процесса тканей в области язвы приводит к увеличению уровня глюкозы крови. Таким образом возникает «порочный круг» СДС: гипергликемия – инфекционный процесс – гипергликемия.
Постоянный контроль показателей крови и коррекция лечебных процедур более эффективны в стационарных условиях.
Пациентов с СДС в 80% случаев госпитализируют в хирургический стационар. Показаниями для этого служат:
- системные проявления инфекции (лихорадка, лейкоцитоз и др.);
- необходимость в коррекции глюкозы крови и ацидоза;
- клинические признаки ишемии;
- наличие глубокой и/или быстро прогрессирующей инфекции, некротического участка на стопе или гангрены;
- необходимость экстренного хирургического вмешательства или обследования;
- невозможность самостоятельного выполнения назначений врача или домашнего ухода.
Медикаментозное лечение
Существует несколько видов препаратов, применяемых при консервативном лечении СДС:
- инсулинотерапия;
- ангиопротекторы:
- замедляют образование фермента гиалуронидазы или подавляют активность ее производных;
- обладают антибрадикининовым свойством;
- способствуют угнетению агрегации тромбоцитов;
- активируют процесс образования мукополисахаридов в стенках капилляров;
- нормализуют проницаемость стенок сосудов;
- регулируют сосудистый тонус, восстановливают функции эндотелия, уменьшают оксидативный стресс и воспалительную реакцию;
- антиагреганты — ацетилсалициловая кислота («Аспирин», «Тромбо АСС», «КардиАСК», «Тромбопол») — подавляют активность циклооксигеназы, фермента, усиливающего реакции синтеза тромбоксана (фактора склеивания тромбоцитов);
- антидепрессанты и противосудорожные препараты;
- антибиотики — применяются на основании лабораторного анализа отделяемого из язвы и классификации инфекционных осложнений у пациентов с СДС по тяжести процесса.
- препараты, влияющие на обмен веществ — тиоктовая кислота и комплекс витаминов:
- ускоряют распространение импульсов по нервным волокнам;
- нормализуют кровообращение в тканях;
- избавляют от дефицита клеточных ферментов;
- выводят токсины из организма.
Эффективность всего комплекса медикаментозной терапии инфекции у пациентов с СДС по разным авторам составляет:[1][2][3][4]
- 80-90% при лёгкой и средней тяжести заболевания;
- 60-80% при тяжёлом течении.
Хирургическое лечение СДС
Оперативное вмешательство показано в следующих случаях:
- опасность распространения процесса от дистальных отделов конечности к проксимальным при условии неэффективной медикаментозной терапии;
- при ограничении положительного эффекта выраженной сухой гангреной части стопы или пальцев.
Хирург выбирает тактику проведения оперативного вмешательства исходя из клинической картины и формы инфицированности.
Физиотерапевтические методы лечения
Данный метод лечения предполагает ограниченное индивидуальное применение.
Физиотерапия часто проводится на стадии реабилитации после хирургического лечения. Она предполагает:
- нормализацию всех видов обмена веществ в организме и в тканях непосредственно;
- снижение уровня глюкозы в крови;
- нормализацию уровня иммунореактивного инсулина в крови;
- стимуляцию кровообращения и снижение воздействия антагонистов инсулина;
- снятие болей при ангиопатии и нейропатии.
К методам физиотерапии относятся:
- магнитотерапия — непосредственно влияет на обмен веществ при нейропатической форме ДС, так как магнитное поле обладает иммуно-стимулирующим, трофико-регуляторным и анестезирующим действием, укрепляя сосудистую стенку.
- УВЧ, теплотерапия;
- СМТ-терапия;
- светолечение;
- фонофорез.
Также лечение СДС предполагает:
- соблюдение специальной диеты;
- выполнение лечебной гимнастики;
- уход за кожей.
Неблагоприятному сценарию развития болезни способствуют следующие факторы:
- системные проявления инфекции;
- тяжёлые нарушения периферического кровотока в конечности;
- остеомиелит;
- некротические участки и гангрена;
- отсутствие квалифицированной хирургической помощи;
- распространение инфекции на более проксимальные отделы конечности.
Рецидивы в 20-30%, по большей части, характерны для пациентов с остеомиелитом.
Более 65% всех ампутаций проводится при диабетической стопе, однако своевременная профилактика и полноценное лечение может сберечь минимум 80% конечностей.
Своевременная диагностика и профилактика сахарного диабета за последнее десятилетие позволили уменьшить число ампутаций при СДС почти на 50%. Летальные исходы после ампутаций при СДС остаются на уровне 25-28%. Но при этом реальное количество больных СД в 3-4 раза выше, так как многие и не подозревают о том, что больны. Вероятность выявить таких больных во время предварительных и периодических медицинских осмотров очень велика.
Применяемая методика диспансеризации, неформальный подход к интерпретации анализов крови при периодических и предварительных медицинских осмотрах позволяет врачу-специалисту вовремя заподозрить нарушение углеводного обмена, а значит вовремя предотвратить развитие тяжёлых осложнений при сахарном диабете.
В качестве профилактики СДС, особенно людям с сахарным диабетом, необходимо:
- следить за уровнем сахара в крови;
- заниматься лечением СД;
- стараться не ходить босиком;
- носить ортопедическую обувь;
- не удалять появляющиеся мозоли;
- отказаться от вредных привычек (в частности, курения);
- избегать ожогов и переохлаждения стоп;
- ежедневно осматривать стопы для своевременного обнаружения трещин, шелушения и других признаков.
- Аметов А.С. Сахарный диабет 2 Типа: проблемы и решения. — М.: ГЭОТАР-Медиа, 2012.
- Майоров А.Ю., Суркова Е.В. Сахарный диабет1 Типа. — М.: Перспектива, 2007.
- Бреговский В.Г., Зайцев А.А. Поражение нижних конечностей при сахарном диабете. — М., 2004.
- Дедов И.И., Удовиченко О.В., Галстян Г.Р. Диабетическая стопа // Практическая медицина. — М., 2005.
- Славин Л.Е., Годжаев Б.Н., Анчикова Л.И. Синдром диабетической стопы // Практическая медицина. — 2008. -—№ 27. — С. 54-57.
- Wagner FW. A classification and treatment program for diabetic, neuropatic and dysvascular foot problems. // In The American Academy of Ortopaedic Surgeons instructional course lectures. — St. Louis. — Mosby Year Book. — 1979. — P. 143-165.
- Оболенский В.Н., Семенова Т.В., Леваль П.Ш., Плотникова А.А. Синдром диабетической стопы в клинической практике // Русский медицинский журнал. — 2010. — № 2. — С. 45.
- Armstrong DG, Lavery LA, Harkless LB: Validation of a diabetic wound classification system. Diabetes Care 21: 855-859,1998.
- Храмилин В.Н., Демидова И.Ю. Синдром диабетической стопы: Методическое пособие для самоподготовки слушателей циклов усовершенствования врачей. — М., 2004. — 54 с.
Источник
