Гемолитико уремический синдром у детей реферат
Гемолитико-уремический синдром (болезнь Гассера) является одним из немногих приобретенных заболеваний, встречающихся обычно в детской возрастной группе. Вероятно, данный синдром охватывает целый спектр заболеваний, варьируя от классической саморазрешающейся формы у детей грудного возраста до более грозной и часто фатальной тромбоцитопенической тромбо-гемолитической пурпуры (болезнь Мошкович), наблюдаемой у взрослых. Для этих заболеваний характерна общая триада: острая почечная недостаточность с олигурией, гемолитическая анемия и тромбоцитопения. Однако заболевания, протекающие под прикрытием болезни Гассера, могут также иметь ту или иную степень артериальной ангиопатии, гипертензии и поражения ЦНС, кишечника или печени.
Хотя общий знаменатель, который связывал бы различные формы болезни или служил базисом для их классификации или выбора лечения, еще не найден, некоторые из недавних основных научных достижений помогают проникнуть в суть данной проблемы.
Повреждение эндотелиальных клеток играет центральную роль в патогенезе почечных поражений, гемолиза и тромбоцитопении. Повреждение эндотелия может ограничиваться капиллярными мембранами, но не исключено и вовлечение артерии. Такое разграничение может помочь в более детальном классифицировании и прогнозировании, а также объяснении природы большой группы симптомов. Механизм повреждения эндотелия в настоящее время является объектом споров и научных исследований. Идентифицировано по меньшей мере 5 агентов, способных оказывать повреждающее действие на эндотелиальные клетки при болезни Гассера: эндотоксин, нейраминидаза, эстроген – содержащие контрацептивы, истинный цитотоксин (веротоксин), продуцируемый некоторыми штаммами кишечной палочки, и токсин, вырабатываемый бактериями Григорьева – Шиги. Во время эпидемий Гемолитико – уремического синдрома было выделено несколько видов вирусов, чаще всего Коксаки, ECHO и аденовирус, но без четкой связи с заболеванием. Более убедительным является развитие данного синдрома у больных с инфекциями, вызванными шигеллой, сальмонеллой, цитотоксической, кишечной палочкой или пневмококком. В настоящее время внимание исследователей сосредоточено на веротоксин-продуцирующей E. Coli (VTEC O157:H7) и Shigella disenteriae type1. Болезнь Гассера может также наблюдаться у женщин, принимающих гормональные контрацептивные средства, содержащие эстроген, или у беременных. Некоторые исследования отмечают высокую частоту возникновения Гемолитико – уремического синдрома при использовании ампициллина для лечения дизентерии вызваной Shigella disenteriae type1.[3]
Повреждение эндотелиальных клеток затрагивает и приводит в действие целый ряд вторичных процессов: локальное внутрисосудистое свертывание крови, слипание тромбоцитов и агрегацию тромбоцитов. У большинства больных отмечаются появление продуктов распада фибрина в циркулирующей крови и тромбоцитопения. Наличие циркулирующих мономеров фибрина (указывает на продолжающееся внутрисосудистое свертывание) определяется у меньшинства больных; предполагается, что у большинства больных к моменту обращения за медицинской помощью внутрисосудистое свертывание прекращается. Фактически во всех случаях наблюдается отложение фибрина в сосудах почечных клубочков, что приводит к сужению или облитерации просвета капилляров, снижению скорости клубочковой фильтрации и уменьшению перфузии почечных канальцев с их вторичной дисфункцией или некрозом. У большинства больных с болезнью Гассера возникает тромбоцитопения, которая обусловлена как возросшим потреблением тромбоцитов, так и сокращением периода их жизни. Более того, циркулирующие в крови тромбоциты неполноценны; в них меньше серотонина, аденозиндифосфата, бета-тромбоглобулина и снижена способность к агрегации, что предполагает их истощение . Значение этих факторов и развитии поражений почек или ЦНС не установлено, однако при возникновении у больного геморрагических осложнений тромбоцитопении следует помнить о сниженной функции тромбоцитов.
Другим удивительным фактом является очевидное снижение продукции простациклина (PGJ2
) эндотелиальными клетками у некоторых больных с болезнью Гассера и членов их семей. Простациклин является эндогенным ингибитором агрегации тромбоцитов. Это предполагает, что у некоторых людей имеется генетический дефект, который может привести к болезни Гассера, если этиологический фактор вызовет повреждение сосудов. Такой механизм может быть причиной заболевания в наблюдавшихся семейных случаях.
У больных с Гемолитико-уремическим синдромом при снижении гематокрита до 10-15 % быстро возникает гемолитическая анемия. Реакция Кумбса, как правило, бывает отрицательной, а осмотическая резистентность и ферменты эритроцитов находятся в пределах нормы. Таким образом, анемия у них обусловлена, вероятно, микроангиопатией, приводящей к повреждению эритроцитов во время их продвижения по измененной капиллярной сети. Выживаемость перелитых с кровью клеток также снижена. Главной причиной повреждения эритроцитов является механическая травма, чему в ряде случаев способствует измененный антиоксидантный статус эритроцитов.
Наконец, как показывают проведенные за последнее десятилетие исследования, при болезни Гассера в процесс вовлекаются и другие органы, особенно печень и мозг, а также сердце и легкие, возможно, вследствие все той же микроангиопатии, обсуждавшейся выше. Судороги, ступор или кома нередко бывают осложнением гемолитико-уремического синдрома, и их нельзя объяснить только гипертензией, вызванной почечной недостаточностью, или нарушением электролитного баланса. Тем не менее патологические изменения в мозге детей, умерших от болезни Гассера, были неспецифическими (отек, некроз клеток); микротромбы (предположительно вследствие повреждения сосудов) обнаружены лишь в нескольких случаях.
Продромальное заболевание обычно на несколько дней или недель предшествует болезни Гассера и чаще всего проявляется диареей и рвотой. Кровавый стул отмечается не всегда, но довольно часто. Реже заболеванию предшествует инфекция верхних или нижних дыхательных путей или вирусная инфекция . Затем, прежде чем синдром начнет проявляться, может последовать короткий период относительно хорошего состояния. Наблюдаемые симптомы варьируют в зависимости от тяжести заболевания и вовлечения в процесс различных органов. Часто при первом обращении к врачу, связанном с жалобами на бледность или вялость ребенка, обнаруживаются анемия и уремия. Гемолитико-уремический синдром может также проявляться абдоминальными симптомами, симулирующими острый живот или язвенный колит, с кровавой диареей и болезненностью брюшной стенки при надавливании.
Симптомы заболевания широко варьируют как при вне почечных, так и при почечных проявлениях. Различия в тяжести заболевания связаны скорее с экстраренальными проявлениями, нежели с выраженностью и продолжительностью почечной недостаточности. У нетяжелых больных наблюдаются анемия, тромбоцитопения и азотемия, у более тяжелых – олигурия или анурия и гипертензия. У самых тяжелых больных могут также отмечаться упорные судороги, кома, легочная недостаточность или признаки миокардита.
Дифференциальный диагноз болезни Гассера включает септицемию и неотложные абдоминальные хирургические состояния с сопутствующей преренальной олигурией или острым тубулярным некрозом (заворот кишок с инфарктом, непроходимость кишечника, перфорация кишечника, дивертикул подвздошной кишки, слизистая колика). однако в мазках крови при болезни Гассера обычно определяется гемолиз, а абдоминальные признаки, как правило, обнаруживают доброкачественный характер. Факторы тяжелого васкулита при почечной недостаточности редко выявляются в детском возрасте (например, люпус-нефрит) и обычно не вызывают тромбоцитопении.
Включает выявление наличия тромбоцитов в мазке и определение числа лейкоцитов, коагуляционного профиля, содержания электролитов, функции печени, измерение уровня азота мочевины в крови и креатинина, а также культуральные исследования крови и кала. Особое внимание следует уделить выявлению патогенных штаммов кишечной палочки, в частности 0157:Н7, которому приписывается ведущая роль: в патогенезе болезни Гассера . У детей со значительными нарушениями психики, судорогами или патологическими изменениями, обнаруженными при неврологическом исследовании, можно произвести компьютерную томографию черепа и поясничную пункцию для исключения кровотечения или менингита. Рутинная биопсия почки не показана, она проводится лишь в атипичных случаях и при необходимости инструментального исследования.
В настоящее время при болезни Гассера осуществляется поддерживающее лечение, направленное на сохранение гематокрита) в приемлемых пределах, на нормализацию содержания электролитов в сыворотке и поддержание водного баланса, а также на борьбу с гипертензией и судорогами. Раннее проведение перитонеального диализа для коррекции биохимических показателей сыворотки и восстановления объема крови снижает смертность, тяжелобольных с 77% до менее чем 10%.
Рутинный непрерывный мониторинг в отделении интенсивной терапии включает контроль за ЭКГ. Для контроля за внутрисосудистым объемом и серийного получения проб крови для лабораторных анализов устанавливают центральновенозный катетер У больных с лабильной (транзиторной) гипертензией целесообразно использование внутриартериального катетера. Катетер для выведения мочи позволяет выполнять точное количественное определение диуреза и клиренса креатинина. В случае анурии этот катетер удаляют ввиду риска инфицирования.
Количество жидкостей, не содержащих натрия или калия, ограничивают объемом, необходимым для возмещения неощутимых потерь воды (300 мл/м2
в день) плюс ее потеря с мочой и фекалиями. Другие виды поддерживающего лечения, имеют своей целью контроль за гиперкалимией, гипертензией и судорогами, если они возникают. Гиперкалиемию, если она не является неотложным состоянием, можно лечить с помощью катионообменных смол; глюкоза, инсулин и хлорид кальция используются при неотложной терапии. При не значительно выраженной или умеренной гипертензии лечение начинают с диализа для уменьшения внутрисосудистого объема; если симптомы сохраняются, назначают сосудорасширяющие средства. Для предупреждения тахикардии и повышения эффективности лечения можно добавить бета – блокаторы, такие как анаприлин. Тяжелая гипертензия лучше всего лечится с помощью непрерывной инфузии нитропруссида натрия при постоянном АД-мониторинге с использованием внутриартериального катетера. При сохранении гипертензии после окончания острой фазы болезни можно перевести больного на пероральный прием гипотензивных средств.
Осуществляется ежедневный контроль за гематокритом и числом тромбоцитов. Если гематокритное число меньше 20 %, больному переливают эритроцитную массу. Необходимо иметь под рукой запас крови на случай внезапного снижения гематокритного числа в результате гемолиза или кровотечения. Переливание тромбоцитов производится при определении их числа ниже 20,0*109
/л или при наличии клинических признаков кровотечения.
Сообщалось о применении антикоагулянтной терапии гепарином или противотромбоцитарными средствами, а также фибринолитической терапии стрептокиназой, однако число проспективных контролируемых исследований их эффективности пока невелико. Антикоагулянтная терапия, не дает немедленного антитромботического эффекта, но способна оказывать продолжительное благоприятное влияние на гипертензию и протеинурию в тяжелых случаях при комбинированном назначении гепарина и стрептокиназы. Однако антикоагулянтная терапия сопряжена со значительным риском геморрагических осложнений; у большинства детей выздоровление наступает без ее применения.
Немногочисленные литературные данные не позволяют дать окончательную оценку эффективности плазмафереза при лечении болезни Гассера. Описано лишь два случая такого лечения; в одном из них уровень креатинина в сыворотке крови начал снижаться еще до проведения плазмафереза на 14-й день болезни. Оценивалась также эффективность повторного переливания плазмы при лечении болезни Гассера у 10 детей и 7 взрослых. Отсутствие данных о проведении исследований в контрольной группе затрудняет интерпретацию полученных результатов; в целом же исход болезни был не лучше обычно наблюдаемого при стандартном лечении. У 2 больных (13 %,) в результате переливания развился сывороточный гепатит. Степень риска по отношению к эффективности рутинного переливания плазмы, по-видимому, слишком высока, что не позволяет рекомендовать повторные переливания плазмы больным с неослож ненной болезнью Гассера. Более определенно установлена положительная роль плазмафереза или переливания плазмы в лечении специально отобранных больных с рецидивирующим гемолитико-уремическим синдромом или с явными признаками нарушения синтеза простациклина.
На основании существующих клинико-патологических корреляций можно выделить подгруппы форм гемолитико-уремического синдрома, что помогает врачу в выборе лечения и прогнозировании исхода. Классическая форма болезни Гассера, наблюдаемая у маленьких пациентов, проявляется преимуществвенно поражением почечных клубочков и имеет хороший прогноз (табл. 1).
Таблица 1. Прогноз ГУС при разных формах заболевания.
| Форма болезни | Возраст | Возможная этиология | Прогноз |
| Классическая | <2лет | Кишечная палочка Веротоксин | Хороший |
| Постинфекционная | Любой | Эндотоксины, нейраминидаза | Хороший |
| Наследственная | Любой | Нарушение метаболизма простациклина | Плохой: может прогрессировать до хронической почечной недостаточности |
| Аутоиммунная | Молодые взрослые | Активация комплемента | Плохой |
| Связанная с беременностью | Молодые взрослые | Неизвестна | Плохой |
| Прочие | Любой | Связана с коллагенозом | Изменчивый |
У детей старшей возрастной группы и у взрослых отмечаются большая выраженность артериальной ангиопатии, более тяжелая гипертензия и вовлечение многих органов;в среднем у них выше летальность и частота отдаленных последствий. Помимо возрастного фактора, неблагоприятными прогностическими признаками являются отсутствие такого предвестника, как диарея , рецидивирование болезни и определение ее наследственной формы. Другими словами, прогноз хуже в тех случаях, когда наблюдаемые проявления болезни расходятся с ее классическим описанием. На противоположном конце спектра форм гемолитико-уремического синдрома находится болезнь Мошкович (тромбоцитопеническая тромбогемолитическая пурпура), часто фатальное заболевание с более тяжелым неврологическим вовлечением и менее выраженным заболеванием почек.
Хотя серьезное поражение ЦНС является плохим прогностическим признаком, у больных, выживших после острой стадии болезни, может наблюдаться ослабление симптомов со стороны ЦНС. Сообщилось о 5 случаях выздоровления детей после продолжительной комы, осложнившей течение болезни Гассера. Как показывают данные аутопсии, у больных, скончавшихся после острой стадии болезни Гассера, микроэмбо лы не обнаруживаются ни в мозге, ни в других органах, кроме почек; тогда как у детей, умерших во время острой фазы, наличие микротромбов обычно определяется во многих органах. Это предполагает, что гистологические изменения вне почек со временем разрешаются.
Долгосрочный прогноз при болезни Гассера, по-видимому, хороший. Критическим при острой стадии заболевания является 2-недельный срок . Необходимость проведения диализа в течение менее 2 недель предполагает последующую нормализацию функции почек. Необходимость же продолжения перитонеального диализа дольше этого срока указывает на возможное сохранение
частичной дисфункции почек, хотя необратимость почечной недостаточности может быть констатирована лишь через несколько месяцев.
Литература:
1.Интенсивная терапия в педиатрии
. Под ред. Дж. П. Моррея, М. 1995.
2. Неотложные состояния в педиатрии
. Под ред. В. М. Сидельникова, Киев 1994.
3. Emerging Infectious Diseases
, Vol.1, No. 4 – October-December 1995, pages 134-140
(
доступно по
WWW –
https://www.cdc.gov/ncidod/EID/eid.htm )
Источник
В 1955 г. C. Gasser с соавторами описали наблюдавшееся ими у 5 детей заболевание, которое представляло собой сочетание острой почечной недостаточности (ОПН) с гемолитической анемией и тромбоцитопенией, развивающимися на фоне инфекционной диареи (E. coli, Sh. dysenteriae, S. pneumoniae), и назвали его гемолитико-уремическим синдромом (ГУС).
Эпидемиология
С данным синдромом должен быть знаком каждый педиатр, ведь ГУС является основной причиной развития ОПН у детей до 3-х лет. Частота возникновения ГУС у детей данного возраста составляет 2–3 случая на 10 тысяч детей. Причем в разных регионах заболеваемость типичным ГУС (тГУС) значительно варьирует (в зависимости от численности сельского населения, особенностей водоснабжения — в Аргентине и Уругвае эшерихиоз эндемичен, поэтому частота достигает 10 случаев на 100 тыс. населения в год; в более холодных регионах заболеваемость также выше — в Шотландии, по сравнению с Англией, в 2 раза выше — 3,4 vs 1,54 на 100 тыс. населения в год). Для тГУС чаще характерны эпидемические подъемы заболеваемости, но могут быть и спорадические случаи (более характерно для атипичного ГУС). Резервуаром инфекции являются фекалии крупного рогатого скота (E. coli O157 длительно выделяют в стуле Shiga like toxin (Stx) 2 типа). Человек заражается при употреблении сырой телятины, непастеризованного молока, загрязненных фруктов и овощей, контаминированной воды из колодца и водоемов, а также при неисправностях водопровода. Прямой контакт детей с животными или их испражнениями и передача от человека к человеку являются не менее важными механизмами передачи этой инфекции.
Классификация
Официальной классификации ГУС нет. По причинам возникновения выделяют инфекционные и неинфекционные формы (рис. 1). К инфекционным формам ГУС относят:
- ГУС, ассоциированный с шига-токсином (Sh. dysenteriae тип 1);
- ГУС, ассоциированный с микроорганизмами, секретирующими нейраминидазу (S. pneumoniae);
- ГУС, ассоциированный с ВИЧ-инфекцией, и др.
К неинфекционным формам относят идиопатический ГУС, наследственный ГУС (связанный с аномалиями ADAMTS-13), лекарственно-индуцированный ГУС (прием ингибиторов mTOR или ингибиторов VEGF) и другие формы.

Рисунок 1 | Классификация ГУС
Помимо вышеописанной классификации, ГУС можно отнести к первичным тромботическим микроангиопатиям (ТМА), этиология и патогенез которых установлены:
- ГУС, индуцированный инфекцией или ассоциированный с диареей (тГУС, ГУС-(D+));
- Атипичный ГУС, обусловленный генетическими нарушениями или изменениями иммунной системы, приводящими к патологии системы комплемента (аГУС, ГУС-(D–));
- Тромботическая тромбоцитопеническая пурпура (ТТП, болезнь Мошковица), связанная с аномалиями фермента ADAMTS-13 (врожденная или приобретенная).
Патогенез
Типичный ГУС
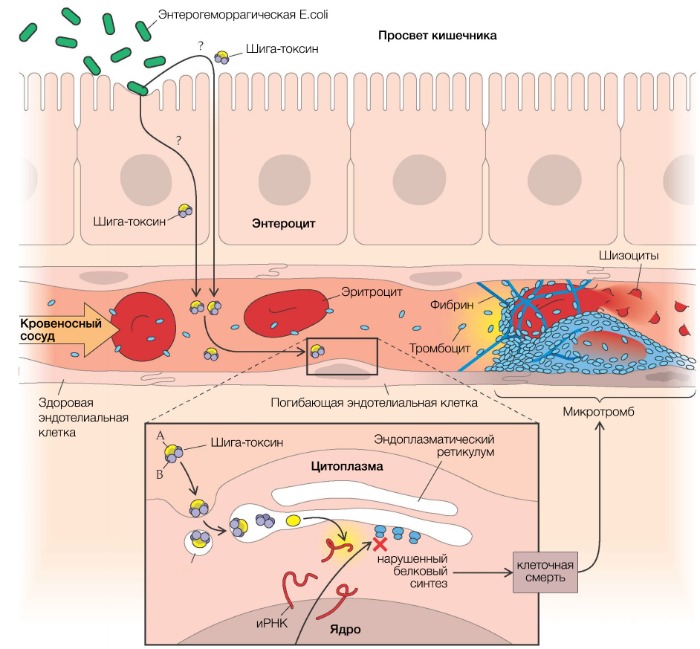
Основным фактором, инициирующим развитие тГУС, который обусловливает до 80 % от общего числа случаев заболевания, является энтерогеморрагическая кишечная палочка (E. coli, EHEC, серотип О157:Н7), синтезирующая шигаподобный токсин (веротоксин 1 и/или 2 типа). Данный штамм обладает высокой патогенностью для человека (для заражения достаточно 103 микроорганизмов), однако диарея развивается только в каждом 10-м случае (рис. 2).

Рисунок 2 | Патогенез тГУС, ассоциированного с EHEC
После попадания E. coli в кишечник она связывается с ворсинками подвздошной кишки и эпителиальными клетками пейеровых бляшек при помощи специального белка, вызывая в конечном итоге гибель клеток с развитием диареи, переходящей в гемоколит (его возникновение связано с веротоксином, который способен повреждать сосуды слизистой оболочки кишечника). Шигаподобный токсин (SLT, Stx), высвобождающийся из кишечника, попадает в печень, где часть его метаболизируется, а другая часть попадает в системный кровоток, вызывая повреждение эндотелия органов-мишеней (легкие, почки, головной мозг).
SLT транспортируется в крови в основном нейтрофилами, но может перемещаться по системному кровотоку и при помощи моноцитов, тромбоцитов и/или их комплексов (липополисахарид кишечной палочки связывается с тромбоцитами, вызывая их активацию и агрегацию). За счет субъединицы В Stx имеет высокое сродство к мембраносвязанным гликосфинголипидам — Gb3/Gb4-рецепторам (в 100 раз выше, чем таковое с нейтрофилами).
В связи с этим повреждение эндотелия ярко выражено в мелких сосудах почек, но не в крупных сосудах других «возможных» органов-мишеней (экспрессия рецепторов Gb на мембранах эндотелиальных клеток почечных клубочков в 50 раз выше, чем в других тканях и органах). Помимо клеток эндотелия почечных клубочков, мезангиальных клеток, подоцитов, Gb-рецепторы в большом количестве синтезируются на мембранах нейронов и глиальных клеток. После проникновения Stx (за счет А субъединицы) внутрь клетки происходит блокирование синтеза белков путем инактивации рибосомальных субъединиц (60S) с последующим апоптозом этих клеток.
Помимо этого, ЛПС, концентрация которого в крови прямо коррелирует с таковой у шига-токсина, обусловливает повышенную продукцию провоспалительных цитокинов — интерлейкинов 1, 6, 8, а также фактора некроза опухоли-альфа (TNF-α). Те, в свою очередь, повышают экспрессию рецепторов на мембранах связывающих их моноцитов, приводя тем самым к более выраженному токсическому эффекту Stx.
Патогенез ГУС, вызванного Shigella dysenteriae 1 типа, схож с таковым у E. coli (рис. 3, 4, 5). Однако этот тип ГУС протекает тяжелее, чем ГУС, ассоциированный с шигаподобным токсином E. coli. Связано это, скорее всего, с липополисахаридным эндотоксином шигелл, который путем сложного взаимодействия с рецепторами TLR4 (на мембранах клеток) и NLR 1, 2 (Nod like receptors, расположены внутриклеточно) вызывает активацию сигнального пути NF-kB, что, в свою очередь, приводит к массивному выделению интерлейкина 8, являющегося мощным хемокином для нейтрофилов, макрофагов и лимфоцитов. Активированные нейтрофилы путем массивного выброса воспалительных цитокинов, помимо повышения секреции специфических рецепторов на мембранах эндотелиоцитов, вызывают активацию перекисного окисления липидов (ПОЛ), приводящего к повреждению не только эндотелия, но и эритроцитов, а также активацию лизосомальных ферментов, например, эластазы или α1-антитрипсина, которые также усугубляют эндотелиальное повреждение.
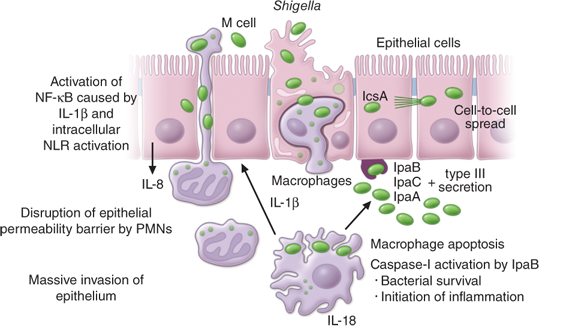
Рисунок 3 | Патогенез тГУС, ассоциированного с Shigella dysenteriae
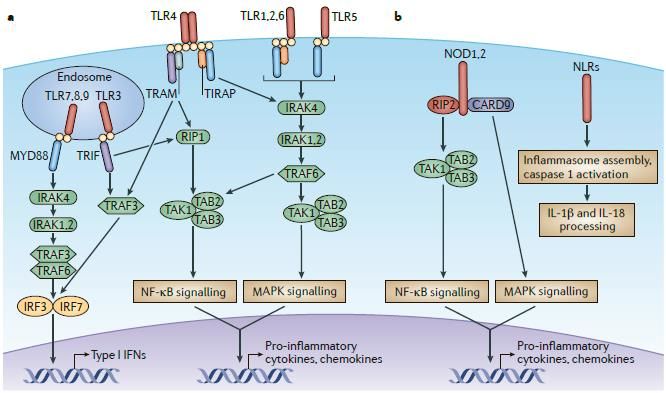
Рисунок 4 | Рецепторы TLR4 и NOD 1-2, через которые Shigella dysenteriae активирует сигнальный путь NF-kB
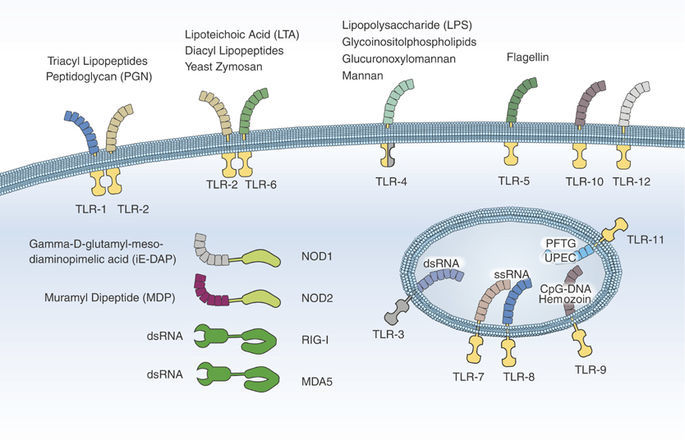
Рисунок 5 | Молекулярная основа патогенеза тГУС, ассоциированного с Shigella dysenteriae
ГУС, ассоциированный со Streptococcus pneumoniae, имеет несколько другой патогенез (рис. 6). Нейраминидаза S. pneumoniae атакует ацетилнейраминовую кислоту поверхности эндотелиальных клеток почечных клубочков, эритроцитов и тромбоцитов, обнажая при этом T-антиген (антиген Томсена-Фриденрайха). После «открытия» этих антигенов происходит усиление продукции Ig класса M, что, в свою очередь, приводит к агглютинации тромбоцитов и эритроцитов. По сути, эндотелий почечных клубочков повреждается как напрямую, так и иммуноопосредованно.
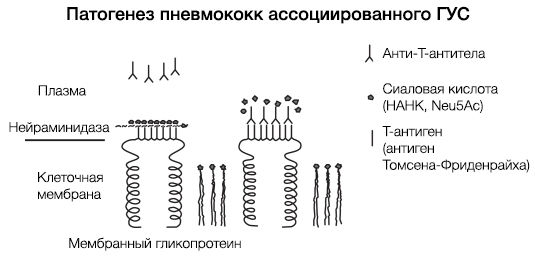
Рисунок 6 | Патогенез тГУС, ассоциированного со Streptococcus pneumoniae
В связи с этим происходит локальное изменение реологических свойств крови. Так называемый «shear stress» (связан с различной скоростью движения слоев крови), возрастающий при повреждении эндотелиальных клеток, помимо увеличения продукции NO (связано с раздражением механорецепторов), активирующего оксидативный стресс и инициирующего апоптоз эндотелиоцитов, также приводит и к агглютинации тромбоцитов. Основным звеном этой агглютинации является фактор Виллебранда (ФВ), который обычно накапливается в альфа-гранулах тромбоцитов и в тельцах Вайбеля-Паладе эндотелиальных клеток. Как говорилось выше, раздражение сосудистой стенки почечных клубочков путем воздействия на их стенку оксида азота, а также возрастающего касательного напряжения («shear stress») приводит к высвобождению ФВ, который способен поддерживать активацию и агрегацию тромбоцитов и тромбообразование в почечных клубочках.
Атипичный ГУС
Патогенез атипичного ГУС (аГУС) разительно отличается от тГУС. В его основе лежат мутации регуляторных белков системы комплемента (чаще всего аГУС ассоциирован с мутацией комплементарного фактора Н (CFH), на втором месте располагается мембранный кофакторный протеин (MCP), тройку замыкает комплементарный фактор I (CFI)).
При активации комплемента образуется C3-конвертаза, расщепляющая C3 на малый (С3а) и большой (C3b) фрагменты, который и опсонизируется на поверхности микробной клетки и формирует мембраноатакующий комплекс (МАК), состоящий из C5b, C6, C7, C8 и C9, что приводит к осмотическому лизису этой клетки. Для того, чтобы активированная система комплемента не уничтожила собственные клетки, на их поверхности расположены белки-регуляторы (DAF и CR1); помимо этого, часть таких белков синтезируется в печени и циркулирует в плазме крови в неактивном состоянии. К таким белкам относят комплементарный фактор H (CFH), фактор I (CFI) и мембранный кофакторный протеин, закрепленный на поверхности клеток (CD46). Фактор I, главный из вышеперечисленных факторов, расщепляет C3b и C4b. Фактор Н и CD46 являются кофакторами фактора комплемента I (рис. 7). Первый из них связывается с гликозаминогликанами собственных клеток организма, отсутствующими на мембранах бактериальных клеток, а также ингибирует активность C3-конвертазы. При мутации данных регуляторных белков происходит утрата защиты эндотелиальных клеток от повреждения конечными продуктами активации альтернативного пути комплемента (рис. 8).
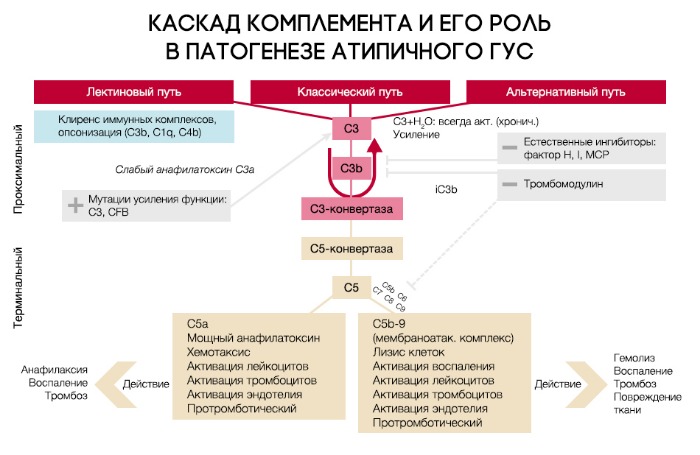 Рисунок 7 | Нормальная регуляция системы комплемента
Рисунок 7 | Нормальная регуляция системы комплемента
Рисунок 8 | Патогенез аГУС
Клиническая картина
В течении тГУС условно можно выделить 2 периода. Продромальный период характеризуется диареей, в ⅔ случаях диарею может сопровождать рвота. Гемоколит, характерный для тГУС, ассоциированного с шига-токсином, обычно развивается у каждого третьего больного через 2–3 дня после появления диареи.
Развернутая клиническая картина тГУС манифестирует в среднем на 5–6 день от начала диареи. Клиника крайне неспецифична. Бледность кожных покровов, общее недомогание, слабость, кожный геморрагический синдром в виде петехиальной сыпи или пурпуры, изменение цвета и уменьшение количества мочи после «кровавой» диареи должны насторожить врача в отношении тГУС (чаще всего диагностируется олигоанурическая стадия ОПН, требующая немедленного диализа).
Ввиду частой гиподиагностики адекватный контроль регидратации может отсутствовать, поэтому дополнительным признаком тГУС у детей можно считать артериальную гипертензию, которая отличается упорным течением и плохо поддается терапии. После восстановления нормального диуреза может отмечаться второй подъем АД, связанный с избыточной выработкой ренина.
Поражение ЦНС в виде генерализованных судорог, нарушения сознания вплоть до комы развивается в каждом четвертом случае и характеризует тяжесть течения тГУС.
Клиника аГУС имеет ряд особенностей!
Для аГУС характерно очень раннее начало (начиная с 2 месяцев при мутации CFI, c 6 месяцев при мутации CFH). Чаще всего аГУС манифестирует неспецифическими симптомами в виде общей слабости, недомогания без предшествующей этим симптомам диареи (при ее наличии затрудняется дифференциальный диагноз с тГУС). Возможно развитие гриппоподобного синдрома. У взрослых клиника может развиваться стерто, при этом классическая триада ГУС имеет слабую выраженность. Возможно развитие неполной триады без тромбоцитопении. Также для аГУС характерен семейный характер заболевания (в 25 % случаев имеется отягощенный наследственный анамнез). Большинство пациентов имеют выраженный отечный синдром вплоть до анасарки даже при отсутствии нефротического синдрома и ОПН. Также для больных с аГУС характерна АГ, связанная с перегрузкой объемом при манифестирующей ОПН или возникающая вследствие активации РААС, вызванной ишемией почечной ткани, обусловленной тромботической микроангиопатией. В отличие от тГУС, для атипичной формы характерно развитие кардиомиопатии с признаками острой СН. Описаны случаи развития острого панкреатита вплоть до панкреонекроза. В общем и целом клиника аГУС отличается яркой вариабельностью симптомов, что затрудняет ее своевременную диагностику (характерно рецидивирование).
Диагностика
Лабораторная диагностика как типичного, так и атипичного ГУС основана на выявлении признаков тромботической микроангиопатии:
- гемолитическая анемия — уровень гемоглобина ниже 90 г/л, выраженный ретикулоцитоз. Помимо этого, в крови могут появляться остатки эритроцитов — шизоциты (больше 1 %). Разрушение эритроцитов происходит из-за механического повреждения нитями фибрина при их прохождении через тромбированные сосуды почечных клубочков;
- тромбоцитопения ниже 150 тыс/мм3;
- выраженный лейкоцитоз выше 20 х 109/л; характеризует тяжесть ГУС.
Помимо этого, к неспецифическим признакам гемолиза эритроцитов можно отнести повышенный уровень ЛДГ, уменьшение уровня свободного гаптоглобина, гипербилирубинемию (за счет непрямой фракции). При проведении прямой пробы Кумбса результат будет отрицательным как у тГУС, так и аГУС.
Система диагностики ОПН, согласно критериям AKIN, основана на исследовании концентрации креатинина в сыворотке крови, СКФ, рассчитанной по формуле MDRD или CKD-EPI, а также на объеме мочи в течение суток. Для достоверной диагностики анурической стадии ОПН при подозрении на ГУС возможно выявление ранних признаков почечного повреждения (повышение уровня цистатина С, NGAL), а также повышения уровня калия крови выше 6 ммоль/л.
С целью подтверждения ГУС, связанного с шига-токсином, при наличии симптомов со стороны ЖКТ необходимо провести:
- посев кала на среду МакКонки для выявления серотипа E. coli O157:H7;
- определение шига-токсина в кале методом ПЦР или его выявление в сыворотке крови;
- возможно определение антител к липополисахариду эндемичного для данного региона серотипа E. coli.
Для исключения тромботической тромбоцитопенической пурпуры (ТТП) всем больным с характерной для ГУС клинической картиной необходимо определение активности ADAMTS-13 (менее 5 %). Для пациентов с аГУС типично снижение данного показателя, однако он в любом случае будет выше 10 % (в норме составляет 80–110 %).
Если при госпитализации больного в его анамнезе были выявлены предшествующие тромботические микроангиопатии, необходимо исследовать кровь на содержание С3 и С4 компонентов комплемента, а также на аутоантитела к фактору Н (анти-FH-антитела). Помимо этого, необходимо проведение дифференциальной диагностики со системными заболеваниями соединительной ткани (рис. 9). Развитие характерного симптомокомплекса во время беременности требует исключения специфической акушерской патологии.

Рисунок 9 | Дифференциальная диагностика ГУС
Лечение
Относительно специфическое лечение разработано только для атипичной формы ГУС. В настоящее время единственным допущенным до применения ингибитором системы комплемента является экулизумаб (рекомбинантное моноклональное антитело против компонента комплемента С5). Данный препарат блокирует расщепление С5 компонента комплемента (С5а — провоспалительный, C5b — протромботический компонент) и формирование на мембране собственных клеток МАК C5b-9.
Клинические испытания показали, что в профилактике и лечении аГУС экулизумаб оказался более эффективен, чем плазмаферез. Однако наилучшей схемой лечения считается введение препарата на фоне проведения плазмафереза, так как последний удаляет часть препарата из циркуляции, тем самым предотвращая развитие побочных реакций.
Введение свежезамороженной плазмы (СЗП) не предотвращает развитие терминальных стадий ХБП у больных с аГУС. Ее использование оправдано ввиду того, что СЗП является источником нормальных комплементарных факторов CFH и CFI. Как и в ситуации с экулизумабом, введение СЗП лучше сочетать с плазмаферезом (удаляются мутантные комплементарные факторы и анти-CFH антитела; удаление части плазмы предотвращает гиперволемию и следующую за этим острую сердечную недостаточность). Ввиду генетической детерминированности аГУС высок риск развития рецидива. Это, в свою очередь, требует проведение адекватной профилактической терапии, включающей в себя санацию очагов хронической инфекции, а также проведение своевременной вакцинопрофилактики. Трансплантация почки как метод лечения аГУС не имеет на данный момент широкой доказательной базы (описано всего 3 случая пересадки). Риск возврата аГУС сразу после трансплантации чрезвычайно высок, особенно у пациентов с мутацией комплементарного фактора Н.
Консервативное лечение тГУС заключается в проведении корректной регидратационной терапии. Как говорилось выше, неспецифичность клинической картины обусловливает высокий процент гиподиагностики, в связи с чем следующая за этим попытка коррекции водно-электролитного баланса оказывает отрицательный эффект (например, перегрузка объемом приводит в итоге к развитию острой сердечной недостаточности и активации РААС (гиперренинемии) — формируется резистентная к проводимой терапии артериальная гипертензия. Использование петлевых диуретиков, например, фуросемида, не оправдано; предпочтение стоит отдавать гемодиализу (на фоне гиперкалиемии или метаболического ацидоза) ввиду того, что диализ чаще всего начинается в олигоанурической стадии ОПН. При развитии анемии тяжелой степени (Hb ниже 70 г/л) показано переливание эритроцитарной массы. Антибиотики не являются основным компонентом терапии тГУС. Однако раннее назначение цефалоспоринов III поколения или фторхинолонов снижает риск развития тГУС, ассоциированного с S. dysenteriae типа 1.
Источники:
- Gasser C. et al. Hemolytic-uremic syndrome: bilateral necrosis of the renal cortex in acute acquired hemolytic anemia //Schweizerische medizinische Wochenschrift. – 1955. – Т. 85. – №. 38-39. – С. 905.
- Цыгин А. Н. и др. Федеральные клинические рекомендации по оказанию помощи детям с гемолитико-уремическим синдромом //Педиатрическая фармакология. – 2015. – Т. 12. – №. 4.
- Mayer C. L. et al. Shiga toxins and the pathophysiology of hemolytic uremic syndrome in humans and animals //Toxins. – 2012. – Т. 4. – №. 11. – С. 1261-1287.
- Boyer O., Niaudet P. Hemolytic uremic syndrome: new developments in pathogenesis and treatment //International journal of nephrology. – 2011. – Т. 2011.
- Taylor C. M. Enterohaemorrhagic Escherichia coli and Shigella dysenteriae type 1-induced haemolytic uraemic syndrome //Pediatric Nephrology. – 2008. – Т. 23. – №. 9. – С. 1425.
- Oliver J. W. et al. Pneumococcal induced T-activation with resultant thrombotic microangiopathy //Clinical Medicine Insights: Pathology. – 2010. – Т. 3. – С. CPath. S670.
- Чубуков Ж. А. Фактор Виллебранда и дисфункция эндотелия при стрессе //Проблемы здоровья и экологии. – 2012. – №. 2 (32).
- Fremeaux-Bacchi V. Pathophysiology of atypical hemolytic uremic syndrome. Ten years of progress, from laboratory to patient //Biologie aujourd’hui. – 2013. – Т. 207. – №. 4. – С. 231-240.
- Zhang K. et al. Atypical hemolytic uremic syndrome: a brief review //Hematology reports. – 2017. – Т. 9. – №. 2.
- Salvadori M., Bertoni E. Update on hemolytic uremic syndrome: diagnostic and therapeutic recommendations //World journal of nephrology. – 2013. – Т. 2. – №. 3. – С. 56.
- Козловская Н. Л. и др. Клинические рекомендации п?
