Эндотелиальная дисфункция в метаболическом синдроме
Что является причиной развития метаболического синдрома и инсулинорезистентности (ИР) тканей? Какова связь между ИР и прогрессированием атеросклероза? На эти вопросы пока не получено однозначного ответа. Предполагают, что первичным дефектом, лежащим в основе развития ИР, является дисфункция эндотелиальных клеток сосудов.
Эндотелий сосудов представляет собой гормонально активную ткань, которую условно называют самой большой “эндокринной железой” человека. Если выделить из организма все клетки эндотелия, их вес составит приблизительно 2 кг, а общая протяженность – около 7 км. Уникальное положение клеток эндотелия на границе между циркулирующей кровью и тканями делает их наиболее уязвимыми для различных патогенных факторов, находящихся в системном и тканевом кровотоке. Именно эти клетки первыми встречаются с реактивными свободными радикалами, с окисленными липопротеинами низкой плотности, с гиперхолестеринемией, с высоким гидростатическим давлением внутри выстилаемых ими сосудов (при артериальной гипертонии), с гипергликемией (при сахарном диабете). Все эти факторы приводят к повреждению эндотелия сосудов, к дисфункции эндотелия, как эндокринного органа и к ускоренному развитию ангиопатий и атеросклероза. Перечень функций эндотелия и их нарушений перечислены в таблице 1.
Функциональная перестройка эндотелия при воздействии патологических факторов проходит несколько стадий:
I стадия – повышенная синтетическая активность клеток эндотелия, эндотелий работает как “биосинтетическая машина”.
II стадия – нарушение сбалансированной секреции факторов, регулирующих тонус сосудов, систему гемостаза, процессы межклеточного взаимодействия. На этой стадии нарушается естественная барьерная функция эндотелия, повышается его проницаемость для различных компонентов плазмы.
III стадия – истощение эндотелия, сопровождающееся гибелью клеток и замедленными процессами регенерации эндотелия.
Из всех факторов, синтезируемых эндотелием, роль “модератора” основных функций эндотелия принадлежит эндотелиальному фактору релаксации или оксиду азота (NO). Именно это соединение регулирует активность и последовательность “запуска” всех остальных биологически-активных веществ, продуцируемых эндотелием. Оксид азота не только вызывает расширение сосудов, но и блокирует пролиферацию гладкомышечных клеток, препятствует адгезии клеток крови и обладает антиагрегантными свойствами. Таким образом, оксид азота является базовым фактором антиатерогенеза.
К сожалению, именно NO-продуцирующая функция эндотелия оказывается наиболее ранимой. Причина тому – высокая нестабильность молекулы NO, являющейся по природе своей свободным радикалом. В результате благоприятное антиатерогенное действие NO нивелируется и уступает место токсическому атерогенному действию других факторов поврежденного эндотелия.
В настоящее время существуют две точки зрения на причину эндотелиопатии при метаболическом синдроме. Сторонники первой гипотезы утверждают, что дисфункция эндотелия вторична по отношению к имеющейся ИР, т.е. является следствием тех факторов, которые характеризуют состояние ИР – гипергликемии, артериальной гипертонии, дислипидемии. При гипергликемии в эндотелиальных клетках активируется фермент протеинкиназа-С, который увеличивает проницаемость сосудистых клеток для белков и нарушает эндотелий-зависимую релаксацию сосудов. Кроме того, гипергликемия активирует процессы перекисного окисления, продукты которого угнетают сосудорасширяющую функцию эндотелия. При артериальной гипертонии повышенное механическое давление на стенки сосудов приводит к нарушению архитектоники эндотелиальных клеток, повышению их проницаемости для альбумина, усилению секреции сосудосуживающего эндотелина-1, ремоделированию стенок сосудов. Дислипидемия повышает экспрессию адгезивных молекул на поверхности эндотелиальных клеток, что дает начало формированию атеромы. Таким образом, все перечисленные состояния, повышая проницаемость эндотелия, экспрессию адгезивных молекул, снижая эндотелий-зависимую релаксацию сосудов, способствуют прогрессированию атерогенеза.
Сторонники другой гипотезы считают, что дисфункция эндотелия является не следствием, а причиной развития ИР и связанных с ней состояний (гипергликемии, гипертонии, дислипидемии). Действительно, для того чтобы соединиться со своими рецепторами, инсулин должен пересечь эндотелий и попасть в межклеточное пространство. В случае первичного дефекта эндотелиальных клеток трансэндотелиальный транспорт инсулина нарушается. Следовательно, может развиться состояние ИР. В таком случае ИР будет вторичной по отношению к эндотелиопатии (рис. 1).
Рис. 1. Возможная роль дисфункции эндотелия в развитии синдрома инсулинорезистентности
Для того, чтобы доказать эту точку зрения, необходимо исследовать состояние эндотелия до появления симптомов ИР, т.е. у лиц с высоким риском развития метаболического синдрома. Предположительно, к группе высокого риска формирования синдрома ИР относятся дети, родившиеся с низким весом (менее 2,5 кг). Именно у таких детей впоследствии в зрелом возрасте появляются все признаки метаболического синдрома. Связывают это с недостаточной внутриутробной капилляризацией развивающихся тканей и органов, включая поджелудочную железу, почки, скелетную мускулатуру. При обследовании детей в возрасте 9–11 лет , родившихся с низким весом, было обнаружено достоверное снижение эндотелий-зависимой релаксации сосудов и низкий уровень антиатерогенной фракции липопротеидов высокой плотности, несмотря на отсутствие у них других признаков ИР. Это исследование позволяет предположить, что, действительно, эндотелиопатия первична по отношению к ИР.
До настоящего времени не получено достаточных данных в пользу первичной или вторичной роли эндотелиопатии в генезе ИР. В то же время неоспоримым является факт, что эндотелиальная дисфункция является первым звеном в развитии атеросклероза, связанного с синдромом ИР. Поэтому поиск терапевтических возможностей восстановления нарушенной функции эндотелия остается наиболее перспективным в предупреждении и лечении атеросклероза. Все состояния, входящие в понятие метаболического синдрома (гипергликемия, артериальная гипертония, гиперхолестеринемия) усугубляют дисфункцию эндотелиальных клеток. Поэтому устранение (или коррекция) этих факторов безусловно будет способствовать улучшению функции эндотелия. Перспективными препаратами, позволяющими улучшить функцию эндотелия, остаются антиоксиданты, устраняющие повреждающее воздействие окислительного стресса на клетки сосудов, а также лекарства, повышающие продукцию эндогенного оксида азота (NO), например, L-аргинин.
В таблице 2 перечислены препараты, у которых доказано антиатерогенное действие посредством улучшения функции эндотелия. К ним относятся: статины (симвастатин), ингибиторы ангиотензинпревращающего фермента (в частности, эналаприл), антиоксиданты, L-аргинин, эстрогены.
Экспериментальные и клинические исследования по выявлению первичного звена в развитии ИР продолжаются. Одновременно идет поиск препаратов, способных нормализовать и сбалансировать функции эндотелия при различных проявлениях синдрома инсулинорезистентности. В настоящее время стало совершенно очевидно, что тот или иной препарат только в том случае сможет оказать антиатерогенное воздействие и предупредить развитие сердечно-сосудистых заболеваний, если он прямо или опосредованно восстанавливает нормальную функцию эндотелиальных клеток.
Симвастатин –
Зокор (торговое название)
(Merck Sharp & Dohme Idea)
Эналаприл –
Веро-эналаприл (торговое название)
Источник
Введение
Если вы в последнее время читали о сердечно-сосудистых заболеваниях или недавно разговаривали с врачом о профилактике или лечении сердечно-сосудистых заболеваний, возможно, вы встречали термин «эндотелиальная дисфункция». Концепция эндотелиальной дисфункции стала важной в последние годы для нашего понимания многих сердечно-сосудистых заболеваний, включая ишемическую болезнь сердца (ИБС), артериальную гипертензию, микрососудистую стенокардию (кардиальный синдром Х), диастолическую дисфункцию и другие.
Эндотелиальная дисфункция — это состояние, при котором эндотелиальный слой (внутренняя оболочка) малых артерий не может нормально выполнять все свои важные функции. В результате с тканями, которые снабжаются этими артериями, может случиться несколько неприятных процессов.
Функция эндотелиального слоя
В артериолах организма (небольших артериях, которые точно регулируют поток крови к тканям) эндотелиальный слой (или эндотелий) является внутренней оболочкой клеток, которая выполняет несколько критических функций.
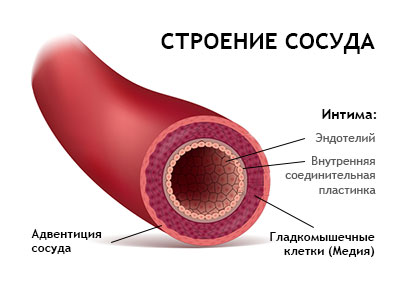
Эндотелий поддерживает правильное расширение и сужение кровеносных сосудов. Эта функция мгновенно определяет, сколько крови поступает в различные ткани организма. Эндотелиальный «тонус» (баланс между дилатацией и сужением) также в значительной степени определяет кровяное давление человека и то, сколько работы сердце должно проделать, чтобы выкачать кровь в организм.
Кроме того, эндотелий также защищает ткани от различных токсических веществ; регулирует механизм свертывания крови; контролирует жидкость, электролиты и многочисленные другие вещества, которые проходят между кровью и тканями; и регулирует воспаление в тканях.
Все это означает, что правильное функционирование эндотелия имеет решающее значение для нормального функционирования тканей и органов организма.
Когда эндотелиальный слой не выполняет все эти функции адекватно — иными словами, при наличии эндотелиальной дисфункции — условие будет благоприятствовать развитию атеросклероза, гипертонии (артериальной гипертензии) и другим сердечно-сосудистым заболеваниям.
Причины эндотелиальной дисфункции
Поскольку эндотелий так важен для многих жизненно важных функций, проводится много исследований, чтобы понять все причины эндотелиальной дисфункции. В этот момент очевидно, что эндотелиальная дисфункция связана со снижением уровня оксида азота (NO) в стенках кровеносных сосудов.
Оксиды азота представляют собой газ, который образуется в результате метаболизма аминокислоты (L-аргинин). Оксиды азота, имеющие очень короткий период полураспада, действуют локально в кровеносных сосудах, помогая модулировать тонус сосудов и другие важные эндотелиальные функции.
Дефицит продукции NO приводит к избыточному сужению кровеносных сосудов (которое может вызвать артериальную гипертензию), способствует активации тромбоцитов (приводит к свертыванию крови), увеличивает стимуляцию воспаления в стенках кровеносных сосудов (что способствует атеросклерозу) и увеличивает проницаемость стенок сосудов для повреждения липопротеинов и различных токсинов.
Подводя итог, можно сказать, что эндотелиальная дисфункция характеризуется снижением уровня оксида азота (NO) в сосудах, что, в свою очередь, приводит к нескольким нарушениям функции кровеносных сосудов. Эти функциональные нарушения способствуют развитию сердечно-сосудистых патологий.
Кроме того, эндотелиальная дисфункция может непосредственно вызывать аномальное сужение мелких артерий, и считается, что она является основным фактором, вызывающим кардиальный синдром Х и, возможно, диастолическую дисфункцию.
Нарушения и расстройства, сопутствующие эндотелиальной дисфункции

Точные причины, по которым у человека развивается эндотелиальная дисфункция, все еще изучаются. Тем не менее, очевидно, что этому способствуют многочисленные медицинские расстройства, привычки и неизбежные жизненные события, в том числе:
- повышенное кровяное давление (артериальная гипертензия);
- сахарный диабет;
- повышенные уровни холестерина и триглицеридов ЛПНП;
- курение;
- сидячий образ жизни;
- эмоциональный стресс (считается, что стрессовая кардиомиопатия, также известная как «синдром разбитого сердца» или кардиомиопатия Такоцубо, возникает в результате острой и тяжелой формы эндотелиальной дисфункции);
- инфекционные заболевания;
- сердечная недостаточность;
- гипотиреоз;
- остеопороз;
- естественное старение;
- химиотерапия и лучевая терапия;
- генетические влияния.
Диагностика
Делать формальный диагноз эндотелиальной дисфункции обычно нет необходимости. Некоторая степень дисфункции эндотелия может быть с уверенностью диагностирована у всех, кто имеет ишемическую болезнь сердца, гипертонию или основные факторы риска сердечно-сосудистых заболеваний (особенно перечисленные выше).
Таким образом, обследование эндотелиальной функции пациента — это не то, чем обычно занимаются врачи. Но если эндотелиальная дисфункция заподозрена у человека без четких причин (например, у человека, предположительно, имеющего кардиальный синдром X), диагноз может быть подтвержден различными диагностическими тестами, которые измеряют способность кровеносных сосудов расширяться (во время катетеризации или с помощью ультразвукового исследования) в ответ на введение ацетилхолина.
Лечение эндотелиальной дисфункции
Функционирование эндотелия может быть улучшено с помощью мер, направленных на снижение риска сердечно-сосудистых заболеваний, включая потерю веса, физические упражнения, прекращение курения, контроль гипертонии и диабета, которые всем нам обычно настоятельно рекомендуются.
Некоторые из этих мер контроля рисков были хорошо зарекомендованы для снижения эндотелиальной дисфункции. К ним относятся:
- применение статинов (фармацевтические препараты, направленные на борьбу с высокими уровнями холестерина в крови человека);
- средиземноморская диета;
- другие пищевые продукты, включая орехи, оливковое масло, темный шоколад, зеленый чай, растительные продукты;
- аэробные упражнения;
- потеря лишнего веса;
- применение ингибиторов АПФ (группа природных и синтетических химических соединений, применяющихся для терапии и профилактики сердечной и почечной недостаточности, для снижения артериального давления).
Кроме того, в настоящее время изучается несколько лекарственных препаратов, специально предназначенных для клинического улучшения эндотелиальной дисфункции. К перспективным агентам относятся нифедипин, эстроген, рунолазин, аспирин, L-аргенин и сильденафил.
Заключение
В последние годы медицинские исследования установили, что эндотелиальная дисфункция является важным фактором, способствующим возникновению многих видов сердечно-сосудистых расстройств. В то время как ведутся активные исследования по поиску путей улучшения лечения эндотелиальной функции и, следовательно, снижения риска сердечно-сосудистых заболеваний, мы уже многое можем сделать сами для решения этой проблемы. В частности, следует уделять большое внимание физическим упражнениям, бросать курить и при наличии таких заболеваний, как гипертония или диабет, работать с докторами.
Источник
Current Urology Reports 2005; 6:470-475 Metabolic syndrome, endothelial dysfunction, and erectile dysfunction: association and management Burnett AL. Резюме
В последнее время появляется всё большее количество данных, подтверждающих существование связи между метаболическим синдромом, включающим нарушение толерантности к глюкозе, ожирение, гипертензию и дислипидемию, и эректильной дисфункцией. Объединяющим эти заболевания механизмом может являться эндотелиальная дисфункция, так как последняя способна поражать различные составляющие сосудистой системы полового члена. Наиболее важным следствием существования связи между метаболическим синдромом и эректильной дисфункцией является то, что больные, обращающиеся по поводу эректильной дисфункции, могут быть подвергнуты более тщательному обследованию, которое позволит устранить существующие факторы сердечно-сосудистого риска и, как следствие, улучшить состояние здоровья населения в целом.
Введение
Эректильная дисфункция (ЭД), определяемая как постоянная неспособность достигать и/или поддерживать эрекцию, достаточную для осуществления полового акта, часто сопровождается другими серьёзными заболеваниями. Многочисленные исследования, проведённые в последние годы, подтвердили существование связи между ЭД и сосудистыми заболеваниями, неврологическими, гормональными и психологическими нарушениями, а также факторами образа жизни, такими как ожирение, малоподвижный образ жизни и курение (1,2). Среди них основное место занимают сердечно-сосудистые заболевания, в том числе сахарный диабет, артериальная гипертензия, дислипидемия и атеросклероз периферических сосудов. Это неудивительно, учитывая важность состояния сосудов для осуществления нормальной эрекции. Известные в настоящее время патофизиологические механизмы поражения сосудов могут также иметь место на уровне сосудов полового члена. Одним из подобных механизмов является поражение эндотелия, ведущее к развитию атеросклероза. Подобные процессы могут иметь место и в эндотелии полового члена, что стало причиной появления известной концепции ЭД=ЭД (эректильная дисфункция соответствует эндотелиальной дисфункции).
В последнее время особый интерес привлекают вопросы связи между ЭД и метаболическим синдромом, метаболическим нарушением, связанным с ожирением и являющимся важным фактором риска развития сахарного диабета 2 типа и сердечно-сосудистой патологии. Гипотеза о существовании связи между метаболическим синдромом и ЭД кажется вполне обоснованной. Логично также распространить данные, полученные в экспериментальных исследованиях механизмов поражения сосудов полового члена, а также рекомендации по ведению пациентов с ЭД и сердечно-сосудистыми заболеваниями или сахарным диабетом, на пациентов с метаболическим синдромом. Настоящий обзор нацелен на изучение существующих данных о связи между ЭД и метаболическим синдромом. Особое внимание уделено эпидемиологическим и фундаментальным данным, обсуждаются также вопросы лечения ЭД у больных метаболическим синдромом.
Метаболический синдром
Концепция метаболического синдрома не нова и известна в течение более чем 80 лет (3). Впервые данное заболевание упомянуто Kylin, шведским терапевтом, который в 1920 году описал сочетание метаболических нарушений, включающее гипертензию, гипегликемию и подагру (4). Примерно через 30 лет появились данные, что эти обменные нарушения сочетаются с абдоминальным ожирением и повышают риск развития сахарного диабета 2 типа и сердечно-сосудистых заболеваний. Другими названиями метаболического синдрома являются синдром Х, синдром инсулинрезистентности и смертельный квартет. В настоящее время основными компонентами данной патологии считают заболевания, связанные с нарушением толерантности к глюкозе (сахарный диабет 2 типа, нарушение толерантности к глюкозе или повышение уровня глюкозы натощак), инсулин резистентность, центральное ожирение, дислипидемию и гипертензию. Сочетание перечисленных заболеваний, каждое из которых является самостоятельным сосудистым фактором риска, приводит к значительному повышению риска развития сердечно-сосудистых заболеваний (5,6).
Несмотря на важность, данный синдром не имел общепризнанного определения. В 1998 ВОЗ стала инициатором создания критериев диагностики (7). В дальнейшем свои критерии были созданы National Cholesterol Education Program’s Adult Treatment Panel и European Group for the Study of Insulin Resistance (8,9). Также разными экспертами обсуждались такие вопросы как определение ожирения в разных популяциях. В настоящее время ожидается формирование окончательного определения, которое будет применимо во всех странах мира. Тем не менее, можно утверждать что центральными компонентами синдрома являются нарушение толерантности к глюкозе, ожирение, гипертензия и дислипидемия.
Параллельно с ростом частоты ожирения и диабета в последние два десятилетия возросла заболеваемость и метаболическим синдромом. В то же время, точно определить распространённость данного заболевания сложно. Основным препятствием является отсутствие общепризнанного определения. Кроме того в нескольких работах показано, что на частоту метаболического синдрома влияют возраст, этническая принадлежность, пол, степень ожирения и национальность обследованных. Особенно важным фактором является возраст. По данным National Health and Nutrition Examination Survey частота метаболического синдрома возросла с 7% среди людей в возрасте от 20 до 29 лет до 44% и 42% в возрастных группах от 60 до 69 и старше 70 лет, соответственно (10). Средняя частота составила 23.7%, наиболее высокой частота оказалась среди американцев мексиканского происхождения (31.9%) (10). Среди обследованных в исследовании Cardiovascular Health Study, которое включало мужчин и женщин в возрасте старше 65 лет, частота метаболического синдрома составила от 21% до 28% (11).
В последние годы особое внимание уделяется прогностическому значению метаболического синдрома. По данным обобщённого прогноза исследований, выполненных в период с 1998 по 2004 годы, метаболический синдром повышает риск общей смертности в 1.2-1.4 раза, сердечно-сосудистых заболеваний в 1.7-1.9 раза и диабета в 3.0-6.1 раза (12). Схожие результаты получены в исследовании Cardiovascular Health Study, в котором повышение риска развития инфаркта и инсульта составило 1.38 (11).
Эректильная дисфункция и риск развития сердечно-сосудистых заболеваний
В многочисленных исследованиях, проведённых в последние годы, было показано повышение риска развития ЭД у больных ИБС, сахарным диабетом, гипертензией, дислипидемией и курящих. В исследовании, включавшем 300 пациентов с поражением коронарных артерий и стенокардией, частота ЭД составила 49% (13). В недавнем крупном исследовании, включавшем более 25000 мужчин наличие ЭД сопровождалось двукратным увеличением риска инфаркта миокарда, при этом у мужчин в возрасте старше 40 лет отмечено повышение риска было в 3-4 раза выше, чем у более молодых (в возрасте 30-39 лет) (14). Среди 104 мужчин в возрасте от 34 до 75 лет с артериальной гипертензией у 68.3% имела места ЭД, при этом у 45.2% тяжёлая (15). Частота ЭД у больных сахарным диабетом в 4 раза выше по сравнению с мужчинами с нормальным обменом глюкозы (16,17), при этом риск повышен у пожилых, страдающих диабетом длительное время, с плохим контролем уровня глюкозы и наличием осложнений диабета, таких как периферическая нейропатия (18,19). Курение также повышает риск развития ЭД в два раза (20,21).
Помимо эпидемиологической связи с сердечно-сосудистой патологией, ЭД также является ранним признаком атеросклероза. В одном из исследований, в котором были обследованы 178 мужчин ЭД, у 46 (71%) из 65 обследованных, у которых имела место дислипидемия, данное нарушение было выявлено впервые, у 6 (14%) из 42 диагноз сахарного диабета был установлен впервые, а у 11 (31%) из 35 мужчин была впервые выявлена артериальная гипертензия (22). Другим подтверждением роли ЭД в качестве раннего признака возможности развития сердечно-сосудистых заболеваний являются данные о наличии ЭД у 57% больных, которым было выполнено аорто-коронарное шунтирование и у 64% госпитализированных с инфарктом миокарда (23). По данным Montorsi и соавт. (13) среднее время между возникновением ЭД и появлением симптомов ИБС составляет 38.8 месяцев (от 1 до 168). Схожая картина имеет место в случае диабета – в одном из исследований у всех пациентов с сахарным диабетом 1 типа имела место ЭД до возникновения симптомов ИБС (13). В другой работе, в которой были обследованы 133 мужчины с сахарным диабетом 2 типа и подтверждённой бессимптомной ИБС и 127 мужчин с сахарным диабетом, не имевших сердечно-сосудистой патологии, отмечена выраженная корреляция между ЭД и наличием ИБС (24).
Эректильная дисфункция и метаболический синдром
В нескольких исследованиях, проведённых в последнее время, исследована взаимосвязь между ЭД и метаболическим синдромом. Так в работе, в которой сравнивали 100 мужчин с метаболическим синдромом с контрольной группой, сходной по возрасту и индексу массы тела, среди обследованных с метаболическим синдромом частота ЭД составила 26.7% по сравнению с 13% в контрольной группе, также у больных отмечено повышение уровня С-реактивного белка, являющегося маркёром сосудистого воспаления, почти в 3 раза (25). Более того, исследователи показали повышение частоты ЭД в соответствии с увеличением числа компонентов метаболического синдрома. В другом исследовании, среди 79 мужчин с ИБС и нарушением обмена липидов, у 38 пациентов, соответствовавших критериям метаболического синдрома, имела место ЭД (26). Исследователи показали, что среди факторов риска ЭД, таких как артериальная гипертензия, дислипидемия и курение, метаболический синдром в наибольшей степени коррелировал с наличием ЭД (26).
Интересные результаты получены при анализе данных Massachusets Male Aging Study – ЭД развивалась параллельно с компонентами метаболического синдрома (27). Среди 882 мужчин, не имевших метаболического синдрома на момент начала исследования у 29.6% данное заболевание развилось по данным повторных осмотров через 8 и 15 лет, при этом вероятность развития метаболического синдрома у больных ЭД была повышена в 1.74 раза (27). В другой работе среди 268 мужчин, набранных из урологического и эндокринологического отделения у 66 (74%) из 89 мужчин с метаболическим синдромом имела место ЭД, в то время как у мужчин без метаболического синдрома этот показатель составил 50% (28). Коэффициент вариации для наличия ЭД у больных метаболическим синдромом составил 2.9 (28).
Результаты этих клинических исследований показывают, что ЭД и метаболический синдром связаны так же как и ЭД и сердечно-сосудистые заболевания. Эти исследования являются предварительными и нуждаются в подтверждении. То, что ЭД может указывать на высокую вероятность развития метаболического синдрома, также должен быть подтверждён дальнейшими работами.
Биологические аспекты
Выяснение биологических механизмов является необходимым компонентом понимания связи между ЭД и метаболическим синдромом. Предполагается, что поражение сосудистой системы полового члена является основным патофизиологическим механизмом развития ЭД при метаболическом синдроме. Продолжая эту мысль, можно предполагать, что эндотелиальная дисфункция является общим для этих двух заболеваний нарушением. В действительности, таким же образом в настоящее время объясняют связь между ЭД и сердечно-сосудистыми заболеваниями (29-31). В соответствии с этой гипотезой, различные факторы, такие как сахарный диабет, артериальная гипертензия, дислипидемия и курение приводят к дисфункции эндотелия. Механизмом этого повреждения является окислительный стресс, повреждающий эндотелий сосудов и синусов полового члена, аналогично повреждению других сосудов, что приводит к вазоконстрикции, атеросклерозу, воспалению и тромбозу (32-34).
Насколько вообще уместна теория «эндотелиальной дисфункции» сосудов полового члена и насколько она применима к метаболическому синдрому? Учёные находят всё больше подтверждений того, что снижение биодоступности оксида азота (NO), основного вазодилататора и по-видимому вообще основного регулирующего агента в половом члене (35), может быть основным нарушением, лежащим в основе снижения реакции эректильной ткани при сосудистых нарушениях, к числу возможных механизмов относят снижение синтеза или усиление разрушения данного медиатора. В первом случае источник синтеза NO может быть просто утерян при повреждении эндотелиальных клеток, кроме этого также могут иметь значение особые патологические механизмы, приводящие к инактивации фермента эндотелиальная NO-синтетаза (эNOC) (36). К примеру, в недавних исследованиях показано нарушение функции конститутивно активной формы эNOC, которая по последним данным играет основную роль в эрекции. Подобное явление отмечено у больных сахарным диабетом и пожилых (37,38). Кроме того, недостаток эндотелиального NO может быть усугублён повышением активности вазоконстрикторных механизмов, таких как RhoA/RhoA киназа, что имеет место у больных сахарным диабетом (39).
Снижение количества NO также имеет место в сосудистой ткани вследствие его инактивации супероксидным анионом, относящимся к группе свободных радикалов. Результатом этой реакции является пероксинитрит, высокотоксичное вещество, способное повреждать ДНК, белки и липиды, усиливать выделение вазоконстрикторов и апоптоз, и в итоге приводить к повреждению тканей (40). Среди источников супероксидного аниона эNOC также является основным ферментом, нарушение функции которого приводит к формированию супероксидного аниона и повышению активности радикалов. Предварительные данные подтверждают существование подобного механизма развития ЭД при дислипидемии, включая окисление липидов низкой плотности и нарушение связывания эNOC (Musicki и Burnett, неопубликованные данные). Также следует помнить, что окислительный стресс оказывает неблагоприятное действие непосредственно на гладкомышечные клетки сосудов и биохимические процессы в них, в том числе на систему RhoA/RhoA киназа, независимо от действия на эндотелиальную функцию (41).
Изложенные экспериментальные данные с высокой вероятностью указывают на важность роли эндотелиальной дисфункции и окислительного стресса в патогенезе ЭД при метаболическом синдроме. В то же время, следует отметить, что этиологические факторы развития метаболического синдрома точно не установлены. Многие специалисты считают инсулинрезистентность основным механизмом (42). Другими предполагаемыми механизмами являются хроническая активация имунной системы, нарушения функционирования гипоталамо-гипофизарно-надпочечниковой системы, нарушение функции глюкокортикоидных гормонов, хронический стресс и генетические механизмы (12). Также изучалось влияние цитокинов, гормонов и молекул, синтезируемых адипоцитами (43). Итоговым эффектом всех перечисленных воздействий является усиление окислительного стресса, что ведёт к повреждению разных сосудов, включая сосуды полового члена.
Учитывая то, что основным методом снижения частоты метаболического синдрома является его предотвращение (44), превентивные мероприятия также рассматриваются в качестве основных мер снижения частоты ЭД. Среди методов профилактики основное значение придаётся коррекции факторов образа жизни и снижение массы тела. Эпидемиологические исследования указывают на достаточно высокую эффективность применения коррекции патологических факторов, прежде всего увеличения физической активности и снижения массы тела, что способно приводить к сексуальной дисфункции (45,46,47). Лечение других компонентов, включая гипертензию и дислипидемию, может требовать специфической терапии. Кроме этого, основной целью лечения должно являться предотвращению любых нарушений, способных приводить к обострению хронического воспаления и повышению риска атеросклероза, кроме этого отказ от курения также может оказывать благоприятное действие.
Другие рекомендации по лечению ЭД у пациентов с метаболическим синдромом, могут быть позаимствованы из рекомендаций по ведению ЭД при других сопутствующих заболеваниях. Одним из подобных источников могут являться рекомендации второй Принстонской конференции, подтвердившей важность оценки степени сердечно-сосудистого риска у всех больных ЭД (48). Разработанный алгоритм оценки степени риска важным инструментом при обследовании всех больных. Определение риска проводится по результатам сбора анамнеза, общего осмотра и лабораторного обследования. Авторы рекомендаций признают, что в созданный алгоритм не были включены менее хорошо изученные факторы риска, включая ожирение, национальность, уровень маркёров воспаления, приём медикаментозных препаратов и наличие метаболического синдрома. В то же время, учитывая, что в соответствии с данными рекомендациями по мере увеличения количества факторов риска возрастает необходимость кардиологического обследования, можно предполагать, что при метаболическом синдроме следует придерживаться аналогичной тактики. После подтверждения безопасности сексуальной активности или стабилизации течения сопутствующей патологии можно возобновить сексуальную активность. В подобной ситуации можно проводить стандартное лечение ЭД (49).
Заключение
Данные, указывающие на важность роли сопутствующих заболеваний в генезе ЭД, подтверждают возможность существования связи между метаболическим синдромом и сексуальной дисфункцией. Метаболический синдром, даже несмотря на отсутствие общепризнанного его определения, может рассматриваться в качестве важного фактора риска ЭД. С другой стороны ЭД может рассматриваться в качестве раннего предшественника метаболического синдрома. Тем не менее, необходимы исследования существования и характера связи между этими двумя заболеваниями. Можно предполагать, что будет доказано то, что ЭД является ранним признаком метаболического синдрома, по мере накопления данных об аналогичном значении ЭД при сердечно-сосудистых заболеваниях. Существующие данные по данному вопросу в отношении метаболического синдрома весьма интересны, но нуждаются в подтверждении.
Кроме этого, важны также данные научных исследований, по изучению механизмов связи между ЭД и метаболическим синдромом. Ожидается, что дальнейшие научные исследования позволят выяснить патофизиологические механизмы развития метаболического синдрома, что в свою очередь позволит лучше понять механизмы развития ЭД у данной категории больных. Весьма вероятно, что эндотелиальная дисфункция, связанная с окислительным стрессом, является общим механизмом развития метаболического синдрома и ЭД. Тем не менее, необходимы дополнительные исследования молекулярных процессов, происходящих при метаболическом синдроме и поражающих сосуды полового члена, приводя к ЭД. Подобные знания могут выявить возможные молекулярные цели для воздействия, которое позволит снизить частоту осложнений метаболического синдрома и также ЭД, связанной с ним.
Профилактика является ключевым методом борьбы с метаболическим синдромом. Учитывая, что ЭД может являться ранним проявлением атеросклероза, у больных с ЭД также возможно раннее выявление и лечение метаболического синдрома. Первые исследования показывают, что устранение факторов риска у людей, склонных к развитию метаболического синдрома, также позволяет снизить частоту и тяжесть ЭД, а также сердечно-сосудистых осложнений и последствий сахарного диабета. После исследования и коррекции сердечно-сосудистого риска можно проводить стандартное лечение ЭД. Всё изложенное выше указывает, что понимание связи между ЭД и метаболическим синдромом позволит повысить качество лечения данной группы пациентов.
Читайте также другие научные публикации: “Мужская стерилизация – вазэктомия”
Источник
