Код мкб 10 хвдп


Хроническая воспалительная демиелинизирующая полиневропатия (ХВДП) — это приобретённое поражение периферической нервной системы аутоиммунного характера. В классическом варианте проявляется типичной клиникой симметричной сенсомоторной полиневропатии с медленным монотонным или ступенчатым прогрессом. Диагностируется ХВДП по клиническим данным, ЭНМГ критериям, результатам МРТ позвоночника или УЗИ нервных стволов. Лечение проводится длительно с применением глюкокортикостероидов, сеансов плазмафереза и внутривенной иммунотерапии. В большинстве случаев ХВДП прогноз благоприятный.
Общие сведения
Хроническая воспалительная демиелинизирующая полиневропатия (ХВДП) окончательно получила своё название в 1982 г. До этого в отношении неё применялись различные термины. Из-за сходства симптоматики клиницисты долгое время считали ХВДП хронической формой синдрома Гийена-Барре. В конце XX века специалистами в области клинической неврологии были выделены чёткие нейрофизиологические признаки и разработаны диагностические критерии ХВДП.
Заболевание встречается преимущественно во взрослом возрасте. Частота у детей — 0,5 случаев на 100 тыс. человек, у взрослых — 1-2 случая на 100 тыс. Лица мужского пола заболевают чаще. Пик заболеваемости ХВДП приходится на возраст 40-50 лет. Причём у лиц старше 50 лет наблюдается более тяжёлое течение и меньший ответ на терапию. ХВДП зачастую сочетается с другими заболеваниями: ВИЧ-инфекцией, саркоидозом, ревматоидным артритом, СКВ, амилоидозом, хроническим гломерулонефритом, сахарным диабетом, опухолевыми поражениями. Наряду с другими симптомами ХВДП может составлять клинику паранеопластического синдрома.
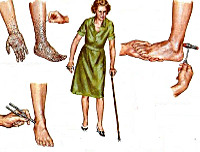
Хроническая воспалительная демиелинизирующая полиневропатия
Причины ХВДП
ХВДП относится к воспалительным полиневропатиям. Основу патологического процесса составляет воспаление периферических нервных стволов. Его аутоиммунный характер не вызывает сомнений, однако этиопатогенез пока достаточно не изучен. У пациентов с ХВДП часто обнаруживаются гены HLA, в 70% выявляются антитела к р-тубулину.
В отличие от синдрома Гийена-Барре, в большинстве случаев ХВДП не прослеживается связь дебюта с каким-либо предшествующим заболеванием или состоянием (ОРВИ, вакцинацией, перенесённой операцией и т. п.). Возможно такая связь существует, но из-за скрытого медленного начала ХВДП её сложно проследить.
Патогенез
Аутоиммунное воспаление приводит к разрушению миелиновой оболочки нерва. Демиелинизация при ХВДП носит рассеянный характер: поражаются отдельные участки нерва; процесс распространяется то по поперечнику, то по длиннику нервного ствола; изменения могут затрагивать то сенсорные, то двигательные волокна. Это обуславливает большой полиморфизм клинических проявлений и определённые трудности в диагностике ХВДП.
Классификация
В связи с полиморфизмом симптоматики выделяют типичную (классическую) форму и атипичные варианты ХВДП.
- Классическая форма ХВДП подразумевает симметричную мышечную слабость как дистальных, так и проксимальных отделов всех 4 конечностей, сочетающуюся с сенсорными нарушениями и нарастающую в период более 2-х мес. Имеет монотонное или ступенчатое медленно прогрессирующее течение, на фоне которого возможны отдельные обострения.
- К атипичным формам ХВДП относятся:
- дистальная с преимущественным поражением кистей, стоп, предплечий и голеней;
- асимметричная с асимметричным вовлечением конечностей;
- фокальная — изолированное поражение одного или нескольких нервов, плечевого или пояснично-крестцового сплетения;
- изолированная двигательная — поражение только моторных волокон;
- изолированная чувствительная — поражение только сенсорных волокон.
Около 70-75% случаев ХВДП составляют варианты с монофазным и хроническим течением. В первом случае симптоматика медленно прогрессирует до максимума, а затем наблюдается её полный или частичный регресс без последующего рецидивирования.
Хроническое прогрессирующее течение ХВДП характеризуется непрерывным плавным или ступенчатым усугублением симптомов. У 25-30% пациентов отмечается рецидивирующее-ремитирующее течение с чётко выделяющимися периодами обострения.
Отдельно выделяют вариант ХВДП с острым дебютом, который зачастую диагностируют как синдром Гийена-Барре (острую воспалительную демиелинизирующую полиневропатию). Однако его последующее хроническое прогрессирующее течение позволяет окончательно выставить диагноз ХВДП.
Симптомы ХВДП
Базис клинической картины ХВДП составляет сенсомоторная полиневропатия. Она развивается исподволь, зачастую пациенты не могут даже примерно указать начало заболевания. Первое обращение к врачу обычно продиктовано слабостью в конечностях, которая затрудняет ходьбу по лестнице, подъём на подножку в городском транспорте, мелкую работу пальцами рук и т. п. Пациенты отмечают шаткость и онемение конечностей. Обычно при ХВДП мышечная слабость симметрична и прогрессирует по восходящему типу. В большинстве случаев её медленное нарастание занимает более 2-х месяцев. Однако у 16-20% пациентов с ХВДП отмечается более острое начало с развитием слабости в период до месяца.
Двигательные нарушения прогрессируют и захватывают проксимальные отделы конечностей. Сопровождаются снижением и выпадением рефлексов, наиболее часто – ахиллового. Мышечные атрофии развиваются не сразу, а лишь при длительном течении ХВДП без лечения. Сенсорные расстройства отмечаются в 85% случаев ХВДП. Они превалируют над двигательными лишь у 10% заболевших. Как правило, отмечаются онемения стоп и кистей. В ряде случаев ХВДП из-за поражения глубоких видов чувствительности развивается сенситивная атаксия. У отдельных пациентов наблюдается болевой синдром.
Нередко при ХВДП наблюдается постуральный тремор кистей — дрожание при удержании рук в определённой позе. Возможно поражение черепно-мозговых нервов: глазодвигательного, лицевого, тройничного. Бульбарный паралич при ХВДП развивается редко. Вовлечение дыхательной мускулатуры с развитием дыхательной недостаточности наблюдается лишь в отдельных случаях. Вегетативные расстройства для ХВДП не характерны.
Диагностика ХВДП
Пациенты с симптомами полиневропатии проходят обследование у врача-невролога. В неврологическом статусе у них выявляется мышечная слабость дистальных отделов конечностей, снижение чувствительности (гипестезия) по типу «чулок и перчаток», выпадение сухожильных рефлексов. При атипичных формах ХВДП изменения могут носить асимметричный характер или выявляться только в зоне иннервации отдельных нервов или сплетений. Диагностика типа полиневропатии осуществляется при помощи электронейромиографии (ЭНМГ), магнитно-резонансной томографии и исследования цереброспинальной жидкости.
- ЭНМГ. Проводится нейрофизиологом и в большинстве случаев диагностирует типичные для демиелинизации периферических нервов изменения. В дальнейшем на стимуляционной ЭМГ могут обнаруживаться признаки аксонального поражения. Первоначальное ЭНМГ-исследование должно включать не менее 4 нервов.
- Люмбальная пункция с анализом ликвора. При ХВДП сейчас проводится все реже и реже. В классическом варианте она позволяет исключить инфекционное поражение ЦНС. Для ХВДП типичен высокий уровень белка (> 1 г/л) в цереброспинальной жидкости при отсутствии цитоза (повышенного содержания клеточных элементов). Наличие цитоза указывает, прежде всего, на вероятность ВИЧ или болезнь Лайма.
- МРТ позвоночника. У пациентов с ХВДП выявляет усиление МР-сигнала от спинальных корешков, ветвей поясничного или плечевого сплетения, которое свидетельствует об их утолщении. Почти у 50% пациентов при проведении МРТ головного мозга диагностируются церебральные очаги демиелинизации.
- Сонография. В настоящее время в диагностике полинейропатий все активнее используется УЗИ нерва. Этот метод намного проще и дешевле МРТ. Также позволяет выявить утолщение нервного ствола и может применяться в дифференциальной диагностике ХВДП с мультифокальной моторной нейропатией.
Поскольку в 10-20% ХВДП является вторичной, сопутствующей системному заболеванию, необходимо тщательно обследовать пациентов для исключения такого варианта. В некоторых случаях признаки основного заболевания появляются через несколько месяцев после возникновения ХВДП. Поэтому обследование пациентов необходимо повторить. Комплексное обследование включает анализ крови на глюкозу, белковый спектр, антинуклеарные антитела, печёночные пробы, онкомаркеры; диагностику ВИЧ и вирусных гепатитов, рентгенографию лёгких и пр.
Лечение ХВДП
На сегодняшний день терапия ХВДП имеет 3 составляющие: приём кортикостероидов, введение иммуноглобулина и плазмаферез. Кортикостероидная терапия обычно начинается с большой дозы преднизолона. При наличии эффекта дозу постепенно уменьшают и переходят на его приём через день. В период от 1 до 1,5 лет терапии у большинства пациентов с ХВДП наблюдается практически полный регресс симптоматики. Для предупреждения рецидивов кортикостероидную терапию продлевают ещё на несколько лет. У части пациентов даже через 2-3 года на фоне попыток отмены терапии возникают рецидивы ХВДП и тогда лечение необходимо продолжать.
Длительный приём кортикостероидов должен проходить под контролем АД, плотности костной ткани (денситометрия), сахара крови, холестерина, уровня калия и кальция. Обязательны сопутствующие курсы гастропротекторов, препаратов кальция. Альтернативой кортикостероидам при ХВДП выступают иммуносупрессоры. Они применяются в случаях малой эффективности стероидов, при их плохой переносимости или при невозможности снижения дозировки.
Снизить дозы и длительность глюкокортикоидной терапии у пациентов с ХВДП позволяет дополнительное применение плазмафереза и иммуноглобулина. Внутривенная терапия иммуноглобулином оказывается эффективна у 50% больных ХВДП. Однако её действие непродолжительно, поэтому курсы иммунотерапии необходимо постоянно повторять. Плазмаферез проводят с частотой 2 раза в неделю до клинического улучшения (примерно 1,5 мес). Затем сеансы постепенно урежают до 1 раза в месяц.
Прогноз
Адекватное лечение ХВДП позволяет добиться полного или почти полного регресса симптомов полиневропатии. Лишь у 10% пациентов отмечается сохранение или усугубление клиники. В 85% случаев спустя 5 лет от дебюта остаётся минимальный неврологический дефицит.
Важное прогностическое значение имеет продолжительность первичного нарастания симптомов ХВДП. Если она больше 3-х месяцев, то выздоровление может занять всего 1 год. Однако большинство заболевших ХВДП нуждается в длительном лечении и сталкивается с возвратом симптомов при его отмене.
Источник
Рубрика МКБ-10: G61.8
МКБ-10 / G00-G99 КЛАСС VI Болезни нервной системы / G60-G64 Полинейропатии и другие поражения периферической нервной системы / G61 Воспалительная полинейропатия
Определение и общие сведения[править]
Хроническая воспалительная демиелинизирующая полинейропатия
Синонимы: хроническая воспалительная демиелинизирующая полирадикулонейропатия
Хроническая воспалительная демиелинизирующая полинейропатия представляет собой монофазное, хроническое прогрессирующее или рецидивирующее симметричное сенсомоторное расстройство, характеризующееся прогрессирующей мышечной слабостью с нарушением чувствительности, отсутствием или снижением сухожильных рефлексов, а также повышением уровня белков в цереброспинальной жидкости.
Хроническая воспалительная демиелинизирующая полинейропатия по клинической картине сходна с синдромом Гийена-Барре и ранее рассматривалась как его хроническое проявление.
Распространенность хронической воспалительной демиелинизирующей полинейропатии составляет около 1 /200 000 детей и 1-7 / 100 000 взрослых, но принято считать, что распространеннось заболевания недооценена.
Этиология и патогенез[править]
Хроническая воспалительная демиелинизирующая полинейропатия может быть вызвана иммунной реакцией, приводящей к развитию сегментарной и мультифокальной демиелинизации, которая со временем может вызывать утрату аксонов .
Клинические проявления[править]
Начало хронической воспалительной демиелинизирующей полинейропатии может происходить в любом возрасте, но чаще встречается на 5-м и 6-м десятилетиях жизни. Основные клинические проявления включают прогрессирующую симметричную слабость как в проксимальных, так и в дистальных отделах мышцах нижних и/или верхних конечностей (с частичным или полным разрешением между рецидивами), сопровождаемую нарушением чувствительности и отсутствием/ослаблением сухожильных рефлексов. Течение заболевания является рецидивирующим в 30% случаев, хронический и прогрессирующим в 60%, а также монофазным с полным общим выздоравлением в 10% случаев. В 5-30% случаев может отмечаться дисфункция черепных нервов. Сообщалось о случаях нейропатической боли, вовлечения респираторной мускулатуры и субклиническом поражении ЦНС. Может наблюдаться поражение вегетативной нервной системы. У детей отмечается более быстрое начало болезни, более выраженная инвалидизация и более частое наблюдается рецидивирующее течение. Хроническая воспалительная демиелинизирующая полинейропатия может сопутствовать гепатиту C, воспалительным заболеванием кишечника, лимфоме, ВИЧ, трансплантации органов, меланоме или болезням соединительной ткани.
Другие воспалительные полиневропатии: Диагностика[править]
Для постановки диагноза хронической воспалительной демиелинизирующей полинейропатии пациенты должны продемонстрировать 2-месячный анамнез прогрессирующей демиелинизирующей нейропатии. Хроническая воспалительная демиелинизирующая полинейропатия может также проявляться более, чем через 8 недель после синдрома Гийена-Барре. Диагноз основан прежде всего на клинических и электрофизиологических данных: снижение скорости проведения импульса менее 70% нижней границы нормы не менее чем по 2 двигательным нервам; уровень белка в цереброспинальной жидкости более 0, 45 г/л, клеточный состав менее 10 клеток в 1 мм³; при биопсии икроножного нерва доказательства демиелинизации и/или ремиелинизации по данным электронной микроскопии или анализа расчёсанных нервных волокон.
Дифференциальный диагноз[править]
Дифференциальный диагноз хронической воспалительной демиелинизирующей полинейропатии включает хронические приобретенные полинейропатии (моноклональные гаммопатии, диабет, токсические невропатии) и наследственные нейропатии (болезнь Шарко-Мари-Тута или транстиуретиновая амилоидная нейропатия).
Другие воспалительные полиневропатии: Лечение[править]
Тактика лечения зависит от изначальной тяжести симптоматики, возраста, общего состояния пациента и противопоказаний к трем общепринятым методам лечения: кортикостероидной терапии, внутривенным иммуноглобулинам или плазмаферезу. Пациентам с исключительно моторными поражениями показаны внутривенные иммуноглобулины и не рекомендуется прием стероидов. При более мягких формах рекомендуется клиническое наблюдение и, возможно, кортикостероидная терапия (в зависимости от результатов электронейромиограммы). Плазмаферез или комбинацию кортикостероидов с иммуноглобулинами можно использовать, если ни один из методов лечения не является эффективным. В рефрактерых случаях можно использовать интенсивную иммуносупрессивную терапиб. Эффективность интерферона бета-1а и альфа, а также этанерцепта или ритуксимаба остаются неопределенными. Нейропатическая боль может купироваться противоэпилептическими препаратами или трициклическими антидепрессантами.
Прогноз
Долгосрочный прогноз обычно хороший. Пациенты могут демонстрировать остаточные симптомы, которые могут приводить к снижению качества жизни. Квадриплегия, дыхательная недостаточность и смерть наблюдались, но крайне редко.
Профилактика[править]
Прочее[править]
Мультифокальная моторная нейропатия
Синонимы: мультифокальная двигательная нейропатия с блоком проводимости
Мультифокальная моторная нейропатия является редкой приобретенной иммуноопосредованной нейропатией.
Характеризуется клинически изолированным моторным дефицитом с блоком проводимости и асимметричной мультифокальной гипотонией, фасцикуляциями и судорогами.
Распространенность 1-9 / 100 000, встречается у взрослых.
Источники (ссылки)[править]
https://www.orpha.net
Дополнительная литература (рекомендуемая)[править]
1. Levinson, A. I. The use of IVIG in neurological disease. Clin. Rev. Allergy 10(1—2):119, 1992.
2. Yu, R. K., et al. Autoimmune mechanisms in peripheral neuropathies. Ann. Neurol. 27(Suppl.):S30, 1990.
3. Pleasure, D. E., Lovelace, R. E., and Duvoisin, R. C. The prognosis of acute polyradiculoneuritis. Neurology (Minneapolis) 18:1143, 1968.
Действующие вещества[править]
Источник
Связанные заболевания и их лечение
Описания заболеваний
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Описание
- Симптомы
- Диагностика
- Дифференциальная диагностика
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Хроническая воспалительная демиелинизирующая полинейропатия.

Хроническая воспалительная демиелинизирующая полинейропатия
Описание
Хроническая воспалительная демиелинизирующая полинейропатия (ХВДП) является частым заболеванием, при котором нередко наблюдается гиподиагностика. Оно потенциально излечимо, средняя распространенность составляет около 0,5 случая/100 000 детей и 1–2 случая/100 000 взрослых. Клиническое сходство с острой воспалительной демиелинизирующей полинейропатией (синдромом Гийена-Барре) и положительный эффект иммуносуппрессоров наталкивает на мысль об иммунно-опосредованном патогенезе. Со времени первого описания случаев хронической полинейропатии с ответом на лечение стероидами, спектр клинической симптоматики и диагностические возможности значительно расширились, это же касается и лечения.
Симптомы
Классическая ХВДП характеризуется симметричной слабостью мышц проксимальных и дистальных отделов конечностей, прогрессирующей более 2 месяцев. Она также ассоциируется с чувствительными нарушениями, ослаблением или исчезновением сухожильных рефлексов, повышением содержания белка в спинномозговой жидкости (СМЖ), изменениями, типичными для демиелинизации при электрофизиологических исследованиях, и признаками демиелинизации по результатам биопсии. Ее течение может быть рецидивирующим или непрерывно прогрессирующим, причем последнее более характерно для молодых пациентов.
Поскольку диагностика указанного заболевания постепенно совершенствуется, его становится все проще распознавать, следовательно, различные клинические исследования также не обошли стороной данную патологию. Определение вышеупомянутого типа полинейропатии было предложено сразу несколькими экспертными группами. Все они обосновывают диагноз преимущественно клинической симптоматикой и результатами электрофизиологических исследований, тогда как в отношении необходимости анализа СМЖ или биопсии к единому мнению прийти не удалось, поскольку степень клинико-диагностической точности широко варьирует. Два последних метода исследования необходимы для постановки четкого диагноза согласно критериям Американской академии неврологии, однако это не согласуется с широко известными критериями Saperstein et al или рекомендациями Группы по изучению причин и лечению воспалительных нейропатий. Классическая ХВДП сопровождается, как правило, хорошим ответом на лечение кортикостероидами, что помогает в дифференциальной диагностике с другими формами приобретенных демиелинизирующих полинейропатий.
Приобретенная демиелинизирующая дистальная симметричная полинейропатия.
Предполагается, что данное заболевание является отдельной формой. К характерным его признакам относятся возрастающая заболеваемость среди мужчин и лиц старше 50 лет, сенсорный дефицит и легкая слабость преимущественно в дистальных отделах конечностей (в отличие от более генерализированного поражения при ХВДП) и неустойчивость походки. IgM-парапротеинемия наблюдается практически у 2/3 пациентов с подобным состоянием. Оно, по-видимому, слабо реагирует на иммуносупрессивную терапию.
Мультифокальная двигательная полинейропатия.
Очень важно отличать мультифокальную двигательную полинейропатию от болезней мотонейрона. Первая характеризуется наличием асимметричной слабости без чувствительного дефекта и начинается, как правило, с мышц дистальных отделов конечностей. Частичная блокада двигательной активности в различных зонах является характерным электрофизиологическим признаком, хотя и не у всех пациентов. Это же касается выявления циркулирующих антиганглиозидных антител. Содержание белка и количество клеток находится, как правило, в пределах нормы. Несмотря на то, что кортикостероиды и плазмаферез при мультифокальной моторной полинейропатии редко приносят эффект, течение болезни улучшается при использовании иммуноглобулинов или циклофосфамида.
Приобретенная демиелинизирующая мультифокальная мотосенсорная полинейропатия (синдром Люиса-Самнера).
Приобретенная демиелинизирующая мультифокальная мотосенсорная полинейропатия (синдром Люиса-Самнера) характеризуется рядом общих признаков как с ХВДП (мотосенсорный дефицит, повышенное содержание белка в СМЖ, патологические изменения при электрофизиологических исследованиях), так и с мультифокальной моторной полинейропатией (асимметричность симптомов с началом с верхних конечностей, блокада проводимости). У некоторых лиц с данным состоянием появляются антитела к ганглиозидам и они относительно хорошо реагируют на внутривенное введение иммуноглобулинов и циклофосфамида.
Другие полинейропатии, подобные ХВДП.
Многие другие варианты приобретенных и хронических полинейропатий, подобных ХВДП, разделяются на следующие подгруппы. Это аксональная, изолированная сенсорная, изолированная моторная и аксональная хроническая воспалительная демиелинизирующая полинейропатия. Каждая из них довольно редко упоминается в литературе. В основном, именно у пациентов с демиелинизацией периферических нервов при хорошей или хотя бы частичной реакции на иммунотерапию вероятность наличия хронической приобретенной демиелинизирующей полинейропатии максимальна. В зависимости от клинической картины данный диагноз возможен, вероятен либо однозначен. Хронические идиопатические аксональные полинейропатии представляют собой гетерогенную группу медленно прогрессирующих нейропатий с болевым синдромом или без такового и легкой либо умеренной инвалидизацией.
Диагностика
Диагноз дистальной приобретенной демиелинизирующей симметричной полинейропатии основан преимущественно на клинических проявлениях и результатах исследований проводимости нервов, свидетельствующих о демиелинизации. Увеличение содержания белка в СМЖ без плеоцитоза и гистологические признаки демиелинизации и ремиелинизации, зачастую с воспалением, по результатам биопсии, обеспечивают дополнительную информацию. При сомнительном диагнозе рекомендуется проведение биопсии нерва, учитывая ятрогенные последствия и серьезные побочные эффекты длительной иммуномодулирующей и иммуносупрессивной терапии.
Электрофизиологические методы диагностики.
Исследования проводимости нервов позволяют выявить основные признаки демиелинизации. Специальный комитет Американской академии неврологии выделил обязательные нейрофизиологические признаки, типичные для рассматриваемой патологии: частичная блокада проводимости двигательных нервов, снижение скорости проводимости, пролонгированная латентность дистальных двигательных нервов и пролонгированная латентность F-волн. С целью уточнения критериев включения в клинические исследования критерии демиелинизации были модифицированы. Thaisetthawatkul et al выделяют дисперсию дистального комплексного потенциала действия в мышечном волокне как очень чувствительный диагностический признак ХВДП. Хотя научно-исследовательские критерии являются высокоспецифичными, клинические их варианты должны быть еще чувствительнее с целью идентификации пациентов, которым потребуется лечение.
Лабораторные исследования.
Большинство экспертов рекомендует анализ СМЖ с целью выявления типичных признаков ХВДП: повышения содержания белка и нормального или слегка повышенного цитоза. Вместе с тем, согласно критериям INCAP, у таких больных люмбальная пункция не обязательна. Иногда возникает необходимость в расширенных лабораторных исследованиях с целью выявления других причин демиелинизирующей полинейропатии и сопутствующих заболеваний.
Биопсия нервов.
Диагностическая ценность невральной биопсии (в основном икроножного нерва) при ХВДП очень интенсивно дискутируется последние несколько лет. Некоторые эксперты не рассматривают ее как диагностический метод вообще, тогда как другие считают ключевым элементом диагностики и лечения более чем у 60% больных. Bosboom et al сравнивали признаки демиелинизации, аксональной дегенерации, регенерации и воспаления в биоптатах пациентов с ХВДП и хронической идиопатической аксональной полинейропатией. Патоморфологические образцы у большинства лиц обеих групп характеризовались подобными изменениями. Кроме того, по нескольким причинам биопсия нерва не обладает высокой диагностической ценностью при вышеупомянутом состоянии. Наиболее выраженные изменения наблюдаются в проксимальных сегментах двигательных нервов или спинномозговых корешков, которые не всегда анатомически доступны для данной процедуры. Кроме того, одновременные или вторичные аксональные изменения, появляющиеся на ранних стадиях болезни, могут маскировать первичные признаки демиелинизации и воспаления до момента проведения биопсии.
Несмотря на вышеупомянутые ограничения, данный метод в определенных случаях все же полезен ( 1D-G). По мнению Haq et al, биопсия икроножного нерва обладает более высокой чувствительностью, чем электрофизиологические исследования. Аналогично Vallat et al сообщают, что у 8 из 44 больных наблюдались характерные для ХВДП патоморфологические изменения, даже при отсутствии электрофизиологических признаков демиелинизации. Важно отметить, что 5 пациентов положительно отреагировало на лечение.
Биопсия особенно рекомендуется при подозрении на ХВДП, у пациентов, невральная проводимость у которых не свидетельствует о демиелинизации, или при вероятном васкулите. При обследовании 100 больных с данным неврологическим расстройством Bouchard et al доказали, что аксональное разрушение являлось самым чувствительным прогностическим фактором неблагоприятного течения заболевания. При этом демиелинизация наблюдалась у 71% больных, смешанные аксональные и демиелинизирующие изменения у 21% и только аксональное разрушение — всего у 5%.
Томография.
МРТ используется для того, чтобы продемонстрировать гадолиниевое усиление ( 1В и 1С) и увеличение проксимальных отделов нервов или спинномозговых корешков, отражающих активный воспалительный процесс и демиелинизацию конского хвоста либо плечевого сплетения. Изменения со стороны последнего (асимметричный отек и усиление интенсивности сигнала в Т2-режиме) наблюдались более чем у 50% пациентов с ХВДП. Интересно, что аналогичные изменения присутствовали также у больных с дистальной демиелинизирующей полинейропатией при IgM моноклональной гаммапатии.
Дифференциальная диагностика
Дифференциация указанного состояния и других распространенных мотосенсорных поражений периферических нервов, сопровождающих диабет, алкоголизм или недоедание, остается главным вопросом.
Лечение
В целом, лечение заболевания, которому посвящена данная статья, направлено на блокаду патоиммунных процессов, подавление воспаления и демиелинизации с предотвращением вторичной дегенерации аксонов. У пациентов, отреагировавших на него, терапию следует продолжать до достижения максимального улучшения и стабилизации, поэтому есть необходимость в поддерживающем лечении, которое должно подбираться индивидуально для каждого конкретного больного с целью профилактики, снижения частоты обострений и замедления прогрессирования заболевания. Положительный терапевтический ответ заключается в ощутимом улучшении моторики и чувствительности, а также способности пациента к повседневной активности. Важно помнить, что инфекции и лихорадочные состояния также влияют на риск демиелинизации и могут усугублять симптоматику ХВДП. Одновременное назначение нейротоксических препаратов или наличие системных заболеваний, сопровождающихся полинейропатиями, теоретически также влияет на симптоматику.
Наиболее распространенными лечебными подходами при ХВДП являются внутривенное введение иммуноглобулинов, плазмаферез и прием кортикостероидов (табл. 3). Терапию следует начинать на самых ранних стадиях заболевания, чтобы предотвратить прогрессирующую демиелинизацию и вторичное разрушение аксонов, т. Е. Процессов, приводящих к инвалидизации. Согласно опубликованным данным, все три вышеупомянутых подхода, по-видимому, одинаково эффективны. Выбор метода зависит от стоимости, доступности (например плазмафереза) и побочных реакций (особенно если речь идет о тяжелых персистирующих побочных эффектах кортикостероидов). Приблизительно у 60–80% пациентов с классической ХВДП состояние улучшается при использовании одного из перечисленных подходов в режиме монотерапии, однако долгосрочный прогноз в данном случае зависит от своевременности начала лечения и степени аксонального поражения. Азатиоприн, циклофосфамид и циклоспорин довольно долго использовались в качестве средств второй линии при указанном заболевании, однако точные данные относительно их эффективности, основанные на результатах рандомизированных контролированных исследований, недоступны. По непонятным причинам преимущества указанных препаратов не столь впечатляющие при полинейропатии с выработкой антител к миелин-связанному гликопротеину.
Принимая во внимание вероятность аутоиммунных причин ХВДП, а также патогенетическое сходство данной патологии с рассеянным склерозом, были проведены исследования иммуномодуляторов, доказавших свой эффект при втором заболевании. 20 больных с медикаментозно-резистентной ХВДП было включено в проспективное, многоцентровое, открытое исследование интерферона β-1а. Препарат вводился внутримышечно в дозе 30 мкг раз в неделю на протяжении 6-месячного курса лечения. У 35% пациентов отмечалось улучшение, тогда как стабилизации болезни удалось достичь в 50% случаев, поэтому авторы считали целесообразным проведение крупномасштабного плацебо-контролированного исследования. Вместе с тем, другое исследование, в котором получало лечение 4 больных ХВДП, засвидетельствовало, что интерферон эффективен только в сочетании с внутривенным введением иммуноглобулина. Более того, небольшое, рандомизированное, двойное слепое, плацебо-контролированное, перекрестное исследование 10 пациентов с фармакорезистентным вариантом данного заболевания, которым назначался интерферон β-1а (3 раза/неделю подкожно 3 млн. МЕ на протяжении 2 недель и 6 млн. МЕ на протяжении 10 недель), не засвидетельствовало достоверных преимуществ подобного лечения. Роль α-интерферона при ХВДП остается неясной, несмотря на единичные сообщения и даже результаты открытого проспективного пилотного исследования в пользу эффективности данного средства.
Существуют некие опасения, так как по данным нескольких сообщений упомянутое состояние возникает при применении как α- так и β-интерферонов. Кроме того, последние не засвидетельствовали эффекта у больных с IgM моноклональной гаммапатией и синдромом Гийена-Барре. Подобные наблюдения вызвали провокационный вопрос о причинно-следственной связи интерферонов и ХВДП. Hughes et al пришли к выводу, что в настоящее время не существует веских доказательств в пользу эффективности упомянутых препаратов при данном типе полинейропатии.
Другие методы лечения изучались в открытых исследованиях на малочисленных популяциях или даже отдельных пациентах. Положительные результаты наблюдались у больных с наличием в анамнезе фармакорезистентной ХВДП на фоне лечения комбинациями плазмафереза и внутривенного введения иммуноглобулинов, микофенолата мофетила, циклоспорина, этанерсепта, циклофосфамида и аутологической трансплантации гемопоэтических стволовых клеток. У пациентов с мультифокальной моторной полинейропатией или ХВДП сочетание иммуноглобулинов и микофенолата мофетила позволяло снижать дозу как первого компонента схемы, так и кортикостероидов, что подтвердилось в открытом исследовании 6 пациентов и в ретроспективном анализе 21 пациента. В двух последних крупномасштабных исследованиях у 30 больных IgM-ассоциированной демиелинизирующей полинейропатией наблюдалось улучшение клинического состояния при лечении ритуксимабом, который представляет собой химерное человеческое моноклональное антитело против антигена CD20, кроме того он снижает уровень В-лимфоцитов. Вместе с тем, данные рандомизированных, контролированных исследований с участием достаточного числа больных, на основании которых появилась бы возможность разработки четких рекомендаций по лечению вышеупомянутыми препаратами, отсутствуют. Доказательства эффективности плазмафереза, внутривенного введения иммуноглобулинов и кортикостероидов были получены только в краткосрочных исследованиях. Опыт отдельных врачей свидетельствует, что назначение иммуносуппрессоров позволяет снижать частоту и даже отменять плазмаферез и лечение иммуноглобулинами со значительной экономией затрат. Необходимость контролированных исследований для оценки долгосрочных аспектов лечения ХВДП является очевидной.
Основные медуслуги по стандартам лечения | |||||||||||||||||
Клиники для лечения с лучшими ценами
|
