Лимфопролиферативный синдром пропедевтика внутренних болезней
Аутоиммунный лимфопролиферативный синдром – группа генетически обусловленных заболеваний, которые возникают по причине наследственных или соматических мутаций в генах, отвечающих за различные этапы FAS-обусловленного апоптоза. Симптоматика может быть вариабельной и наиболее часто включает в себя лимфаденопатию, спленомегалию и разнообразные аутоиммунные поражения системы крови, печени, щитовидной железы. Диагностика аутоиммунного лимфопролиферативного синдрома производится на основании результатов общего и биохимического анализов крови, биопсии лимфатических узлов, генетических исследований. Специфического лечения заболевания в настоящий момент нет, применяют комбинации иммунносупрессивной и цитотоксической терапии.
Общие сведения
Аутоиммунный лимфопролиферативный синдром (АЛС, ALPS, синдром Канале-Смит) – группа иммунодефицитных состояний, характеризующихся аутоиммунными цитопениями, лимфаденопатией, спленомегалией. Первые данные о заболевании стали поступать в 1968-м году, после чего вскоре началось бурное изучение патологии. Изначально АЛС был отнесен к первичным иммунодефицитам, однако со временем были обнаружены формы синдрома, обусловленные соматическими мутациями в детском и подростковом организме. Данные о встречаемости у разных исследователей довольно сильно различаются, на сегодняшний момент описано более 500 случаев различных форм аутоиммунного лимфопролиферативного синдрома. Наследственные формы заболевания передаются по аутосомно-доминантному типу, при этом в развитии врожденных форм также довольно велика роль спонтанных мутаций. Среди больных с одинаковой частотой встречаются как мальчики, так и девочки.

Аутоиммунный лимфопролиферативный синдром
Причины аутоиммунного лимфопролиферативного синдрома
Выяснено, что причиной любого типа АЛС является нарушение FAS-опосредованного апоптоза лимфоцитов. При образовании Т-лимфоцитов те линии, которые способны атаковать собственные ткани, уничтожаются за счет активизации рецепторов CD-95 (Fas-рецепторов) на поверхности их мембраны. Активация CD-95, относящегося к группе рецепторов фактора некроза опухолей, запускает многостадийную реакцию с участием каспаз, которая оканчивается апоптозом клетки. При аутоиммунном лимфопролиферативном синдроме генетические мутации приводят к блоку этого процесса на определенном этапе, из-за чего устранения потенциально опасных клонов Т-лимфоцитов не происходит, и они начинают накапливаться в лимфатических узлах. Кроме того, создаются условия для аутоиммунного поражения органов и тканей.
Наиболее часто встречаются наследственные и спонтанные мутации в гене TNFRSF6, который кодирует собственно Fas-рецептор. При этом нарушение структуры белка (особенно домена, отвечающего за взаимодействие с FADD-молекулой) приводит к тому, что он становится неспособным выполнять свои рецепторные функции и активизировать апоптоз. Возможны и соматические мутации в гене FAS, которые в полной мере проявляют себя в позднем детском или подростковом периоде, и поэтому их относят к отдельной группе АЛС. Второй по распространенности вариант аутоиммунного лимфопролиферативного синдрома обусловлен мутацией в гене CASP10, кодирующем цистин-аспарагин кислотную протеазу (каспаза-10). Этот белок играет ключевую роль в передаче сигнала об апоптозе с клеточной мембраны в ядро клетки. К этому же варианту относят и мутации гена CASP8.
Третьим по распространенности является аутоиммунный лимфопролиферативный синдром, который вызван мутацией в гене FASLG, кодирующем Fas-лиганд или рецептор CD-178. Он играет вспомогательную роль в распознавании факторов, стимулирующих апоптоз, и участвует в передаче сигнала в клетку. Некоторые формы АЛС обусловлены мутацией гена NRAS, который кодирует «малый G-белок», принимающий участие в качестве вторичного мессенджера в передаче сигналов с мембраны в клетку, в том числе и ядро. Примерно в трети случаев аутоиммунного лимфопролиферативного синдрома врачам-иммунологам не удается установить непосредственную причину заболевания.
Классификация аутоиммунного лимфопролиферативного синдрома
При помощи методов современной генетики удалось выявить шесть основных форм АЛС:
ALPS 1A – вызвана мутацией гена TNFRSF6, расположенного на 10-й хромосоме, чаще всего имеет врожденный характер, наследуется по аутосомно-доминантному типу. По статистике, более 40% АЛС относятся именно к этой разновидности.
ALPS 1В – обусловлена мутацией гена FASLG, также довольно часто приводит к врожденному аутоиммунному лимфопролиферативному синдрому. К этому типу относят около 10% от всех клинических случаев АЛС.
ALPS 1m – ее причиной являются соматические мутации в гене FAS, возникающие в детском или подростковом возрасте и поэтому приводящие к поздним формам АЛС. При этом повреждение гена должно произойти в полипотентной клетке-предшественнице, которая способна дать начало многим линиям лимфоцитов. При этой форме наиболее часто возникает внезапная самопроизвольная ремиссия заболевания.
ALPS 2 – вызвана мутацией в генах CASP10 и, по некоторым данным, CASP8, которые кодируют белки-каспазы, передающие сигнал об апоптозе от рецептора к ядру клетки. Эта форма аутоиммунного лифопролиферативного синдрома составляет примерно 25% от всех случаев заболевания, может быть как врожденной, так и проявиться в более старшем возрасте.
ALPS 3 – мутация какого гена и характер ее наследования при этой форме неизвестны. Особенностью такого варианта АЛС является нарушение не только FAS-, но и IL2-опосредованного апоптоза, а также более тяжелый характер течения.
ALPS 4 – обусловлена мутацией гена NRAS, также кодирующего белки-передатчики внутриклеточного сигнала. Данный тип аутоиммунного лимфопролиферативного синдрома характеризуется более доброкачественным течением и умеренной выраженностью симптомов.
Симптомы аутоиммунного лимфопролиферативного синдрома
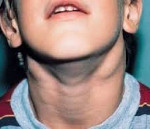
Симптомы АЛС довольно вариабельны из-за большого количества мутаций, которые могут приводить к такому состоянию. Начало заболевания можно заметить уже на 15-й день после рождения (при врожденных формах), в детском или подростковом возрасте в случае соматических мутаций в генах FAS, CASP10 или NRAS. Обычно первым проявлением заболевания является лимфаденопатия – подмышечные, паховые или шейные лимфатические узлы увеличиваются в размерах, но при этом безболезненны и не спаяны с окружающими тканями. Регистрируется спленомегалия, в некоторых случаях она сопровождается увеличением печени (гепатоспленомегалия).
Аутоиммунные проявления АЛС регистрируются обычно через некоторое время после лимфаденопатии и увеличения селезенки. В основном это поражения кровяных ростков – тромбоцитопения, гемолитическая анемия, приводящая к желтухе, изредка нейтропения. Помимо крови, аутоиммунному поражению могут подвергаться органы ЖКТ (возникают гастрит, панкреатит, колит, аутоиммунный гепатит). На коже могут проявляться признаки васкулита, делая клинику аутоиммунного лимфопролиферативного синдрома схожей с таковой при системной красной волчанке. Кроме того, могут возникать аутоиммунные формы тиреоидита, гломерулонефрита, поражаться суставы, ткани глаза (иридоциклит, увеит). Нередки поражения центральной нервной системы – эпилептические припадки, миелиты, мозжечковая атаксия.
Выраженность симптомов и их количество может значительно варьироваться у каждого конкретного больного. Кроме того, при аутоиммунном лимфопролиферативном синдроме в десятки раз возрастает риск развития злокачественных опухолей, так как опухолевые клоны лимфоцитов также устраняются посредством апоптоза. Примерно в 20% случаев АЛС приводит к неходжкинским лимфомам (лимфома Беркитта, фолликулярная лимфома), описаны и другие онкологические заболевания. Из-за этого проявления АЛС могут быть ошибочно определены как следствие опухолевой инфильтрации лимфоидной ткани. Среди других осложнений аутоиммунного лимфопролиферативного синдрома наиболее часто встречается травматический разрыв селезенки, сепсис и другие инфекционные поражения.
Диагностика аутоиммунного лимфопролиферативного синдрома
Диагностика АЛС производится на основании осмотра, а также лабораторных, иммунологических и генетических исследований. При осмотре выявляют увеличение более чем трех групп лимфатических узлов, спленомегалию, увеличение печени. Анализ крови может показывать уменьшение количества некоторых клеток (анемию, тромбоцитопению), у части больных определяется высокая (до 30%) эозинофилия. Проба Кумбса положительная, в биохимическом анализе крови определяется выраженная гипергаммаглобулинемия. Одним из высокочувствительных методов иммунологической диагностики аутоиммунного лимфопролиферативного синдрома является проточная иммуноцитофлюориметрия, проводимая с целью выявления количества лимфоцитов с атипичным набором рецепторов (CD3+CD4-CD8-). При АЛС количество таких клеток превышает 1% от всех лимфоцитов. В биоптате лимфатических узлов определяется фолликулярная гиперплазия, результатом гистологического исследования селезенки служит лимфоидная гиперплазия.
Врачом-генетиком может быть произведено секвенирование гена FAS с целью выявления мутаций, ставших причиной аутоиммунного лимфопролиферативного синдрома. С учетом значительной величины этого гена для ускорения и удешевления процедуры поиск может быть произведен лишь в отдельных экзонах гена FAS, в которых наиболее часто обнаруживаются нарушения – эти участки называют «горячими точками». Таким образом, при помощи генетической диагностики можно определить АЛС только 1А, 1В и 1m типов. Методики определения остальных форм АЛС генетическими методами на сегодняшний день не разработаны. Изучение наследственного анамнеза в ряде случаев будет неэффективно из-за значительной доли форм заболевания, вызванных соматическими мутациями.
Лечение и прогноз аутоиммунного лимфопролиферативного синдрома
Этиотропное лечение аутоиммунного лимфопролиферативного синдрома не разработано, патогенетическая терапия сводится к применению иммуносупрессивных и цитотоксических средств. В качестве средств, подавляющих аутоиммунную активность, наиболее часто используют кортикостероиды (преднизолон, дексаметазон). К специфическим препаратам, ограничивающим скорость пролиферации лимфоцитов, относят микофенолата мофетил, сиролимус. Также при аутоиммунном лимфопролиферативном синдроме активно применяются традиционные цитотоксические средства – метотрексат, циклоспорин А и другие. При значительном увеличении селезенки или отсутствии эффекта от консервативного лечения прибегают к спленэктомии. Пересадка костного мозга и использование стволовых клеток в долгосрочной перспективе давали только временный эффект. При значительно выраженных гематологических нарушениях применяют гемотрансфузии, введение эритроцитарной или тромбоцитарной массы. Больному следует избегать физических нагрузок, использовать высоковитаминную диету.
Прогноз заболевания, ввиду высокой вариабельности и выраженности симптомов, неопределенный или неблагоприятный. У большей части больных проявления заболевания постепенно нарастают, со временем приводя к летальной анемии, тромбоцитопении, билиарному циррозу печени. Также важную роль в прогнозе играют нарушения иммунитета, так как нередко причиной смерти выступают сепсис и другие инфекционные поражения. В прогнозе аутоиммунного лимфопролиферативного синдрома следует учитывать и повышенный риск онкологических заболеваний, примерно пятая часть больных умирает от различных типов лимфом. В некоторых случаях возникает спонтанная и длительная ремиссия патологии.
Источник
Эти синдромы характерны для гемобластозов. При лейкозах патологические изменения (пролиферация опухолевых клеток) изначально локализуются в костном мозге, затем патологические клетки поступают в периферическую кровь и метастазируют в другие органы.
Для лейкозов характерны следующие признаки.
- 1. Патологическая пролиферация клеток одного из ростков кроветворения (миелоидного, лимфоидного).
- 2. При острых лейкозах почти полностью отсутствует дифференци- ровка клеток пораженного ростка кроветворения, и в периферической крови преобладают бластные формы. Зрелые клетки представлены в небольшом количестве. Полностью отсутствуют переходные формы созревания. Этот признак острого лейкоза называется лейкемическим провалом (hiatus leucemicus).
- 3. Для хронических лейкозов характерно уменьшение дифферен- цировки клеток. В периферической крови выявляются все переходные формы пораженного ростка кроветворения.
- 4. Вследствие патологической пролиферации клеток одного из ростков кроветворения другие ростки кроветворения подавляются (чаще подавляются эритроцитарный и тромбоцитарный).
- 5. В различных органах выявляются патологические разрастания клеток пораженного ростка кроветворения — лейкемоидные инфильтраты. При остром лейкозе возникновение лейкемоидных инфильтатов возможно в различных органах и тканях (печень, селезенка, лимфатические узлы, кожа, центральная нервная система и др.) При хроническом лимфолейкозе сначала поражаются лимфатические узлы, затем печень и селезенка. При хроническом миелолейкозе в первую очередь характерно увеличение печени и селезенки.
Геморрагический синдром достаточно часто встречается при заболеваниях крови.
Проявлением гипокоагуляции являются геморрагические диатезы, которые подразделяются на следующие формы.
- 1. Коагулопатии — нарушен коагуляционный гемостаз из-за врожденных (например, при гемофилии) или приобретенных (например, при болезнях печени, злокачественных опухолях, после лечения антикоагулянтами) нарушений образования факторов свертывания.
- 2. Тромбоцитопении или тромбоцитопатии — нарушен тромбоцитарный гемостаз (например, при тромбоцитопенической пурпуре, тромбоцитопатии).
- 3. Вазопатии — диатезы из-за патологии стенки кровеносных сосудов (например, при геморрагическом тромбоваскулите — болезнь Шенлейна — Геноха, при наследственной геморрагической телеангиэктазии — болезнь Рандю — Ослера, при лекарственной аллергии, сахарном диабете, злокачественных опухолях или при патологии соединительной ткани).
Выделяют 5 типов кровоточивости.
- 1. Гематомный тип — проявляется образованием внутри- и межмышечных гематом, кровоизлияниями в полость суставов (гемартрозы) и характерен для гемофилии.
- 2. Петехиалъно-пятнистый тип — характеризуется появлением мелкоточечных геморрагий, синячков и кровоподтеков больших размеров (экхимозы), не возвышающихся над поверхностью кожи и не исчезающих при надавливании. Этот тип встречается при тромбоцитопе- ниях (уменьшение количества тромбоцитов) и при тромбоцитопатиях (нарушение функции тромбоцитов). Нередко у этих больных наблюдаются носовые, десневые, маточные, желудочно-кишечные кровотечения.
- 3. Васкулито-пурпурный тип — характеризуется мелкоточечными геморрагиями, слегка возвышающимися над поверхностью кожи, не исчезающими при надавливании. Этот тип характерен для геморрагического тромбоваскулита Шенлейна — Геноха.
- 4. Ангиоматозный тип — характеризуется появлением телеанги- эктазов размером от булавочных уколов до крупных ангиом диаметром 3—4 мм на коже лица, туловища и верхних конечностей, на слизистых оболочках, что может сопровождаться развитием кровотечений. Наиболее встречающимся заболеванием с данным типом кровоточивости является врожденная сосудистая патология, наследуемая по аутосомно- доминантному типу, — геморрагическая телеангиэктазия (болезнь Рандю — Ослера).
- 5. Смешанный тип — имеет признаки разных типов. При этом типе преобладают микроциркуляторные геморрагии, но на них периодически наслаиваются кровоизлияния гематомного характера, обильные спонтанные и послеоперационные кровотечения, меноррагии. Смешанный тип кровоточивости отмечается при тяжелой форме болезни Виллебранда (БВ), ДВС-синдроме.
Источник
Данный симптомокомплекс встречается при хроническом классическом лимфолейкозе и других её формах (опухолевая, костномозговая, спленомегалическая, пролимфоцитарная, хр. лимфолейкоз, осложненный цитолизом), а также иных его вариантах (волосатоклеточный лейкоз и хронический лейкоз из больших зернистых лимфоцитов). Этиология ассоциируется с воздействием ионизирующей радиации, лекарств, химических веществ. Наиболее очевидна роль вирусной инфекции (ретровирусов) и генетических аномалий (хромосомных).
Клиника. Чаще всего лимфопролиферативный синдром развивается у лиц старше 50-60 лет, исключительно редко в возрасте молеже 25 лет, чаще у мужчин (в 2 раза), чем у женщин. По течению различают 1) доброкачественную, 2) прогрессирующую, 3) селезеночную (спленомегалическую), 4) абдоминальную, 5) опухолевую, 6) костномозговую, 7) пролимфоцитарную. Начальный период: активных жалоб нет или небольшая слабость, потливость, простудные болезни. Случайно или при профилактическом осмотре выявляются увеличенные лимфатические узлы, а также изменения в анализе крови: лейкоцитоз (10-30х10 в 9/л?) и лимфоцитоз (до 60-80%). Обычно увеличиваются шейные, затем подмышечные и значительно позже (в развернутой форме болезни) – другие группы лимфоузлов,от небольшого до значительного размера,эластично-тестоватой консистенции (не плотной!), безболезненные, не спаяны с кожей и между собой, не изъязвляются и не
нагнаиваются. Период выраженных проявлений – развернутая картина: резко выраженная слабость, снижение работоспособности, значительная потливость, похудание, повышение температуры тела, увеличение лифмоузлов.
Осмотр: обращают на себя внимание лифмоаденопатия и нередко изменения кожи (лимфоидные инфильтраты,неспецифические поражения,обстрения течения ранее существовавших кожных болезней, нередко – эксфолиативная эритродермия, опоясывающий герпес, крапивница, нейродермит). С помощью специальных методов (УЗИ, компьютерная томография) выявляется также увеличение внутригрудных и внутрибрюшных лимфатических узлов (признаки компрессии в ряде случаев не наблюдается).Печень и селезенка увеличены, наблюдается лейкемическая инфильтрация слизистой оболочки ЖКТ, что сопровождается язвенным поражением желудка, 12-перстной кишки, кровотечениями и развитием синдрома мальабсорбции. Могут развиваться лейкемическая инфильтрация верхних и нижних дыхательных путей (одышка, кашель, кровохарканье), плевры (фиброзный или экссудативный плеврит), паренхимы почек (хотя клиничекские проявления редки), в кавернозных телах (приапизм – длительная и болезненная эрекция) и центральной нервной системе (с развитием менингита, менингоэнцефалита, паралича черепно-мозговых нервов и даже комы).
Доп.исследования: а) лабораторные – лейкоцитоз и резкое увеличение лимфоцитов (самый характерный признак), нормохромная анемия; протеинурия, нерезко выраженная гематурия; биохимические – гипогаммаглобулинемия, реже – гипоальбуминемия, гиперферментемии (отражают цитолиз гепатоцитов); иммунологические – повышение содержания в крови и селезенке Т-лимфоцитов-супрессоров и нарушение соотношения Т-лимфоциты-хелперы/Т-лимфоциты-супрессоры, а также снижение уровня иммуноглобулинов IgG,IgA,IgM, причем особенно значимо IgA и IgM. Иммунофенотипирование позволяет установить, что основными лейкозными клеками являются В-лимфоциты с фенотипом CD19, CD20, CD5, CD23. Цитогенетическое исследование позволяет установить у 65% больных хромосомные аномалии.
Принципы лечения: лечебный режим, цитостатики(показания – ухудшение общего состояния пациента, быстрое увеличение печени, селезенки, лимфатических узлов, появление лекемической инфильтрации нервных стволов, некроветворных органов, что сопровождается болевым синдромом и нарушением функци), неуклонное нарастание количества лейкоцитов (100х10 в 9/ л и более) – хлорбутин, циклофосфан, пафенцил, проспидин, спиробромин, при специальных показаниях – полихимиотерапия (цитостатики с различным механизмом действия); лимфоцитафарез (при гиперлейкоцитозе более 200х10 в 9/л), лучевая терапия (при преимущественном и резком увеличении отдельных групп лимфатических узлов и селезенки, а также генерализованная лимфаденопатия); cпленэктомия (увеличение селезенки, не поддающееся лучевой и цитостатической терапии; частые инфаркты селезенки; варианты болезни, протекающие с преимущественной спленомегалией и сублейкемическим лейкоцитозом; волосатоклеточный лейкоз, характеризующийся спленомегалией, глубокой эритро-, тромбоцито- и гранулоцитопенией; аутоиммунная гемолитическая анемия и тромбоцитопения, не контролируемая глкюкокортикоидами); глюкокортикоиды (по строгим показаниям – аутоиммунная гемолитическая анемия и тромбоцитопения, развившиеся на фоне хр. лимфолейкоза, не менее 80 мг; cублейкемический вариант хр. лимфолейкоза со значительным увеличением лимфоузлов, печени, селезенки, когда невозможно использовать лучевую или цитостатическую терапию или болезнь резистентна к указанным видам лечения; цитопения вследствие терапии цитостатиками, в частности, геморрагический тромбоцитопенический синдром, 60-120 мг; полихимиотерапия с преднизолоном; контроль за инфекционными осложнениями (антибиотики широкого спектра действия – полусинтетические пенициллины, цефалоспорины, аминогликозиды и макролиды, иммуноглобулин.
Следует отметить зависимость программы лечения от нозологического диагноза больного с лимпфопролиферативным синдромом.
Источник
