Метаболический синдром и рак молочной железы
Ашрафян Л.А., Овчинникова О.А.
Введение
Рак молочной железы (РМЖ) – наиболее распространенный вид опухолей, встречающихся среди женского населения Европы, Америки и некоторых стран Азии [4,5,8-10,12]. В течение последних 20 лет в мире, а также в России наметилась устойчивая тенденция к росту заболеваемости этим видом рака, особенно в городах и мегаполисах [7-9,12]. Начиная с 1985 г. РМЖ занимает 1-е место среди онкологических заболеваний у женщин (частота встречаемости – 31,2%) [4,5,8-10].
Известно, что развитие опухоли связано с нарушением роста и дифференцировки клеток и злокачественным их перерождением. Во многих случаях такие нарушения обусловлены мутациями или резким повышением активности клеточных онкогенов – нормальных генов, которые участвуют в регуляции клеточного цикла, передаче сигналов и других процессах жизнедеятельности клеток. В 10% случаев заболевание передается из поколения в поколение и обусловлено наличием врожденных мутаций в генах предрасположенности BRCA1 или BRCA2 (BReast CАncer) [1,8,9,13,14].
Развитие и биологические характеристики рака молочной железы во многом определяются метаболизмом эстрогенов. К наиболее значимым проявлениям действия эстрогенов относят активацию пролиферации, ингибирование процессов апоптоза, а так же стимуляцию выработки факторов роста. Вышеперечисленные эффекты могут обуславливать развитие пролиферативных гиперпластических процессов и рака в эстроген-зависимых тканях.
В настоящее время при определении прогноза заболевания и выбора наиболее адекватной тактики лечения больных раком молочной железы основываются на ряде факторов, определяющих как особенности организма (возраст, состояние менструальной функции), так и биологические характеристики самой опухоли (размер опухоли, наличие метастазов в регионарные лимфоузлы, тип опухолевого роста, гистологическая принадлежность, степень злокачественности, инвазия кровеносных и лимфатических сосудов, уровень экспрессии рецепторов эстрогенов и прогестерона и др.). Однако результаты лечения далеко не всегда являются удовлетворительными. И в настоящее время ведется поиск новых, более информативных параметров, позволяющих адекватно учитывать молекулярные механизмы развития опухолевого процесса.
Несмотря на значительные достижения молекулярной биологии и генетики последнего десятилетия в диагностике, лечении и профилактике рака молочной железы тема остается актуальной. Железистый компонент молочной железы является гормонозависимой мишенью по отношению к яичниковым гормонам, особенно эстрогенам и его метаболитам [3,11].
В настоящее время в отечественной литературе уделяется мало внимания роли метаболитов эстрогенов в генезе гормонозависимых опухолей репродуктивных органов у женщин. Более того, практически отсутствуют исследования, касающиеся попыток их коррекции. Вместе с тем, современная фармакологическая индустрия выделила ряд соединений, активно участвующих в регуляции эстрогенных метаболитов [2,3,15]. Одним из таких препаратов, корректирующий соотношение 2 -ОНЕ1 к 16α-ОНЕ1 является индинол – фитонутриент, содержащийся в овощах семейства крестоцветных, обладающий противоопухолевой активностью. В биохимических исследованиях установлено, что Индинол препятствует образованию 16 α-гидроксистерона, блокирует проведение сигналов в опухолевые клетки, которые побуждают ее к активному делению, и обладает свойством индуцировать в опухолевых клетках процессы апоптоза [3,15].
Для нас было важным на основе современных методологий, на одном клиническом материале обозначить роль метаболического синдрома и убедиться в реальной значимости влияния Индинола на уровень экспрессии метаболитов эстрогенов, что позволит существенно расширить представление о подходах к предупреждению и лечению опухолей молочной железы.
Цель исследования: Изучить роль метаболического синдрома у больных раком молочной железы, оценить изменение экспрессии метаболитов эстрогенов (16α-ОН и 2-ОН) и возможности их коррекции.
Материалы и методы
В основу работы легли результаты наблюдений за 86 больными РМЖ I–IV стадий и 50 пациентками с фиброзно-кистозной мастопатией, находящихся на лечении в ФГУ РНЦРР в период с 2006 по 2009 г. Средний возраст больных РМЖ составил 47,3±4,1 года, в контрольной группе этот показатель был равен 49,6±2,5 года. Распределение по стадиям пациенток со злокачественными новообразованиями молочной железы было следующим: I стадия РМЖ диагностирована у 31 (36,04%), II – у 40 (46,5%), III – у 15(17,4%) больных. В план лечения входили различные варианты хирургических вмешательств: секторальная резекция молочной железы; радикальная резекция молочной железы с регионарной лимфаденэктомией (ЛАЭ); радикальная резекция молочной железы с регионарной ЛАЭ и одномоментной пластикой торакодорзальным лоскутом и фрагментом большой грудной мышцы; мастэктомия по Маддену; подкожная мастэктомия (одно- или двусторонняя) с одномоментным аломаммопротезированием. Гистологическое и иммуногистохимическое исследования биопсийного и операционного материалов проводили в отделении патоморфологии ФГУ РНЦРР.
Молекулярно-генетическое исследование проводилось с использованием метода полимеразной цепной реакции (ПЦР). Основные этапы исследования включили в себя: подготовку материала и выделение из него ДНК, аплификацию и детекцию продуктов ПЦР.
Для количественного определения соотношения метаболитов эстрогенов в моче (2 гидроксиэстрон/16α-гидроксиэстрон) в настоящей работе использован иммуноферментный набор ESTRAMET 2/16 ELISA.
Использовалась утренняя моча 40 мг с добавлением 50 мг аскорбиновой кислоты (лучше всего для хранения образца), затем образец мочи подписывался и помещался в заморозку при -20°С и ниже. Образцы в таком состоянии могут храниться в замороженном состоянии несколько месяцев без потери метаболитов.
Принцип методики: тест ESTRAMET 2/16α ELISA основан на конкурентном методе твердофазного иммуноферментного анализа (рис.1).
С помощью набора ESTRAMET 2/16 определялась индивидуальная концентрация 2-гидроксиэстрона (2ОНЕ1) и 16α-гидроксиэстрон (16αОНЕ1) в моче. В методе используются антитела, связанные с твердой фазой (лунки микропланшета) и антиген (метаболит эстрогена), конъюгированный с ферментом. Во время инкубации связывание конъюгированного с ферментом антигена с иммабилизованными в лунках микропланшета антителами ингибируется добавленными в лунки свободным антигеном, присутствующим в стандартных образцах. Так как число сайтов связанных с антителами, иммобилизованными в лунке, ограничено, то активность фермента, связавшегося с твердой фазой (в лунке) снижается в присутствии свободного антигена. После промывки лунок добавляется субстрат, в результате его взаимодействия с ферментом появляется цветное окрашивание (рис 2).

Рис. 1. Метод твердофазного иммуноферментного анализа
Рис. 2. Цветное окрашивание лунок при взаимодействии субстрата с ферментом
Интенсивность окрашивания обратно пропорциональна концентрации свободного антигена. Моноклональные антитела к метаболитам эстрогена иммобилизованы непосредственно в лунках микропланшета. Метаболиты эстрогена конъюгированы со щелочной фосфатазой.
2ОНЕ1 и 16α-ОНЕ1 в моче обнаруживаются в форме 3-глюкуронида и 3- или 3,16α–глюкуронидов, соответственно. Для глюкуронидов требуется удаление сахаров перед тестированием, для распознавания моноклональными антителами. Для высвобождения эстрогенов от глюкуроновой кислоты и от сульфата используют смесь β-глюкуронидазы и арилсульфатазы, выделенных из улитки Helix pomatia. В ходе анализа при подготовке образцов, аликвоту мочи разводят в соотношении 1:20 буфером, содержащим ферменты и инкубируют до полного расщепления. Затем смесь ферментов нейтрализуется, и полученный раствор используется непосредственно для анализа.
Значения уровня метаболитов эстрогенов в моче у «здоровых» женщин, по данным литературы: 16α-ОН -0,6-10 нг/мл; 2-ОН -1-20 нг/мл; 2-ОН/16α-ОН (в популяции «здоровых» женщин) – 0,6-6. Среднее значение соотношения 2-ОН/16α-ОН для здоровых женщин – 2.
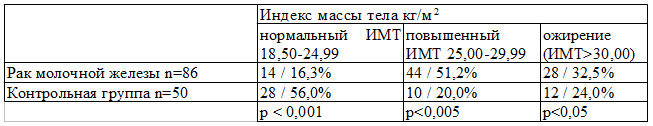
Результаты и обсуждение. В нашей работе мы оценили индекс массы тела больных раком молочной железы в сравнении с контрольной группой. Как видно из табл. 1 в группе больных раком молочной железы всего у 14 пациенток (16,3%) нормальный индекс массы тела, у 44 больных (51,2%) он повышенный и у 28 (32,5%) индекс массы тела превышает 30 кг/м2. При этом в контрольной группе повышенный индекс массы отмечен лишь у 10 женщин, что составило 20,0% и только в 24,0% наблюдений индекс массы тела превышал 30 кг/м2. Из 50 женщин контрольной группы у 28 (56,0%) индекс массы тела был в пределах нормы.
Таблица 1. Индекс массы тела у больных раком молочной железы и контрольной группы (абс/%).
Таким образом, ожирение, являясь патогенетическим субстратом продукции эстрона в постменопаузе, становится как бы маркером гиперэстрогении. Кроме того, жировая ткань является источником ряда значимых с онкологической точки зрения цитокинов: фактора некроза опухолей-α (ФНО-α) и интерлейкина 6. Многие исследователи рассматривают ФНО-α как медиатор инсулинорезистентности. Количество интерлейкина-6, продукция которого сосредоточена в абдоминальной жировой ткани, значительно увеличивается с развитием ожирения.
Следующим этапом наших исследований стало изучение уровня продукции 2 – гидроксиэстрона, 16а-гидроксиэстрона и их соотношений.
Как видно из приведенных данных, средний уровень метаболита 2-ОН в группе больных раком молочной железы (7,80 нг/мл) в 3,2 раза ниже, чем в контрольной группе (25,08 нг/мл). В то же время, средний уровень метаболита 16α-ОН оказался выше, чем в контрольной группе (18,63 нг/мл и 12,00 нг/мл соответственно) в 1,6 раза. Соотношение метаболитов в группах также демонстрировало существенные, статистически достоверные (Р<0,001), различия. При раке молочной железы величина 2-ОН/16α-ОН находилась на уровне 0,42, в то время, как в контрольной группе это показатель более, чем в 5 (2,09) раз превышал коэффициент для больных раком молочной железы. Полученные данные свидетельствуют о том, что в группе больных раком молочной железы метаболизм эстрона через систему цитохромов Р450 чаще ориентирован на продукцию «агрессивного» метаболита 16α-ОН.
Таблица 2. Средний уровень и соотношение метаболитов эстрогенов 2-ОН/16α-ОН

Примечание: * – статистически достоверные отличия между группами, р<0,01
Следующим этапом мы провели анализ соотношения метаболитов 2-ОН/16α-ОН в зависимости от индекса массы тела (рис. 3)
Рис. 3. Средний коэффициент соотношения метаболитов (2-ОН/16α-ОН) у больных раком молочной железы и в контрольной группе в зависимости от индекса массы тела (кг/м2) в группе контроля
Обращает на себя внимание то, что в группе больных с низким индексом массы тела (отсутствие клинически выраженных проявлений метаболического синдрома) отмечен низкий (0,8) коэффициент соотношения метаболитов. Иными словами, при раке молочной железы участие «агрессивных» метаболитов в формировании баланса гормонов представляется более значительным у пациенток и без ожирения. Отчетливо прослеживается и следующая тенденция: по мере нарастания индекса массы тела снижается соотношение метаболитов, о чем свидетельствует более высокий уровень экспрессии 16а-ОН. В то же время, в группе контроля соотношение этих двух метаболитов при различных ИМТ подвержено меньшим колебаниям. Однако следует особо отметить, что при индексе массы тела >30 в группе контроля зафиксировано падение коэффициента ниже 2. О чем это свидетельствует? Без преувеличения можно констатировать, что любое увеличение индекса массы тела свидетельствует о формировании целого комплекса метаболических нарушений, а повышенная экспрессия 16аОН – один из факторов. Иными словами, низкий коэффициент соотношения метаболитов при высоком индексе массы тела может служить признаком высокого риска развития в будущем опухолей репродуктивных органов.
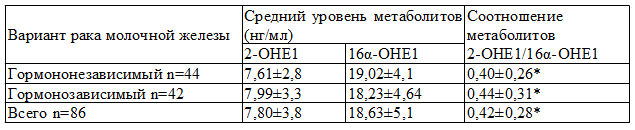
Особое значение в рамках настоящего исследования имеет анализ данных об уровнях метаболитов при различных вариантах рака молочной железы (гормонозависимый и гормононезависимый варианты). В нашем исследовании у 42 больных имелся гормонозависимый и у 44 – гормононезависимый рак молочной железы. Следует заранее оговорить, что определение варианта рака молочной железы выполнялось с помощью иммуногистохимического исследования.
Таблица 3. Средний уровень и соотношение метаболитов эстрогенов 2-ОН/16α-ОН в зависимости от варианта рака молочной железы

Примечание: *- статистически достоверные отличия между группами, р<0,001
Полученные данные иллюстрируют закономерность: при низком уровне рецепторов (гормоннезависимый вариант) мы имеем более высокие значения 16α-ОН – 19,02 (а значит и низкое соотношение 2-ОН/16α-ОН=0,40), в то время как при высоком рецепторном статусе (гормонозависимый вариант) соотношение метаболитов несколько выше – 0,44.
Закономерен вопрос, можно ли каким-то образом повысить в организме уровень 2-ОН (2-гидроксиэстрона) и тем самым блокировать один из ключевых путей патологической пролиферации в гормон-зависимых тканях? В большом количестве проведенных за рубежом экспериментальных и клинических исследованиях было показано, что активно действующий компонент индинола – индол-3-карбинол, а также его физиологический метаболит – 3,3’-дииндолилметан (DIM) обладают выраженным антиэстрогенным эффектом, стимулируя образование в гормон-зависмых тканях антипролиферативного 2-гидроксиэстрона и улучшая таким образом соотношение 2-ОНЕ1/16α-ОНЕ1 в пользу первого.
Рис. 4. Результаты сравнительного исследования
Опираясь на эти данные, предприняли попытку изменить уровень экспрессии эстрогенных метаболитов в сторону усиленной продукции антипролиферативного метаболита 2-ОН (2-гидроксиэстрона) преследуя, как бы две цели: предупреждение новых очагов рака в контралатеральной молочной железе и предупреждение рецидива заболевания и метастазирования.
С этой целью больные раком молочной железы в течение 6 месяцев получали индинол и в интервале 3 и 6 месяцев по схеме 2 капсулы, 2 раза в день (400 мг/сут), без перерыва. У них определялся уровень 2-гидрокси-эстрона и 16α-гидроксиэстрона в моче через 3 месяца и затем через 6 месяцев. Назначался препарат Индинол параллельно с началом общепринятого стандартного лечения рака молочной железы и продолжался прием препарата на фоне проводимого лечения (хирургическое, химиотерапевтическое, лучевое, гормональное).
Результаты исследования свидетельствуют, что заметное улучшение в метаболизме эстрогенов проявляется уже после 3-х месяцев приема: существенно снизился уровень 16α-ОН (с 18,63 нг/мл до 12,00 нг/мл) и возрос уровень экспрессии 2-ОН (с 7,8 нг/мл до 11,31нг/мл). Соответственно коэффициент соотношения метаболитов увеличился более чем в 2 раза: с 0,42 до начала лечения до 0,94 через 3 мес. Последующие еще 3 мес. приема привели к полному восстановлению нормального взаимоотношения метаболитов. Коэффициент 2-ОН/16α-ОН достиг 2,31. При этом экспрессия 16α-ОН снизилась в 3 раза в сравнении с данными до начала лечения. Иными словами, для достижения полного «метаболического» эффекта необходим длительный, не менее полугода, прием препарата. Этот факт вполне вписывается в механизм фармокинетики таргетных препаратов, эффект действия которых сопряжен с формированием нормальных физиологических процессов.
Выводы
1. У больных раком молочной железы отмечена высокая экспрессия 16α-ОН и низкие показатели 2-ОН (коэффициент соотношения 0,42) в сравнении с контрольной группой (2,09), что является важной составляющей метаболического синдрома.
2. Низкий коэффициент соотношения метаболитов характерен как для гормонозависимого (0,44), так и для гормононезависимого (0,4) вариантов заболевания.
3. При раке молочной железы вне зависимости от индекса массы тела отмечен низкий уровень коэффициента соотношения метаболитов, что позволяет отнести этот показатель к прогностическому маркеру при определении риска развития рака молочной железы.
4. Для рака молочной железы характерен высокий уровень сопутствующих эндокринно-обменных нарушений при высоком индексе массы тела, что отражает клиническое проявление метаболического синдрома. Увеличение индекса массы тела коррелирует с коэффициентом соотношения метаболитов для группы контроля: при низком ИМТ (<25 кг/м2) коэффициент соответствует 2,24, при ИМТ>30 кг/м2 он снижается до 1,99.
5. При всех вариантах рака молочной железы проявляется эффект корректирующего действия Индинола наиболее выраженный по истечении 6 месяцев приема.
Источник
ПРОЯВЛЕНИЯ МЕТАБОЛИЧЕСКОГО СИНДРОМА У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ СОЧЕТАНИИ С МИОМОЙ МАТКИ
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Франциянц Е.М.
1
Верескунова М.И.
1
Кечеджиева Э.Э.
1
Кечеджиева С.М.
1
Черярина Н.Д.
1
1 ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России
Изучены некоторые показатели метаболического синдрома у женщин с патологией рака молочной железы и сочетанной патологией рака молочной железы и миомы матки постменопаузального и перименопаузального периодов. Выявлено, что у больных раком молочной железы в самостоятельном варианте имеются нарушения в антропометрических показателях и липидном спектре сыворотки крови (абдоминальное ожирение, изменение липидограммы крови, повышенный уровень натощак глюкозы и инсулина, свидетельствующий о наличии инсулинорезистентности, сочетание соматической патологии с преобладанием артериальной гипертензии и ишемической болезни сердца), тогда как у женщин с сочетанной патологией (рак молочной железы и миома матки) ни антропометрические показатели, ни данные липидного обмена не выходили за пределы нормативных значений. Однако на основании выявленных принципиальных отличий метаболического фона пока нельзя дать однозначного ответа на вопрос: являются ли пременопаузальный и постменопаузальный рак разными заболеваниями или одной болезнью.
рак молочной железы в сочетании с миомой матки
метаболический синдром
1. Ашрафян Л.А., Харченко Н.В., Степанова Е.В., Бабаева Н.А., Ивашина С.В., Саратян А.А. / Рак вульвы: этиопатогенетическая концепция. https://www.rosoncoweb.ru/congress/ru/09/24.htm.
2. Бойцов С.А., Голощапов А.В. Связь основных параметров метаболического сердечно-сосудистого синдрома со степенью нарушения углеводного обмена и выраженностью абдоминального ожирения у мужчин. // Артериальная гипертензия. – 2003. – Т. 9, № 2. – С. 32–39.
3. Бутрова С.А. Метаболический синдром: патогенез, клиника, диагностика, подходы к лечению // Русский медицинский журнал. – 2001. – Т. 9, № 2. – С. 56–60.
4. Дильман В.М. Эндокринологическая онкология. – Ленинград: Медицина, 1983. – 408 с.
5. Казека Г.Р. Метаболический синдром. «Врачебный практикум». – Новосибирск, 2002. – 50 с.
6. Перова Н.В., Метельская В.А., Мамедов М.Н., Оганов Р.Г. Методы раннего выявления и коррекции метаболического синдрома // Профилактика заболеваний и укрепление здоровья. – 2001. – Т. 4 (1). – С. 18–31.
7. Ройдберг Г.Е. Метаболический синдром. – М.: МЕД – пресс-информ, 2007. – 224 с.
8. Руяткина Л.А., Руяткин Д.С. Интегральный сердечно-сосудистый риск: метаболический синдром и дисфункция щитовидной железы // Сибирское медицинское обозрение. – 2010. – № 4 (64). – С. 11–16.
9. Borch–Johnsen K. The new classification of diabetes mellitus and IGT: a critical approach // Exp Clin Endocrinol Diabetes. – 2001. – Vol. 109. Suppl 2. – Р. 86–93.
10. Grundy S., Brewer H., Cleeman J. et al. For the Conference participants. Definition of metabolic syndrome. / Report of the National Heart, Lung, and Blood Institute / American Heart Association Conference on Scientific Issues Related to Definition. Circulation. – 2004. – Vol. 109. – P. 433–438.
Частота рака молочной железы имеет два пика – это 45–50 лет и свыше 55 лет, т.е. периоды перименопаузы и постменопаузы. Это в свое время послужило основанием для предположения о двух типах рака, соответствующих этим периодам. А различная реакция на эстрогены при этих двух типах рака молочной железы поставила вопрос: пременопаузальный и постменопаузальный рак – одна болезнь или две? И при таком разграничении неизбежно возникает другой вопрос: имеется ли два типа метаболического фона, на котором они возникают [4]? В 90-е годы ХХ столетия в онкологии прочно завоевала место концепция «метаболического синдрома», в истории формирования которой особую значимость имели исследования В.М. Дильмана и Я.В. Бохмана. Именно они впервые указали на тесную взаимосвязь метаболического синдрома, как маркера внегонадного стероидогенеза, и рака органов репродуктивной системы.
Вместе с тем конкретизация клинических и метаболических нарушений, как проявлений метаболического синдрома при раке органов репродуктивной системы, в настоящее временя не завершена.
К сегодняшнему моменту нет единого мнения о первопричине возникновения метаболического синдрома – является ли это состояние предопределенным генетически или развивается исключительно вследствие воздействия факторов внешней среды [6].
Ряд исследователей полагает, что развитие метаболического синдрома обусловлено существованием одного или группы взаимодействующих между собой генов, которые могут одновременно стимулировать развитие всех компонентов синдрома [2]. Общепринятой считается патогенетическая модель, принятая в 1999 году на симпозиуме, посвященном метаболического синдрому, одновременно учитывающая и влияние генетических факторов (олиго- и полигенное) и воздействие среды [9]. Комплекс причин: генетические дефекты, средовые влияния – в итоге реализуется в развитии ключевого патогенеза метаболического синдрома, причиной которого, наряду с перечисленными факторами, могут быть гормональные и метаболические нарушения [7].
В процессе старения в организме закономерно происходит увеличение содержания жира вне зависимости от того, наблюдается или не наблюдается увеличение массы тела. Возрастное ожирение связано не только и не столько с нарушением регуляции аппетита, сколько с существенными нарушениями в энергетическом обмене, которые и создают условия для повышенного накопления жира даже при сбалансированном по калорийности питании. В результате регуляторный тип ожирения дополняется метаболическим типом ожирения. Этот процесс имеет фундаментальное значение не только для механизма формирования ожирения, но и детерминированных с ним болезней. С точки зрения гормонзависимых опухолей, какими считается рак молочной железы, особую значимость приобретает феномен увеличения при ожирении биотрансформации андростендиона в эстрон. Таким образом, увеличение индекса массы тела в постменопаузе становится фактором риска чрезмерной продукции эстрона, а отсюда и такого метаболита, как 16а-гидроксиэстрон [1].
Очевидно одно, формируется убедительная точка зрения в отношении возрастающего онкологического риска у женщин постменопаузального периода в связи с метаболическим синдромом.
Мы не встретили исследований, посвященных изучению показателей, формирующих метаболический синдром, конкретно у женщин постменопаузального или перименопаузального возраста. А это, с нашей точки зрения, актуально для выяснения патогенеза гиперпластических процессов в органах женской репродуктивной системы.
Целью настоящей работы явилось изучение некоторых параметров организма, характеризующих метаболический синдром, у больных раком молочной железы в самостоятельном варианте и при сочетании с миомой матки.
Материалы и методы исследования
Контрольную группу составили 37 больных раком молочной железы. Медиана возраста составила 58,3 ± 1,8. Основную группу составили 36 женщин, имеющих сочетанную патологию: рак молочной железы и сопутствующую миому матки. Медиана возраста в основной группе составила 52,3 ± 2,1. У 24 больных контрольной группы и 25 женщин основной установлена II (А и В) стадия рака молочной железы, III А стадию рака имели соответственно 13 и 11 больных. В качестве группы сравнения была обследована 21 условно здоровая женщина соответствующей возрастной группы.
Содержание глюкозы, общего холестерина (ОХС), холестерина липопротеинов высокой плотности (ХС-ЛПВП) и триглицеридов (ТГ) в сыворотке крови, полученной натощак после 14-часового голодания, определяли ферментативным методом с помощью стандартных наборов «Ольвекс-диагностикум (С.-Петербург). Расчетным путем вычисляли концентрацию холестерина липопротеидов низкой плотности (ХС-ЛПНП) по формуле
ХС-ЛПНП (ммоль/л) = ОХС – (ТГ: 2,2 + + ХС-ЛПВП).
Инсулин определяли с помощью ИФА. Индекс массы тела рассчитывали по формуле: вес в кг, деленный на квадрат роста в м.
Статистический анализ результатов проводили с помощью пакета Statistica (версия 8). Оценка достоверности произведена с использованием t-критерия Стьюдента. Уровень Р < 0,05 принимали как значимый.
Результаты исследования и их обсуждение
Результаты некоторых антропометрических данных больных контрольной и основной групп представлены в табл. 1.
Найдено, что в контрольной группе 23 больных (62,2 %) имели повышенный на 39,4 % относительно показателя у здоровых доноров индекс массы тела, и только у 14 (37,8 %) больных этот показатель находился в пределах возрастной нормы. При изучении показателя отношения объема талии и бедер (ОТ/ОБ), который у этих больных превышал нормативные значения на 26,7 %, было установлено, что женщины страдали абдоминальным (висцеральным) типом ожирения. У 26 (70,3 %) больных имело место наличие артериальной гипертензии, причем у 11 больных этот диагноз был зафиксирован в истории болезни, а 15 женщин к врачу по этому поводу не обращались и лечение проводили периодически самостоятельно.
В отличие от больных контрольной группы, 32 (88,9 %) женщины с сочетанной патологией (рак молочной железы и миома матки) имели антропометрические показатели, не выходящие за пределы нормативных показателей. Только у 4 (11,1 %) больных индекс массы тела превышал значения здоровых доноров на 23,9 %.
Соотношение объема талии и бедер (ОТ/ОБ), которое у этих больных превышало нормативные значения лишь на 13,3 %, не могло свидетельствовать об абдоминальном (висцеральном) типе ожирения у этих женщин. В данном случае могла идти речь только об ожирении 2 степени.
Наличие нестойкой артериальной гипертензии зафиксировано у 12 (33,3 %) из обследованных больных основной группы, которое связывали с возникновением перименопаузы. Женщины отмечали периодические подъемы давления, часто связываемые с изменением погоды или стрессорным состоянием. Однако ни одна из этих больных основной группы не состояла на учете у терапевта по поводу гипертонии.
Результаты изучения липидного спектра сыворотки крови больных представлены в табл. 2.
Оказалось, что у всех женщин контрольной группы имело место нарушение липидного обмена. Так, уровень общего холестерина в крови больных раком молочной железы при самостоятельном варианте развития был повышен на 34,9 %, триглицеридов – на 38,5 %, уровень липопротеидов низкой плотности – 37 % при уменьшении на 43,8 % содержания в крови липопротеидов высокой плотности. Уровень глюкозы у этих больных натощак превышал верхнюю границу нормы у 27 из 37 (73 %) больных раком молочной железы. Содержание инсулина в крови натощак было повышено у 22 (59,5 %) больных контрольной группы. Вместе с тем диагноз сахарного диабета был зафиксирован в истории болезни только у 9 (24,3 %) из обследованных женщин.
Ни у одной из обследованных больных основной группы не обнаружено состояния дислипидемии, а также толерантности к глюкозе и инсулинорезистентности (табл. 2).
Таблица 1
Антропометрическая характеристика больных и показатели артериального давления
Группы | ИМТ (кг/м2) | ОТ (см) | ОБ (см) | ОТ/ОБ | АД сист. (мм рт.ст.) | АД диаст. (мм рт.ст.) |
Здоровые доноры (n = 21) | 26,4 ± 0,8 | 85,4 ± 1,6 | 112,7 ± 2,4 | 0,75 ± 0,06 | 121,1 ± 1,4 | 78,3 ± 2,2 |
Больные контрольной группы (n = 37) | 36,8 ± 3,71 (n = 23) 26,6 ± 1,2 (n = 14) | 121,6 ± 4,71 (n = 23) 87,5 ± 2,1 (n = 14) | 134,1 ± 2,71 (n = 23) 110,1 ± 1,4 (n = 14) | 0,95 ± 0,041 (n = 23) 0,79 ± 0,03 (n = 14) | 162,2 ± 10,3 (n = 26) 120,9 ± 10,3 (n = 11) | 97,8 ± 4,1 (n = 26) 85,5 ± 7,2 (n = 11) |
Больные основной группы (n = 36) | 32,7 ± 2,51 (n = 4) 25,2 ± 2,1 (n = 32) | 109,3 ± 1,91 (n = 4) 84,7 ± 2,3 (n = 14) | 127,1 ± 1,81 (n = 4) 114,2 ± 1,5 (n = 32) | 0,85 ± 0,061 (n = 4) 0,74 ± 0,1 (n = 32) | 142,2 ± 7,5 (n = 12) 121,1 ± 8,3 (n = 24) | 90,8 ± 5,1 (n = 12) 78,5 ± 7,2 (n = 24) |
Примечание. 1 – достоверно по отношению к группе здоровых доноров (Р < 0,05); ИМТ – индекс массы тела; ОТ – объем талии; ОБ – объем бедер.
Таблица 2
Показатели липидного спектра крови и уровня глюкозы у больных контрольной и основной групп
Группы | ОХС (ммоль/л) | ТГ (ммоль/л) | ЛПНП (ммоль/л) | ЛПВП (ммоль/л) | Глюкоза натощак (ммоль/л) | Инсулин натощак (ммоль/л) |
Здоровые доноры | 4,3 ± 0,2 | 1,3 ± 0,1 | 2,7 ± 0,1 | 1,6 ± 0,08 | 4,5 ± 0,3 | 5,2 ± 0,4 |
Больные контрольной группы | 5,8 ± 0,21 | 1,8 ± 0,11 | 3,7 ± 0,21 | 0,9 ± 0,061 | 6,4 ± 0,21 (n = 27) | 12,7 ± 2,31 (n = 22) |
Больные основной группы | 4,1 ± 0,2 | 1,4 ± 0,1 | 2,6 ± 0,2 | 1,7 ± 0,05 | 3,5 ± 0,3 | 6,1 ± 0,5 |
Примечание. 1 – достоверно по отношению к группе здоровых доноров (Р < 0,05); ОХС – общий холестерин сыворотки крови; ТГ – триглицериды; ЛПНП – липопротеиды низкой плотности; ЛПВП – липопротеиды высокой плотности.
Заключение
Совокупность выявленных нарушений липидного обмена у большинства женщин контрольной группы, абдоминальное ожирение, повышенный уровень натощак глюкозы и инсулина, свидетельствующий о наличии инсулинорезистентности, сочетание соматической патологии с преобладанием артериальной гипертензии и ишемической болезни сердца позволили нам сделать вывод о наличии практически у 23 больных раком молочной железы признаков метаболического синдрома.
Метаболический синдром определяется как комплекс метаболических, гормональных и клинических нарушений, являющихся факторами риска развития сердечно-сосудистых заболеваний [5]. Кроме того, у больных с метаболическим синдромом отмечают предрасположенность к развитию ряда других состояний, включая сахарный диабет 2 типа и некоторые формы рака [10]. Практически все составляющие метаболического синдрома: абдоминально-висцеральное ожирение, дислипидемия, нарушение толерантности к глюкозе, атеросклероз/ишемическая болезнь сердца (ИБС), нарушение гемостаза, микроальбуминурия, гиперандрогения – являются установленными факторами риска развития этих заболеваний [3]. Всероссийским научным обществом кардиологов для диагностики метаболического синдрома были приняты критерии американской программы Adult Treatment Panel III (ATP III) [7]. Согласно этому документу для установления диагноза метаболического синдрома необходимо наличие трех или более из шести нижеследующих критериев:
– гипергликемия натощак: уровень глюкозы натощак ≥ 6,1 ммоль/л;
– абдоминальное ожирение: ОТ > 102 см для мужчин и >88 см для женщин;
– гипертриглицеридемия: уровень ТГ плазмы крови ≥ 1,7 ммоль/л;
– низкий уровень холестерина ЛПВП < < 1,04 ммоль/л для мужчин и <1,3 ммоль/л для женщин;
– АД ≥ 130/85 мм рт. ст.
– инсулинорезистентность.
Таким образом, на основании нашего исследования можно выделить пять компонентов, входящих в состав метаболического синдрома, являющихся фоном развития рака молочной железы и, вероятно, связанных с повышенным риском развития рака молочной железы у постменопаузальных больных контрольной группы. Вместе с тем мы не обнаружили ни одного из указанных факторов у больных основной группы, большинство из которых находилось в состоянии перименопаузы.
Являются ли полученные нами результаты ответом на вопрос: пременопаузальный и постменопаузальный рак – одна болезнь или две? На первый взгляд, естественно, являются, так как выявлены принципиальные отличия метаболического фона. С другой стороны, наличие метаболического синдрома у большинства женщин контрольной группы и отсутствие признаков такового у больных основной группы может свидетельствовать о наличии двух типов метаболического фона, на котором возникает самостоятельно развивающийся рак молочной железы и рак молочной железы в сочетании с гиперпластическим процессом в матке.
Очевидно, с позиций приведенных показателей нецелесообразно делать серьезные выводы, так как понятие метаболического синдрома включает значительно более широкий спектр составляющих [8].
Рецензенты:
Непомнящая Е.М., д.м.н., профессор, главный научный сотрудник лаборатории иммунофенотипирования опухолей, ФГБУ «Ростовский научно-исследовательский онкологический институт» М3 РФ, г. Ростов-на-Дону;
Шихлярова А.И., д.б.н., профессор, зав. лабораторией изыскания новых противоопухолевых средств, ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России, г. Ростов-на-Дону.
Библиографическая ссылка
Франциянц Е.М., Верескунова М.И., Кечеджиева Э.Э., Кечеджиева С.М., Черярина Н.Д. ПРОЯВЛЕНИЯ МЕТАБОЛИЧЕСКОГО СИНДРОМА У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ СОЧЕТАНИИ С МИОМОЙ МАТКИ // Фундаментальные исследования. – 2015. – № 7-1. – С. 57-60;
URL: https://fundamental-research.ru/ru/article/view?id=38725 (дата обращения: 21.10.2020).
Предлагаем вашему вниманию жу?
