Миотонический синдром у детей код по мкб
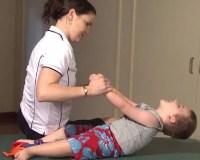
Миотонический синдром у детей — это нервно-мышечная патология, для которой характерна затрудненная релаксация мускулатуры после ее напряжения. Встречается при наследственных генетических дефектах либо как проявление неврологических, эндокринных, метаболических, аутоиммунных заболеваний. Синдром характеризуется нарушениями двигательной активности, асимметрией мышц, задержкой психомоторного развития. Для диагностики необходим неврологический осмотр, инструментальные методы (ЭМГ, МРТ) и генетическое обследование. Лечение миотонии симптоматическое с применением физиотерапии, ЛФК и массажа, психолого-педагогической коррекции.
Общие сведения
Частота встречаемости наследственных форм миотонического синдрома (МС) варьирует от 14 до 23 случаев на 100 тыс. детского населения. В отношении приобретенных вариантов статистических данных нет, поскольку в таких случаях патология не регистрируется как самостоятельная нозологическая единица и входит в структуру других неврологических болезней. Актуальность проблемы в педиатрической практике заключается в прогрессирующем течении заболевания, невозможности назначить этиотропное лечение и значительном ухудшении качества жизни детей при наследственных видах патологии.

Миотонический синдром у детей
Причины
В детском возрасте манифестируют врожденные формы, которые передаются преимущественно по аутосомно-доминантному, реже — аутосомно-рецессивному типу (синдром Шварца-Джампела, в части случаев — болезнь Томпсона). Самая частая форма наследственного МС — миотоническая дистрофия Россолимо-Штейнерта-Баттена-Куршмана, которая составляет до 97% всех генетических миотоний и связана с мутацией гена DMPK на 19-й хромосоме. Реже это заболевание обусловлено генетическими дефектами в 3-й (3q21) и 15-й (15q21-q24) хромосомах.
Вторичным миотоническим синдромом могут сопровождаться:
- родовые травмы с церебральными повреждениями;
- тяжелые формы перинатальной энцефалопатии;
- органические поражения ЦНС (опухоли, последствия перенесенных энцефалитов, ЧМТ);
- врожденные и воспалительные миопатии;
- миоплегии (болезнь Гамсторпа, периодический паралич);
- дефицитные состояния (рахит);
- эндокринные и метаболические расстройства (микседема, гипофункция паращитовидных желез, гиперкалиемия);
- аутоиммунные нарушения (приобретенная нейромиотония);
- длительное лечение клофибратом, калийсберегающими диуретиками, препаратами калия.
Патогенез
В механизме развития заболевания ведущим является нарушение процесса расслабления мышцы в результате метаболического или ионного дисбаланса. При этом изменяются свойства мембран миоцитов, происходит их усиленная деполяризация и повышение возбудимости. При совершении определенного действия с участием мускулатуры миофибриллы долго не могут расслабиться и вернуться в исходное положение, вследствие чего и возникает феномен миотонической задержки.
Лучше всего изучен патогенез дистрофической миотонии 1 типа, связанной с нарушениями на уровне экспрессии нуклеотидного повтора CTG. У детей изменяется концентрация миотонин-протеинкиназы DMPK, которая присутствует в скелетной мускулатуре, миокарде и ЦНС. В редких случаях клинические проявления обусловлены дисфункцией ионных каналов клеточных мембран, которая отмечается при аутоиммунных нарушениях.
Симптомы
Главный признак миотонического синдрома — скованность мышечных групп в конце движения. Это проверяется с помощью симптома «кулака»: после сжатия пальцев ребенок несколько секунд не может разжать кулак, и для этого ему нужно прилагать много усилий. Синдром характеризуется затруднениями жевания, неспособностью быстро открыть глаза после зажмуривания. Для наследственных форм МС у детей типично усиление симптоматики при целенаправленных движениях, в холодное время года.
При врожденных формах миотонического синдрома возможно асимметричное развитие мускулатуры. Если патология проявляется с первых месяцев жизни, родители замечают, что ребенок не способен удерживать голову, слабо сосет грудь, у него хуже сформированы рефлексы. Для грудничков с миотоническим синдромом характерно запоздалое становление моторики. В раннем детстве наблюдается повышенная утомляемость малыша, отсутствие интереса к активным играм, отставание в физическом развитии.
На поздних стадиях заболевания у детей происходит атрофия мышц, поэтому типичные признаки миотонического синдрома ослабевают, а потом исчезают. В клинической картине преобладает выраженная мышечная слабость, особенно в дистальных мышцах конечностей. Это обуславливает изменение походки, приводит к появлению вялых парезов и параличей. Поражение лицевых мышц проявляется постоянно «печальным» выражением лица и бедностью мимики.
Осложнения
Врожденные миотонические синдромы относят к мультисистемным поражениям, поэтому у таких детей зачастую диагностируют сопутствующие сердечно-сосудистые, неврологические и эндокринные нарушения. Особую опасность представляет нарушение иннервации дыхательной мускулатуры, из-за чего у пациентов нарастать дыхательная недостаточность вплоть до асфиксии. Церебральные симптомы, как правило, сочетаются с когнитивными нарушениями.
Лечение наследственных разновидностей миотонического синдрома затруднено, поэтому нередки летальные исходы в молодом возрасте. До 80% смертей вызваны вторичной пневмонией на фоне аспирации пищи и нарушений глотания, жизнеугрожающими аритмиями, которые развиваются вследствие дегенерации проводящей системы сердца. У детей может возникать глубокая умственная отсталость, приводящая к инвалидности.
Диагностика
При физикальном осмотре детский невролог проверяет симптом «кулака», оценивает сохранность рефлексов, мышечную силу. На основании полного физикального осмотра специалисту удается поставить предварительный диагноз. Чтобы подтвердить наличие и выяснить причины миотонического синдрома, назначаются следующие диагностические исследования:
- Электромиография. Патогномоничный признак миотонии на ЭМГ — появление высокоамплитудных разрядов со звуковым феноменом при использовании игольчатых электродов. При прогрессировании болезни присутствуют симптомы миопатии: снижение амплитуды потенциалов, полифазные двигательные единицы.
- Биопсия мышц. На ранних стадиях в биоптате определяются неспецифические миопатические изменения: центрально расположенные ядра, уменьшение длины волокон, признаки денервации — наличие пикнотических ядерных глыбок и маленьких угловых мускульных волокон.
- Магнитно-резонансная томография. По результатам МРТ конечностей врач оценивает степень развития мускулатуры и замещения ее жировой тканью. Учитывая сопутствующее поражение ЦНС, рекомендована МРТ головного мозга для обнаружения структурных изменений белого вещества и желудочков.
- Генетическая диагностика. Исследование генома для выявления типичной мутации — «золотой стандарт» для постановки диагноза врожденных вариантов миотонического синдрома у детей. По показаниям можно проводить тестирование в антенатальном периоде, если в семьях родителей были случаи миотонии.
Лечение миотонического синдрома у детей
Консервативная терапия
Этиопатогенетическое лечение миотонического синдрома пока не разработано, поэтому в детской неврологии ограничиваются симптоматическими средствами. Медикаменты подбираются с учетом конкретной ситуации и выраженности патологических изменений. Для замедления прогрессирования проводится лечение противосудорожными средствами и миорелаксантами, для подавления аутоиммунных реакций назначают глюкокортикоиды.
Решающее значение в терапевтической схеме отводится упражнениям ЛФК, которые укрепляют мышечный корсет, помогают сбалансировать развитие разных групп мышц, что улучшает качество жизни больных детей. Показано физиотерапевтическое лечение в виде электрофореза с кальцием, электростимуляции мышц, бальнеотерапии. Для уменьшения миотонического синдрома полезен массаж.
Реабилитация
Учитывая серьезные двигательные нарушения, лечение дополняется регулярными занятиями в реабилитационных центрах с использованием тренажеров и индивидуальных методик. Нарушения артикуляции у детей корректируются занятиями с логопедом. При задержке умственного развития ребенку может потребоваться помощь олигофренопедагога либо обучение в специализированной школе.
Прогноз и профилактика
Если вовремя начать лечение, при приобретенных формах удается восстановить мышечную активность. Наследственный миотонический синдром отличаются сомнительным прогнозом. Средняя продолжительность жизни пациентов составляет 35 лет при раннем дебюте болезни. Специфические меры профилактики миотонического синдрома не разработаны. Семьям с отягощенным анамнезом требуется медико-генетическое консультирование.
Источник
Рубрика МКБ-10: G71.1
МКБ-10 / G00-G99 КЛАСС VI Болезни нервной системы / G70-G73 Болезни нервно-мышечного синапса и мышц / G71 Первичные поражения мышц
Определение и общие сведения[править]
Миотонии – группа наследственных заболеваний, проявляющихся замедленным расслаблением мышц и относящихся к каналопатиям (заболеваниям, связанным с патологией ионных каналов). Типичные признаки миотонии – миотонические феномены и миотонические разряды, выявляемые при клиническом обследовании и игольчатой ЭМГ соответственно.
Эпидемиология
Наиболее распространена миотоническая дистрофия Штейнерта (2,1-13,5 случая на 100 000), реже наблюдают миотонии Томсена и Беккера. Нейромиотония Исаакса, синдром Шварца-Ямпеля и парамиотония Эйленбурга относятся к редким заболеваниям.
Классификация
Наиболее известны следующие формы миотоний (в скобках приведены синонимы и коды OMIM).
• Миотоническая дистрофия (Штейнерта-Куршмана-Баттена-Россолимо):
– тип 1 (160900);
– тип 2 (602668).
• Конгенитальная аутосомно-доминантная миотония (Томсена, 160800).
• Конгенитальная аутосомно-рецессивная миотония (Беккера, 255700).
• Парамиотония Эйленбурга (168300).
• Нейромиотония (синдром Исаакса).
• Хондродистрофическая миотония (синдром Шварца-Ямпеля, 255800).
Этиология и патогенез[править]
Выделяют три типа дистрофической миотонии, наиболее частый (98% случаев) из них – тип 1, ген которого картирован в локусе 19q13. Все три типа дистрофической миотонии имеют аутосомно-доминантный тип наследования с различной пенетрантностью.
Дистрофическая миотония типа 1 связана с увеличением количества тринуклеотидных повторов CTG (которое может достигать нескольких тысяч) в гене DMPK. Тяжесть заболевания зависит от количества тринуклеотидных повторов. Ген DMPK кодирует миотонин-протеинкиназу. Этот белок присутствует не только в скелетных, но и в сердечной мышце и цНс, что и обусловливает основные клинические проявления дистрофической миотонии (поражение скелетных мышц, нарушение проводимости сердца, легкое снижение интеллекта).
Врожденная миотония Томсена также наследуется по аутосомно-доминантному типу. Схожую клиническую картину имеет ее аллельная аутосомно-рецессивная форма – миотония Беккера. Врожденная миотония связана с патологией хлорных каналов, ген CLCN1 локализован в локусе 7q35. Вследствие изменения структуры белка, кодируемого этим геном, нарушается проникновение хлора в мышечную клетку, что приводит к замедлению расслабления мышечного волокна и нестабильности мембраны.
Парамиотония Эйленбурга связана с патологией натриевых каналов, имеет аутосомно-доминантный тип наследования. Ген SCN4A картирован в локусе 17q35. Механизмы формирования парамиотонических проявлений связаны с повышенной возбудимостью мембраны мышечных волокон и нарушением функционирования сократительных элементов мышцы.
Большинство нейромиотоний – приобретенные заболевания, но одна из форм является наследственной. Наиболее часто наблюдают идиопатическую нейромиотонию (синдром Исаакса). Часть случаев нейромиотонии имеет паранеопластическую этиологию (в частности, нейромиотония описана при тимоме, легочной карциноме, плазмацитоме, лимфоме Ходжкина и т.д.).
Установлено, что заболевание имеет неврогенную природу, так как введение кураре купирует мышечные спазмы. Тем не менее патогенез нейромиотонии остается неясным до сих пор. Выявление повышенного титра антител к потенциал-зависимым калиевым каналам позволило считать приобретенный синдром Исаакса аутоиммунным заболеванием. Аутоиммунный характер приобретенной нейромиотонии подтверждается также наблюдаемой в ряде случаев эффективностью плазмафереза.
Клинические проявления[править]
Классический клинический тест на выявление миотонии – симптом «кулака»: больной не в состоянии быстро разжать крепко сжатый кулак, вместо этого он разжимает кулак медленно и с усилием, как при замедленной киносъемке. При повторных попытках миотонический феномен угасает. Исключение составляет парамиотония Эйленбурга, при которой, наоборот, скованность усиливается при повторных движениях.
Трудности для больного могут возникать при разжимании сжатых челюстей, попытке быстро встать со стула, быстро открыть зажмуренные глаза. Перед подъемом по лестнице больной «замирает» (время на расслабление мышц), подъем на первую ступеньку для него представляет большую трудность, чем дальнейший подъем. При перкуссии мышцы возникает «мышечный валик», исчезающий через несколько секунд. Наиболее характерный для миотонии феномен выявляют при игольчатой ЭМГ. При введении и перемещении игольчатого электрода возникают миотонические разряды с характерным звуком «пикирующего бомбардировщика».
Миотонические феномены фактически патогномоничны, в связи с этим диагностика миотонии не представляет особой сложности. Вместе с тем нередко больные не могут адекватно описать свое состояние и жалуются на трудности при подъеме по лестнице, вставании со стула, которые интерпретируют как проксимальную мышечную слабость, что и приводит к ошибочной диагностике миопатии, миастении, полимиозита и др.
Отличительная клиническая особенность врожденной миотонии – гипертрофия отдельных мышечных групп, создающая впечатление об атлетическом телосложении больного. Как правило, при миотонии Томсена миотонические феномены выражены более ярко, чем при дистрофической. Мышечная сила у большинства больных остается сохранной, но может быть и снижена, особенно в дистальных мышцах рук.
Дистрофическая миотония характеризуется сочетанием миотонических феноменов, мышечной слабости и атрофий. В клинической картине дистрофической миотонии типа 1 сочетаются миотонические феномены (симптом «кулака»; симптом «валика» при перкуссии мышц, языка; миотоническая задержка при открывании глаз и рта) и миопатические черты (преимущественно дистальная мышечная слабость с постепенно прогрессирующими мышечными атрофиями и частым развитием степпажа). Лицо многих больных приобретает характерное выражение, получившее название facies myotonica (гипомимия, «скорбное» выражение, частичный птоз, атрофии височных и жевательных мышц, лобно-височное облысение). Миотонические феномены выражены слабее, чем при врожденной миотонии. Дистрофическая миотония типа 2 характеризуется сочетанием проксимальной мышечной слабости и слабости дистальных мышц рук при относительной сохранности мышц лица и дистальных отделов ног. Кардиомиопатия обычно отсутствует.
Дистрофическая миотония – мультисистемное заболевание. Кроме нервно-мышечных симптомов, у большинства больных наблюдают сердечную патологию (аритмии, гипертрофию левого желудочка и др.), церебральные симптомы (когнитивные нарушения или невысокий уровень интеллекта, гиперсомнию), эндокринные расстройства (у мужчин часто наблюдают гипогонадизм, импотенцию, у женщин – нарушения менструального цикла). Катаракту выявляют у 90% больных, она может быть единственным клиническим признаком заболевания. Для дистрофической миотонии характерен феномен антиципации (т.е. усиление симптоматики в последующих поколениях, поэтому изолированную катаракту часто обнаруживают при обследовании родителей пациента).
Парамиотония Эйленбурга отличается возникновением миотонических реакций, мышечного спазма и пареза на холоде (холодовая миотония). Приступ холодовой миотонии может длиться несколько минут или часов, затем проходит, и в межприступный период никаких симптомов не отмечают. При других миотониях также возможно усиление миотонических феноменов на холоде, но и в тепле они полностью не исчезают. Еще одним важным отличием этого заболевания от миотонии Томсена является пародоксальная реакция на повторные физические упражнения: при миотонии Томсена миотонические феномены при повторении движения уменьшаются, а при парамиотонии, наоборот, усиливаются.
Нейромиотонии – группа заболеваний, связанных с нарушением возбудимости периферических нервов, проявляющимся мышечной скованностью, спазмами (крампи) и постоянной мышечной активностью на ЭМГ. Мышечные спазмы при нейромиотонии, как правило, безболезненны и сопровождаются ЭМГ-признаками, характерными для произвольного напряжения мышцы, но, в отличие от последнего, больные не могут расслабить напряженную мышцу. Характерно сочетание генерализованных миокимий и миотонической задержки движений (симптом «кулака» и др.), в то же время перкуторные миотонические феномены отсутствуют.
Миотонические расстройства: Диагностика[править]
Анамнез
Дистрофическая миотония типа 1 чаще дебютирует в юношеском либо взрослом возрасте (хотя возможны и конгенитальные формы), тяжесть состояния и степень прогрессирования зависят от генетического дефекта (коррелируют с количеством тринуклеотидных повторов). При тщательном сборе семейного анамнеза часто удается выявить отдельные симптомы в старших поколениях (изолированная катаракта, птоз или легкая слабость мимических мышц). Миотония Томсена может дебютировать как в детском, так и во взрослом возрасте, течение заболевания медленное. Миотония Беккера начинается в 4-12 лет и имеет более тяжелое течение, чем миотония Томсена.
Физикальное обследование
Основной диагностический признак миотонии – миотонический феномен. Атлетическое или нормальное телосложение, отсутствие мышечной слабости характерны для врожденных миотоний (Томсена и Беккера), нейромиотонии. При дистрофической миотонии выявляют снижение силы и атрофии мышц, чаще умеренные и симметричные. При дистрофической миотонии типа 1 мышечная слабость имеет дистальное распределение, при дистрофической миотонии типа 2 – проксимальное. Сухожильные рефлексы при дистрофической миотонии могут отсутствовать, при врожденной миотонии наблюдают миотонический феномен – замедленное возвращение голени в исходное положение после вызывания коленного рефлекса.
Лабораторные исследования
При дистрофической миотонии может быть незначительно повышена активность КФК в крови. При нейромиотонии выявляют антитела к потенциал-зависимым калиевым каналам (в 50% случаев). Титр антител снижается на фоне лечения.
Инструментальные исследования
Игольчатая ЭМГ – основной инструментальный метод диагностики миотоний. Миотонические разряды – патогномоничный признак миотонии. При врожденной миотонии параметры ДЕ остаются в пределах нормы, при дистрофической миотонии выявляют сочетание миопатических и невропатических черт; спонтанная активность, помимо миотонических разрядов, представлена потенциалами фибрилляций, положительными острыми волнами.
У больных с парамиотонией в покое вне охлаждения регистрируют нормальные ПДЕ и редкие миотонические разряды. После произвольного сокращения мышцы возникает ее напряжение или мышечная судорога, вслед за которой возникает парез. В период напряжения наблюдают миотонические разряды, в период пареза – отсутствие как спонтанной, так и произвольной активности, а также отсутствие (или резкое снижение) вызванных электрического и механического ответов мышцы. Для диагностики парамиотонии проводят холодовую пробу: при незначительном охлаждении конечности появляются миотонические разряды, при дальнейшем охлаждении исчезают как миотонические феномены, так и ПДЕ (наступает «биоэлектрическое молчание»).
При нейромиотонии исследование игольчатыми электродами в покое выявляет постоянную активность ДЕ. Регистрируются также дуплеты, триплеты ПДЕ, миокимические разряды, разряды высокой частоты. На фоне терапии карбамазепином активность ДЕ снижается. С помощью иммуносупрессивной терапии иногда удается достичь ремиссии, в этом случае спонтанная активность отсутствует либо активность ДЕ минимальна.
ДНК-диагностика
ДНК-диагностика дистрофической миотонии основана на выявлении повышенного количества CTG-повторов в гене DMPK.
Дифференциальный диагноз[править]
Дифференциальную диагностику проводят в два этапа: выявляют миотонические феномены (клинически и при ЭМГ) и устанавливают формы миотонии.
Игольчатая ЭМГ выявляет патогномоничные миотонические разряды, которые следует отличать от псевдомиотонических, наблюдаемых при различной патологии (полимиозите, мышечных заболеваниях). Амплитуда миотонического разряда уменьшается к концу разряда, в то время как амплитуда псевдомиотонического разряда остается стабильной.
В типичных случаях дифференцировать дистрофическую и врожденную миотонию удается по клиническим данным. Тем не менее при врожденной миотонии в ряде случаев выявляют легкую слабость дистальных мышц рук и незначительную спонтанную активность при ЭМГ, что имитирует дистрофическую миотонию.
В пользу последней свидетельствуют полиорганность патологии, катаракта и нарушения ритма сердца, а также мимическая слабость или частичный птоз.
На холоде миотонические проявления усиливаются во всех случаях, заподозрить парамиотонию можно при эпизодах холодовых параличей и исчезновении скованности мышц в теплом помещении.
Схожую с нейромиотонией клиническую картину (постоянная мышечная активность) имеет синдром ригидного человека (stiff-man syndrome). В отличие от нейромиотонии, при синдроме ригидного человека мышечная активность уменьшается во сне, а также после введения диазепама.
Миотонические расстройства: Лечение[править]
Цель лечения при миотонии – снижение выраженности миотонических проявлений, при нейромиотонии – устранение постоянной мышечной активности и по возможности достижение ремиссии.
Немедикаментозное лечение
Диета с ограничением солей калия может уменьшить миотонические проявления. Следует избегать переохлаждения, так как холод усиливает любые миотонические реакции. При дистрофической миотонии показаны все немедикаментозные методы лечения ПМД (ЛФК, массаж и др.).
Медикаментозное лечение
Радикального лечения миотонии не существует. Для уменьшения выраженности миотонических проявлений используют фенитоин в дозе 200-400 мг/сут перорально. Курсы диуретиков (не калийсберегающих) позволяют снизить уровень калия в крови и уменьшить миотонические проявления.
Нейромиотонические проявления уменьшаются при назначении карбамазепина. Ремиссии иногда удается достичь с помощью иммуносупрессивной терапии преднизолон по 1 мг/(кгхсут) через день, плазмаферез, иммуноглобулин человеческий нормальный 400 мг/кг внутривенно, циклофосфамид].
Хирургическое лечение
При дистрофической миотонии иногда может потребоваться имплантация кардиостимулятора.
Прогноз
В целом прогноз для жизни при миотониях благоприятный, однако в связи с кардиальной патологией при дистрофической миотонии типа 1 возможна внезапная сердечная смерть. Прогноз для трудовой деятельности при врожденных миотониях благоприятный (с учетом рационального трудоустройства). При дистрофической миотонии может наступить инвалидизация на поздних стадиях заболевания. При идиопатической нейромиотонии прогноз для жизни благоприятный, при паранеопластических нейромиотониях прогноз зависит от основного заболевания.
Профилактика[править]
Прочее[править]
Ацетазоламид-чувствительная миотония
Синонимы: синдром миотонии и болезненных контрактур, болезненная врожденная миотония
Ацетазоламид-чувствительная миотония представляет собой форму калий-зависимой миотонии, которая демонстрирует резкое улучшение при назначении ацетазоламида.
Источники (ссылки)[править]
Неврология [Электронный ресурс] / Под ред. Е.И. Гусева, А.Н. Коновалова, А.Б. Гехт – М. : ГЭОТАР-Медиа, 2014. – https://www.rosmedlib.ru/book/ISBN9785970428900.html
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
- Клоназепам
Источник
