Неалкогольная жировая болезнь печени метаболический синдром
Дата публикации 23 июля 2018Обновлено 19 июля 2019
Определение болезни. Причины заболевания
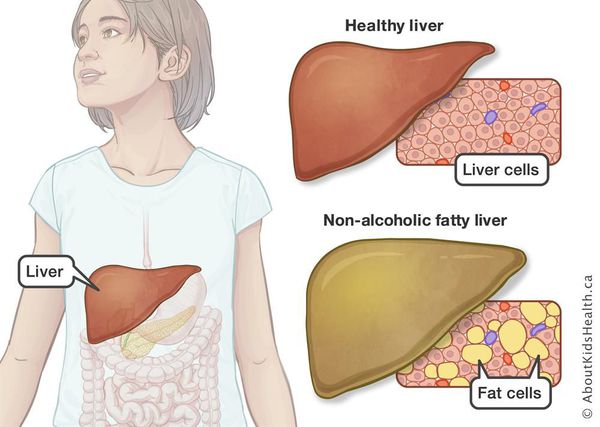
Неалкогольная жировая болезнь печени / НАЖБП (стеатоз печении или жировой гепатоз, неалкогольный стеатогепатит) — это неинфекционное структурное заболевание печени, характеризующееся изменением ткани паренхимы печени вследствие заполнения клеток печени (гепатоцитов) жиром (стеатоз печени), которое развивается из-за нарушения структуры мембран гепатоцитов, замедления и нарушения обменных и окислительных процессов внутри клетки печени.
Все эти изменения неуклонно приводят к:
- разрушению клеток печени (неалкогольный стеатогепатит);
- накоплению жировой и формированию фиброзной ткани, что вызывает уже необратимые, структурные (морфологические) изменения паренхимы печени;
- изменению биохимического состава крови;
- развитию метаболического синдрома (гипертоническая болезнь, ожирение, сахарный диабет);
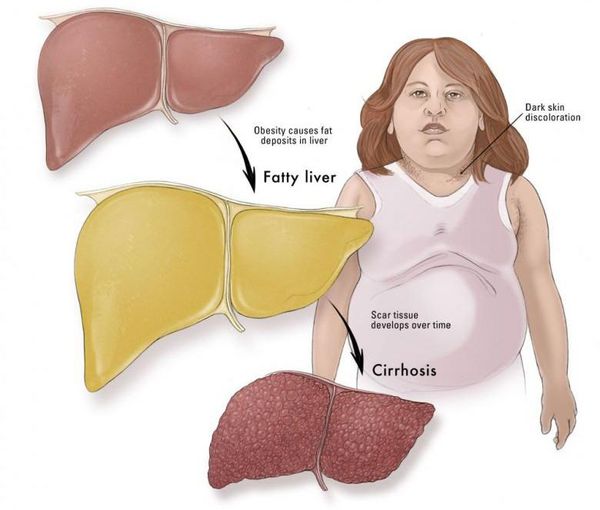
- в конечном итоге, циррозу.
Метаболический синдром — широко распространённое состояние, характеризующееся снижением биологического действия инсулина (инсулинорезистентность), нарушением углеводного обмена (сахарный диабет II типа), ожирением центрального типа с дисбалансом фракций жира (липопротеинов плазмы и триглицеридов) и артериальной гипертензией.[2][3][4]
В большинстве случаев НАЖБП развивается после 30 лет.[7]
Факторами риска данного заболевания являются:
- малоподвижный образ жизни (гиподинамия);
- неправильное питание, переедание;
- длительный приём лекарственных препаратов;
- избыточная масса тела и висцеральное ожирение;
- вредные привычки.
Основными причинам развития НАЖБП являются:[11]
- гормональные нарушения;
- нарушение жирового обмена (дисбаланс липопротеидов плазмы);
- нарушение углеводного обмена (сахарный диабет);
- артериальная гипертензия;
- ночная гипоксемия (синдром обструктивного апноэ сна).
При наличии гипертонической болезни, ожирения, сахарного диабета, регулярном приёме лекарств или в случае присутствия двух состояний из вышеперечисленных вероятность наличия НАЖБП достигает 90 %.[3]
Ожирение определяется по формуле вычисления индекса массы тела (ИМТ): ИМТ = вес (кг) : (рост (м))2. Если человек, например, весит 90 кг, а его рост — 167 см, то его ИМТ = 90 : (1,67х1,67) = 32,3. Этот резултат говорит об ожирении I степени.
- 16 и менее — выраженный дефицит массы;
- 16-17,9 — недостаточная масса тела;
- 18-24,9 — нормальный вес;
- 25-29,9 — избыточная масса тела (предожирение);
- 30-34,9 — ожирение I степени;
- 35-39,9 — ожирение II степени;
- 40 и более — ожирение III степени (морбидное).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы жирового гепатоза, неалкогольной жировой болезни печени (НАЖБП)
У большинства больных данное заболевание на ранних стадиях протекает бессимптомно — в этом и заключается большая опасность.
У 50-75% больных могут появляться симптомы общей (хронической) усталости, снижение работоспособности, недомогание, слабость, тяжесть в области правого подреберья, набор веса, длительное повышение температуры тела без всякой причины, красные точки на коже в области груди и живота. Печень часто увеличена. Возникают расстройства пищеварения, повышенное газообразование, кожный зуд, редко — желтуха, «печёночные знаки».
Часто НАЖБП сопутствуют заболевания желчного пузыря: хронический холецистит, желчнокаменная болезнь. Реже, в запущенных случаях, возникают признаки портальной гипертензии: увеличение селезёнки, варикозное расширение вен пищевода и асцит (скопление жидкости в брюшной полости). Как правило, данные симптомы наблюдаются на стадии цирроза печени.[7]
Патогенез жирового гепатоза, неалкогольной жировой болезни печени (НАЖБП)
К накоплению холестерина, а именно липидов (жироподобных органических соединений) в печени, приводят, прежде всего, следующие факторы:
- избыточное поступление свободных жирных кислот (FFA) в печень;
- усиленный синтез свободных жирных кислот печени;
- пониженный уровень бета-окисления свободных жирных кислот;
- снижение синтеза или секреции липопротеинов очень высокой плотности.[7]
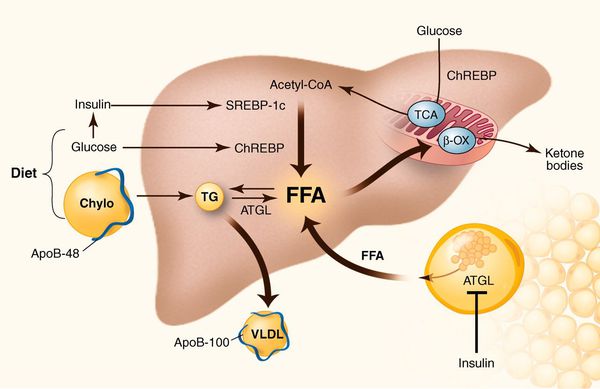
У пациентов с ожирением в ткани печени повышенно содержание свободных жирных кислот, что и может быть причиной нарушения функций печени, так как жирные кислоты химически активны и могут привести к повреждению биологических мембран гепатоцитов, образуя в них ворота для поступления в клетку эндогенного жира, в частности липидов (преимущественно низкой и очень низкой плотности), а транспортом является сложный эфир — триглицерид.[2]
Таким образом, гепатоциты заполняться жиром, и клетка становиться функционально неактивной, раздувается и увеличивается в размерах. При поражении более миллиона клеток макроскопически печень увеличивается в размерах, в участках жировой инфильтрации ткань печени становиться плотнее, и данные участки печени не выполняют своих функций либо выполняют их с существенными дефектами.
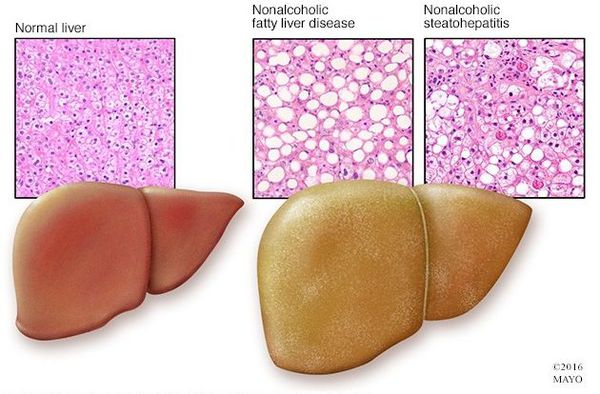
Перекисное окисление липидов в печени приводит к синтезу токсичных промежуточных продуктов, которые могут запускать процесс апоптоза (запрограммированной гибели) клетки, что может вызывать воспалительные процессы в печени и сформировать фиброз.[2]
Также важное патогенетическое значение в формировании НАЖБП имеет индукция цитохрома P-450 2E1 (CYP2E1), который может индуцироваться как кетонами, так и диетой с высоким содержанием жиров и низким содержанием углеводов.[7] CYP2E1 генерирует токсические свободные радикалы, приводящие к повреждению печени и последующему фиброзу.
Кроме того, патогенетическое значение в формировании НАЖБП имеет эндотоксин-опосредованное повреждение, которое, в свою очередь, усиливает выработку провоспалительных цитокинов (ФНО-α, ИЛ-6 и ИЛ-8), приводящих к нарушению целостности мембран гепатоцитов и даже к их некрозу[9], а также к развитию воспалительной клеточной инфильтрации как в портальных трактах, так и в дольках печени, что приводит к стеатогепатиту.
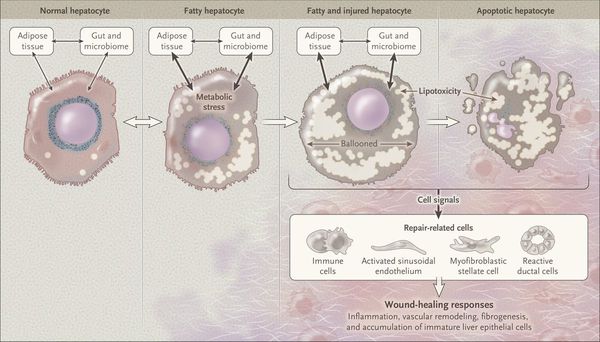
Продукты перекисного окисления липидов, некрозы гепатоцитов, ФНО и ИЛ-6 активируют стеллатные (Ito) клетки, вызывающие повреждение гепатоцитов и формирование фиброзных изменений.
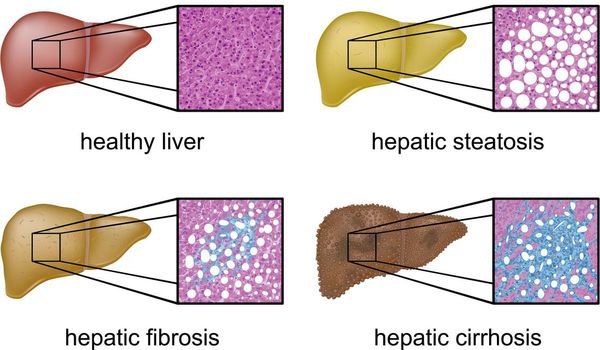
Классификация и стадии развития жирового гепатоза, неалкогольной жировой болезни печени (НАЖБП)
В настоящий момент общепринятой классификации НАЖБП не существует, однако ряд авторов выделяет стадии течения заболевания и степени неалкогольного стеатогепатита (НАСГ).
Оценка стеатоза печени и гистологической активности НАЖБП по системе E.M. Brunt:[9][10][11]
- I степень (мягкий НАСГ) — стеатоз крупнокапельный, не более 33-66% поражённых гепацитов;
- II степень (умеренный НАСГ) — крупно- и мелкокапельный, от 33% до 66% поражённых гепацитов;
- III степень (тяжелый НАСГ) — крупно- и мелкокапельный, больше 60% поражённых гепацитов.
Также можно условно разделить степени стеатоза, фиброза и некроза по результату теста ФиброМакс — степени выраженности жировой инфильтрации:
- S1 (до 33% жировой инфильтрации);
- S2 ( 33-60% жировой инфильтрации)
- S3 (более 60% жировой инфильтрации)
- F1,F2, F3, цирроз.
Осложнения жирового гепатоза, неалкогольной жировой болезни печени (НАЖБП)
Наиболее частые осложнения НАЖБП — это гепатит, замещение нормальной паренхиматозной ткани печени фиброзной — функционально нерабочей тканью с формированием в конечном итоге цирроза печени.
К более редкому осложнению, но всё же встречающемуся, можно отнести рак печени — гепатоцеллюлярную карциному.[9] Чаще всего она встречается на этапе цирроза печени и, как правило, ассоциируется с вирусными гепатитами.
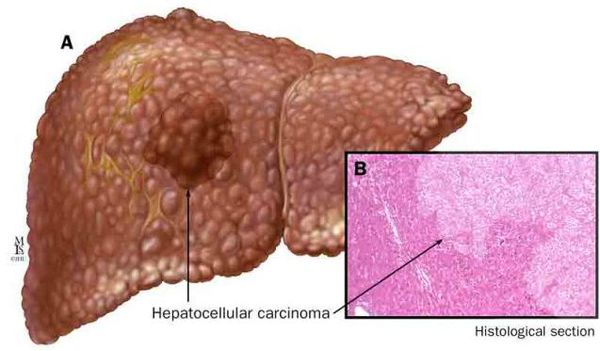
Диагностика жирового гепатоза, неалкогольной жировой болезни печени (НАЖБП)
В диагностике НАЖБП используются лабораторные и инструментальные методы исследования.
В первую очередь оценивается состояние печени на предмет воспалительных изменений, инфекционных, аутоиммунных и генетических заболеваний (в том числе болезней накопления) с помощью общеклинических, биохимических и специальных тестов.[7]
Далее проводится оценка выполняемых печенью функций (метаболическая/обменная, пищеварительная, детоксикационная) по способности выработки определённых белков, характеристикам жиров и углеводов. Детоксикационная функция печени оценивается преимущественно при помощи С13-метацетинового теста и некоторых биохимических тестов.
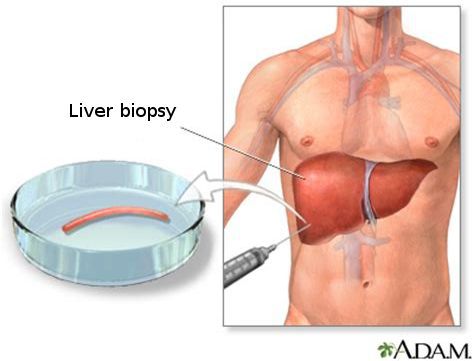
Кода первые два этапа завершены, исследуется структурное состояние печени при помощи УЗИ[4], МСКТ, МРТ и эластометрии (FibroScan), при необходимости исследуется морфологическое состояние — биопсия печени.[3]

С помощью эластометрии исследуется эластичность мягких тканей. Злокачественные опухоли отличаются от доброкачетсвенных повышенной плотностью, неэластичностью, они с трудом поддаются компрессии. На мониторе FibroScan более плотные ткани окрашены в голубой и синий цвет, жировая ткань — жёлто-красный, а соединительная ткань — зелёный. Высокая специфичность метода позволяет избежать необоснованных биопсий.
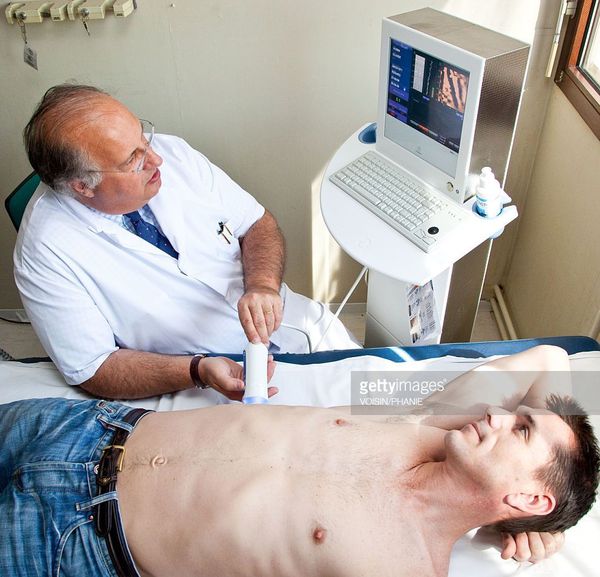
После проведённой диагностики, устанавливается окончательный диагноз и проводится соответствующее лечение.
Лечение жирового гепатоза, неалкогольной жировой болезни печени (НАЖБП)
С учётом механизма развития заболевания разработаны схемы курсового лечения НАЖБП, направленные на восстановление структуры клеточных мембран, обменных и окислительных процессов внутри клеток печени на молекулярном уровне, очистку печени от внутриклеточного и висцерального жира, который затрудняет её работу.
В процессе лечения производится:
- коррекция углеводного, жирового (липидного) обмена веществ;
- нормализация процессов окисления в клетке;
- влияние на основные факторы риска;
- снижение массы тела;
- улучшение структуры печени на обратимых стадиях.
После лечения наступает заметное улучшение дезинтоксикационной (защитной), пищеварительной и метаболической (синтетической) функции печени, пациенты теряют в весе, улучшается общее самочувствие, повышается умственная и физическая работоспособность.
Курсовые программы лечения занимают от трёх до шести месяцев и подбираются в зависимости от степени выраженности метаболических нарушений. К ним относятся:
- программа «Лайт»;
- программа «Медиум»;
- программа «Премиум»;
- индивидуальная программа лечения — разрабатывается на основании сопутствующих заболеваний, текущего состояния пациента и необходимой интенсивности лечения.
Программы включают в себя предварительное обследование, постановку диагноза и медикаментозное лечение, которое состоит из двух этапов:
- инфузионная терапия с пролонгацией приёма препаратов внутрь, подбор диеты и физической активности;
- сдача контрольных анализов и оценка результатов.
Прогноз. Профилактика
На ранних стадиях заболевания прогноз благоприятный.
Профилактика НАЖБП предполагает правильное питание, активный образ жизни и регулярную календарную диспансеризацию.
К правильному питанию можно отнести включение в свой рацион питания омега-3 полиненасыщенных жирных кислот, коротких углеводов, ограничение потребления приправ, очень жирной и жаренной пищи. Разнообразие рациона питания также является ключевым моментом полноценного питания. Показано потребление продуктов, богатых растительной клетчаткой.
Для активного образа жизни достаточно ходить пешком от 8 000 до 15 000 шагов в сутки и уделять три часа в неделю физическим упражнениям.
В отношении календарной диспансеризации следует ежегодно выполнять УЗИ органов брюшной полости и оценивать уровень своих печёночных ферментов (АЛТ, АСТ, общий билирубин), особенно при приёме каких-либо лекарственных препаратов на постоянной основе.
Источник
В последние годы пристальное внимание специалистов различных областей медицины привлекает метаболический синдром (синдром инсулинорезистентности) (МС) — симптомокомплекс, объединяющий различные метаболические нарушения и состояния, связанные с ожирением, едиными патогенетическими механизмами их развития, обусловленными инсулинорезистентностью (ИР). На сегодняшний день в него включены следующие компоненты: ИР с компенсаторной гиперинсулинемией (ГИ), сахарный диабет 2-го типа (СД 2-го типа) и другие нарушения толерантности к глюкозе, абдоминальное ожирение, артериальная гипертензия, атерогенная дислипидемия, неалкогольная жировая болезнь печени (НАЖБП), гиперурикемия, нарушения фибринолитической активности крови, гиперандрогения у девочек, микроальбуминурия, ночное апноэ и пр. [1, 2]. В связи с тем, что формирование МС начинается в детском возрасте задолго до клинической манифестации СД 2-го типа, заболеваний сердечно-сосудистой системы и долгое время протекает бессимптомно, МС признается актуальной педиатрической проблемой, а его частота в детском возрасте колеблется от 17,5% до 50% [3–7].
В настоящее время убедительное подтверждение получила точка зрения, согласно которой органы пищеварения играют непосредственную роль в патогенезе гормонально-метаболических нарушений, приводящих к развитию ожирения, ИР, атерогенной дислипидемии, при этом сами они становятся органами-мишенями [8–14]. Согласно последним научным исследованиям у взрослых практически каждый компонент МС сопровождается вторичным поражением печени по типу НАЖБП. Установлено, что если средняя распространенность НАЖБП составляет 23% и колеблется в интервале от 3% до 58%, то среди людей с избыточной массой тела она достигает 74–100% [11]. Распространенность заболевания в целом по России у взрослого населения составляет 27% с колебаниями от 20% на юге до 32% в Сибири, у 4,5% отмечаются признаки неалкогольного стеатогепатита (НАСГ) [15]. В детской популяции у детей с ожирением НАЖБП выявляется у 68%, а при наличии МС — у 84% детей [16]. Собственные данные свидетельствуют о том, что НАЖБП выявляется у 2/3 детей с МС (до 70%) [17, 21, 22].
Впервые в качестве самостоятельной нозологической единицы НАЖБП описал J. Ludwig в 1980 г. НАЖБП характеризуется накоплением жира в гепатоцитах при отсутствии злоупотребления алкоголем и включает в себя группу последовательных патогенетически связанных стадий поражения печени:
- стеатоз печени (жировая дистрофия печени) — состояние, характеризующееся накоплением жировых везикул в более чем 5% гепатоцитов;
- НАСГ — прогрессирующее заболевание печени, характеризующееся формированием стеатоза и воспаления, приводящее к повреждению гепатоцитов, развитию фиброза с возможностью прогрессирования с исходом в цирроз.
Современная модель патогенеза НАЖБП — это теория «двух ударов». Первым ударом служит развитие жировой дистрофии, вторым — воспаление с формированием стеатогепатита (рис. 1 и 2).
_575.gif)
Основные компоненты гепатоцеллюлярных липидов представлены триглицеридами (ТГ), субстратами для синтеза которых являются неэстерифицированные жирные кислоты (НЭЖК) и глицерофосфат. НЭЖК образуются из пищевого жира и в результате липолиза жировой ткани, доставляются в гепатоцит в связанной с альбуминами форме или в составе хиломикронов. Главными источниками глицерофосфата являются глицерин, выделяющийся при гидролизе липидов, и глюкоза, которая в процессе гликолиза трансформируется в фосфатидную кислоту, запускающую синтез ТГ. В случае, когда продукция ТГ превышает синтез липопротеинов и секрецию их из гепатоцита в виде холестерина липопротеинов очень низкой плотности (ХС ЛПОНП), происходит накопление липидов в гепатоците с развитием жировой дистрофии. На этом фоне нарушается β-окисление жирных кислот, усиливаются процессы свободнорадикального окисления липидов (ПОЛ). Накопление продуктов окисления вызывает некроз гепатоцитов, способствует развитию воспалительного процесса, повышению синтеза провоспалительных цитокинов (фактора некроза опухоли альфа (ФНО-α), интерлейкинов ИЛ-6, ИЛ-8 и пр.), которые активируют звездчатые клетки (клетки Ито), продуцирующие компоненты соединительной ткани и способствующие апоптозу гепатоцитов.
Экспериментальные данные свидетельствуют о том, что основным звеном развития НАЖБП, как и других компонентов МС, является ИР — снижение чувствительности тканей-мишеней к инсулину, приводящее к уменьшению инсулинозависимой утилизации глюкозы органами (в первую очередь печенью и мышцами), при этом формирование НАЖБП способствует поддержанию и прогрессированию ИР [18].
Доказано, что висцеральная жировая ткань обладает эндокринной и паракринной активностью. Адипоциты наряду с НЭЖК, которые не только затрудняют связывание инсулина с рецепторами, но и нарушают передачу сигнала от рецептора в клетки, продуцируют адипоцитокины — ФНО-α, ИЛ-6, адипонектин, резистин, лептин, которые также влияют на чувствительность тканей к инсулину [1, 2] (табл.).
.gif)
ФНО-α активирует ингибитор каппа-киназы-бета (IKKβ) в адипоцитах и гепатоцитах, что приводит к нарушению связывания инсулина с рецептором. Его воздействие на инсулиновый рецептор I типа (IRS-1) проявляется в его фосфорилировании, из-за чего уменьшается его тропность к инсулину, снижается количество транспортного белка GLUT-4, осуществляющего вход глюкозы в клетку. В конечном итоге снижается захват и утилизация глюкозы клетками, нарастает гликемия и прогрессирует ИР. Формирующаяся ГИ напрямую влияет на метаболизм липидов в печени, увеличивая синтез холестерина путем влияния на активность гидроксилметилглутарил-КоА-редуктазы (ГМК-КоА-редуктаза), и повышает захват печенью холестерина липопротеинов низкой плотности (ХС ЛПНП).
Есть данные о том, что в развитии НАЖБП участвует микрофлора желудочно-кишечного тракта (ЖКТ) [19]. Одним из пусковых механизмов ФНО-α опосредованной воспалительной реакции в печени может являться воздействие бактериальных экзотоксинов, которые поступают в систему воротной вены в значительных количествах при синдроме избыточного бактериального роста в кишечнике [18].
Согласно строгим требованиям академической медицины диагноз НАЖБП устанавливается при наличии трех признаков: гистологической характеристики, отсутствия злоупотребления алкоголем и при исключении других хронических заболеваний печени. Однако пункционная биопсия печени является инвазивной процедурой и ее выполнение в педиатрической практике ограничено. В связи с этим в последние годы наибольшую распространенность в диагностике заболеваний печени приобретают неинвазивные методы исследования: ультразвуковое исследование (УЗИ), эластография печени, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). Преимуществом УЗИ можно считать неинвазивность, доступность и низкую себестоимость, отсутствие специальной подготовки и лучевой нагрузки. К ультразвуковым признакам стеатоза печени относятся повышение эхогенности, диффузная неоднородность паренхимы печени, нечеткость сосудистого рисунка, затухание ультразвукового луча. Однако эти ультразвуковые характеристики не являются специфичными и требуют интерпретации с учетом клинических и анамнестических данных [10]. Диагностическим критерием патологических изменений паренхимы печени при проведении КТ является денситометрический показатель по шкале Хаунсфилда. У здоровых детей он составляет 56–70 ед. Н (единиц Хаунсфилда). Воспалительная инфильтрация (гепатит) сопровождается снижением денситометрического показателя до 30–40 ед. Н. Жировая дистрофия характеризуется более выраженным снижением показателя плотности до 0–20 ед. Н. Для участков фиброза характерно очаговое повышение денситометрического показателя более 70 ед. Н. [20]. В лабораторных анализах возможно умеренное повышение (не более 1,5–2 норм) уровня аминотрансфераз, при этом соотношение АЛТ/АСТ (АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза) обычно более 1. Уровень гамма-глутамилтранспептидазы, щелочной фосфатазы, билирубина повышается редко, белково-синтетическая функция печени сохранена. Следует помнить, что в связи с общностью патогенетических механизмов у детей с НАЖБП с высокой частотой диагностируются и другие компоненты МС — абдоминальное (висцеральное) ожирение, артериальная гипертензия, нарушения углеводного и липидного обменов, гиперурикемия и др.
В основе лечения НАЖБП, как и МС в целом, лежат мероприятия, направленные на снижение массы тела и ИР, нормализацию углеводного и липидного обменов. Для этого рекомендуется изменение стереотипов питания, отказ от вредных привычек (курение, алкоголь), повышение физической активности. Есть указания на то, что снижение массы тела на 8–10% от исходной сопровождается уменьшением массы висцерального жира, что, как правило, способствует коррекции метаболических нарушений, повышению чувствительности тканей к инсулину [1]. Однако следует помнить, что снижение веса должно происходить плавно (не более 0,5 кг в неделю), так как быстрая потеря веса может усугубить течение НАЖБП и способствовать развитию некротического воспаления и развитию холестаза.
Необходимо соблюдать принципы сбалансированного питания — диета должна содержать достаточное количество белков, микроэлементов и витаминов. Следует ограничить потребление жиров, преимущественно животного происхождения, легкоусваиваемых углеводов и поваренной соли. Рекомендуется 5-разовый прием пищи: на завтрак должно приходиться 25–30% суточного калоража, на обед — 35–40%, на ужин — 10–15%. Второй завтрак и полдник должны укладываться в 10%. Пищу дают в отварном, тушеном или запеченном виде. Рацион составляется с учетом «пищевой пирамиды»: чувство насыщения обеспечивают продукты, употребляемые без ограничения (нежирное мясо, рыба, свежие овощи и др.), потребность в сладком — ягоды, фрукты. Важно устранить привычку есть на ночь (прекращать прием пищи за 2 часа до сна) и «на ходу» — бутерброды, чипсы, сухарики и пр. Большое значение придается пищевым волокнам. Согласно рекомендациям Американской ассоциации диетологов необходимое потребление ребенком пищевых волокон должно составлять (в граммах): возраст ребенка + 5.
В последние годы большое внимание уделяется продуктам функционального питания и биологически активным добавкам, препаратам на основе пищевых волокон, так как известно, что обогащение ими рациона способствует восстановлению баланса между образованием, всасыванием и выведением холестерина, изменению выделения интестинального глюкагона и панкреатического инсулина, адаптивному изменению функции и структуры кишечника [15, 23]. Имеются данные о том, что использование препарата Мукофальк на основе растительных волокон из оболочки семян подорожника овального (Plantago ovatа) позволяет снизить массу тела, уровень общего холестерина на 10–15% [4].
Для снижения веса можно рекомендовать еженедельные разгрузочные дни, особенно коллективные (семейные), которые могут быть кефирными, творожными, мясо-овощными, рыбо-овощными. Полное голодание строго противопоказано, т. к. оно провоцирует стресс и усугубляет метаболические нарушения.
Большое значение в лечении имеет лечебная физкультура. Рекомендуются танцы, плавание, водная аэробика, катание на велосипеде, лыжах, а также обычная утренняя зарядка, прогулки и туризм. Не показаны занятия тяжелой атлетикой, боксом, участия в кроссах и соревнованиях. Наиболее эффективными являются регулярные, низкоинтенсивные, несиловые тренировки. Не утрачивают своего значения физиопроцедуры — контрастный душ, гидромассаж и пр.
Следует помнить, что фармакологические препараты — это лишь дополнение, а не альтернатива изменениям режима питания и физической активности, а спектр лекарственных средств, используемый для коррекции нарушений липидного и углеводного обмена в детском возрасте, очень ограниченный. В частности, в качестве гипохолестеринемических средств у взрослых широко используются препараты различных фармакологических групп: статины, дериваты фиброевой кислоты, никотиновая кислота и ее производные и пр. Однако применение большинства препаратов этой группы ограничено возрастными рамками. С целью коррекции гипертриглицеридемии у детей возможно применение средств на основе омега-3 полиненасыщенных жирных кислот. Для коррекции пищевого поведения используются ингибитор активности липазы (орлистат), аноректик центрального действия (сибутрамин), однако бесконтрольное применение этих средств в педиатрической практике может быть сопряжено с нежелательными для здоровья последствиями. Для повышения чувствительности к инсулину показано применение бигуанидов (метформин (Глюкофаж, Сиофор)), которые снижают глюконеогенез, тормозят всасывание глюкозы в кишечнике, повышают чувствительность тканей к инсулину и снижают ИР.
В коррекции нарушений функции гепатобилиарной системы особое место отводится лекарственным средствам на основе урсодезоксихолевой кислоты (УДХК) (Урсофальк, Урсосан). УДХК обладает гепатопротективным, литолитическим, умеренным иммуномодулирующим, гипохолестеринемическим действием, блокирует пролиферативную фазу фиброгенеза и обладает антиоксидантными свойствами. К препаратам растительного происхождения, используемым в педиатрической практике и обладающим комплексным действием на функциональное состояние гепатобилиарной системы, относятся лекарственные средства на основе расторопши (Легалон) и артишока (Хофитол). Участие окислительного стресса в патогенезе НАЖБП обосновывает использование в комплексной терапии антиоксидантов (α-липоевая кислота, витамин Е, коэнзим Q10 и др.).
Ряд научных публикаций последних лет посвящен влиянию пре-, пробиотиков на жировой и углеводный обмен. Есть указания на снижение уровня холестерина на фоне приема препаратов этих групп [19].
Таким образом, тенденция к омоложению мультифакторных заболеваний обменного характера, рост в детской популяции НАЖБП и МС, относительно низкая информированность педиатров о критериях диагностики, патогенезе и лечении этих состояний диктует необходимость широкого освещения и внедрения в практику современных научных и экспериментальных данных, разработку образовательных программ для врачей и пациентов.
Литература
- Бутрова С. А. Метаболический синдром: патогенез, клиника, диагностика, подходы к лечению // Рос. мед. журнал. 2001. № 9. Т. 2. С. 56–61.
- Метаболический синдром / Под ред. Г. Е. Ройтберга. М.: Медпресс-информ, 2007. 223 с.
- Бокова Т. А. Метаболический синдром у детей: учебное пособие. М.: Форте принт, 2013. 36 с.
- Леонтьева И. В. Диагностика и лечение метаболического синдрома в практике педиатра // Доктор Ру. 2011. № 2. С. 13–23.
- Щербакова М. Ю., Лебедькова С. Е., Туркина Т. И. и др. Метаболический синдром у детей и подростков. Оренбург, 2011. 162 с.
- Weiss R., Dziura J., Burgert T. Obesity and the Metabolic Syndrome in children and adolescents // New Engl. J. Med. 2004. Vol. 350. № 23. Р. 2362–2374.
- Zimmet P., Alberti G., Kaufman F. et al. The metabolic syndrome in children and adolescents — an IDF consensus report // Pediatric Deabetes. 2007. Vol. 8. № 5. Р. 299–306.
- Захарова И. Н., Звенигородская Л. А., Яблочкова С. В. Неалкогольная жировая болезнь печени у детей: современные возможности патогенетической терапии // Эффективная фармакотерапия. 2012. № 2. С. 32–36.
- Корочина И. Э. Гастроэнтерологические аспекты метаболического синдрома: Материалы 5-го Славяно-Балтийского научного форума «Санкт-Петербург — Гастро-2003» // Гастроэнтерология Санкт-Петербурга. 2003. № 2–3. С. 82.
- Лазебник Л. Б., Звенигородская Л. А. Метаболический синдром и органы пищеварения. М., 2009, 181 с.
- Маев И. В., Дичева Д. Т. Патогенетические механизмы формирования патологии гепатобилиарной системы у больных с метаболическим синдромом и пути их коррекции // Consilium Medicum. 2008, № 2, с. 33–36.
- Бокова Т. А., Урсова Н. И., Тишенина Р. С. и др. Современные подходы к профилактике, диагностике и лечению патологии гепатобилиарной системы у больных с метаболическим синдромом: учебное пособие / Под ред. проф. Г. В. Римарчук. М.: 4 ТЕ Арт, 2011. 27 с.
- Fan J. G., Saibara T., Chitturi S. et al. Effects of nonalcoholic fatty liver disease on the development of metabolic disorders // J. Gastroenterol. Hepatol. 2007. № 22. P.1086–1091.
- Schwimmer J. B., Deutsch R., Kahen T. et al. Prevalence of fatty liver in children and adolescents // Pediatrics. 2006. Vol. 118. № 4. Р. 1388–1393.
- Цуканов В. Н., Тонких Ю. А., Каспаров Э. Р. Неалкогольная болезнь печени у взрослого населения России (распространенность и факторы риска) // Врач. 2010. № 9. С. 1–4.
- Fu J. F., Shi H. B., Liu L. R. et al. Non-alcoholic fatty liver disease: An early mediator predicting metabolic syndrome in obese children? // World J. Gastroenterol. 2011. Vol. 14. № 17 (6). Р. 735–742.
- Бокова Т. А., Урсова Н. И. Патология гепатобилиарной системы у детей и подростков с ожирением и метаболическим синдромом // Врач. 2011. № 1. С. 56–58.
- Ogawa W., Takashima M. Hepatic insulin resistance and energy homeostasis // Nippon Rinsho. 2010. Vol. 68. № 2. Р.3 30–334.
- Петухов В. А. Нарушение функций печени и дисбиоз при липидном дистресс-синдроме Савельева и их коррекция пробиотиком Хилак-форте // Русский медицинский журнал. 2002. Т. 10. № 4. С. 77–89.
- Кармазановский Г. Г., Вилявин М. Ю., Никитаев Н. С. Компьютерная томография печени и желчных путей. М., 1997. 358 с.
- Герок В., Блюм Х. Е. Заболевания печени и желчевыделительной системы. М.: МЕДпресс-информ, 2009. 199 с.
- Gupta R. The prevalence of non-аlcoholic fatty liver disease and metabolic syndrome in obese children // J. Pediatr. Endocrinol. Metab. 2011. Vol. 24. № 11–12. Р. 907–911.
- Шендеров Б. А. Функциональное питание и его роль в профилактике метаболического синдрома. М.: ДеЛи-принт, 2008. 319 с.
Т. А. Бокова, кандидат медицинских наук
ГБУЗ МО МОНИКИ им. М. Ф. Владимирского, Москва
Контактная информация: bta2304@mail.ru
Источник
