Неполная осложненная катаракта псевдоэксфолиативный синдром
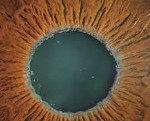

Псевдоэксфолиативный синдром – это увеопатия, характеризующаяся отложением амилоидоподобного вещества на структурах переднего сегмента глазного яблока. Клиническая картина представлена зрительной дисфункцией, появлением «помутнений» и «радужных кругов» перед глазами, затуманиванием зрения. Диагностика базируется на проведении ультразвуковой биомикроскопии, классической биомикроскопии с использованием щелевой лампы, скополаминовой пробы, УЗИ, визометрии, тонометрии, периметрии, гониоскопии. Консервативная терапия основывается на применении антиоксидантов, антигипоксантов, гипотензивных средств, витаминов группы В, А, Е.
Общие сведения
Псевдоэксфолиативный синдром впервые был описан финским ученым Дж. Линдбергом в 1917 году. Наблюдается взаимосвязь между развитием болезни и возрастом пациента. В 50-59 лет вероятность возникновения патологии составляет 1-2,5%, в 60-69 лет – 30%, после 70 лет – 42%. Согласно статистическим данным, заболевание диагностируется у 30% россиян старше 50 лет. Риск развития глаукомы у пациентов с псевдоэксфолиативным синдромом равен 64,6%. Патология чаще встречается среди представителей женского пола, однако тяжелее протекает у мужчин. Распространенность наиболее высока в серверных регионах.
Псевдоэксфолиативный синдром
Причины псевдоэксфолиативного синдрома
Этиология заболевания до конца не изучена. Продолжительное время ученые связывали развитие патологии с изменениями строения эпителия хрусталика, однако диагностика псевдоэксфолиативного синдрома после интракапсулярной экстракции катаракты позволила опровергнуть эту теорию. На сегодняшний день ведущая роль в развитии болезни отводится действию следующих факторов:
- Ультрафиолетовое излучение. Воздействие ультрафиолета индуцирует свободно-радикальное окисление и деструкцию клеточной мембраны. Это влечет за собой атрофию с типичными признаками эксфолиации.
- Травматическое повреждение. Травмы глазного яблока приводят к локальным изменениям, которые у генетически скомпрометированных лиц являются пусковым фактором пигментной дисперсии.
- Внутриорбитальные инфекции. Многие авторы полагают, что поражение глаз обусловлено повышенной проницаемостью гематоофтальмического барьера (ГОБ). Способностью проникать через ГОБ наделена токсоплазма, вирус опоясывающего герпеса и краснухи.
- Нарушения иммунного статуса. В пользу этой этиологической теории псевдоэксфолиативного синдрома свидетельствует обнаружение в слезной жидкости повышенной концентрации интерлейкинов 6, 10, иммуноглобулина класса А и лактоферрина.
- Генетическая предрасположенность. У некоторых пациентов можно установить нарушение экспрессии генов в ядре и митохондриях. Встречаемость ПЭС среди родственников гораздо выше, чем в популяции. Прослеживается аутосомно-доминантный тип наследования.
Ученые полагают, что развитию болезни способствует курение и аутоиммунные патологии. Удается проследить взаимосвязь между возникновением ПЭС и артериальной гипертензией, атеросклерозом, аневризмой аорты в анамнезе. Некоторые исследователи полагают, что данные изменения – это следствие системной васкулопатии, поэтому пациенты с ПЭС часто страдают кардиоваскулярными заболеваниями.
Патогенез
Ключевая роль в механизме развития заболевания отводится образованию и депонированию аномального экстрацеллюлярного микрофибриллярного белка на поверхности передней капсулы хрусталика и радужки, цилиарном теле, цинновых связках, по краю зрачкового отверстия. Реже визуализируются патологические отложения в области передней камеры. Установлено, что белок относится к амилоидоподобной субстанции, за его синтез отвечает пигментный эпителий и меланоциты радужки. Согласно современным представлениям, патогенез ПЭС связан с нарушением эпителио-мезенхимальных взаимоотношений в структурах глазного яблока. Проникновение белковых структур в толщу его оболочек ведет к их дистрофическому перерождению.
Псевдоэксфолиативный синдром принято рассматривать как системное нарушение метаболизма соединительной ткани. Подтверждением этой теории является обнаружение специфических отложений в паренхиматозных органах (печень, почки, сердце, головной мозг) и кожных покровах. Учеными было обнаружено 14 антигенов главного комплекса гистосовместимости (HLA) при наследуемой форме патологии. Прогрессирование заболевания ведет к атрофии пигментной каймы, что проявляется выраженной дисперсией пигмента. Пигментоциты удается обнаружить в УПК и на радужной оболочке. Из-за поражения дренажной сети нарушается отток водянистой влаги с последующим повышением внутриглазного давления.
Классификация
В офтальмологии различают генетически детерминированный и иммуноопосредованный вариант развития. Вне зависимости от патогенеза болезнь всегда возникает в преклонном возрасте. По выраженности дистрофических изменений выделяют следующие степени псевдоэксфолиативного синдрома:
- I – проявляется легкой атрофией радужки. Патологический процесс не распространяется за пределы корня оболочки. Кайма зрачка имеет неравномерную структуру. В области хрусталика определяется маловыраженное наслоение амилоида.
- II – атрофия стромы радужной оболочки умеренная. На поверхности радужки и в зоне УПК выявляются выраженные псевдоэксфолиативные и пигментные отложения.
- III – атрофические изменения резко выражены. Пигментная кайма имеет вид «целлофановой пленки», что обусловлено дисперсией пигмента. Поражение связочного аппарата вызывает подвывих, реже – вывих хрусталика.
Клиническая классификация базируется на результатах ультразвуковой биомикроскопии. Различают следующие стадии патологического процесса:
- I – признаки поражения соответствуют псевдоэксфолиативному синдрому. Удается визуализировать точечные включения в передних отделах глаз.
- II – к вышеописанным изменениям присоединяются начальные признаки повреждения цинновой связки в виде чередования зон истончения с утолщением. Длина волокон разная.
- III – аномальные включения становятся более плотными, провоцируют разрушение связочного аппарата.
- IV – включения объединяются в большие конгломераты, которые приводят к увеличению продольной оси глазного яблока за счет удлинения переднего сегмента.
Симптомы псевдоэксфолиативного синдрома
Для заболевания характерно длительное бессимптомное течение. Вначале поражается один глаз (зачастую левый). Вовлечение второго глазного яблока, как правило, наблюдается спустя 5-10 лет после развития первых симптомов. Жалобы обычно возникают уже после массивного отложения амилоида. Пациенты отмечают появление «помутнений» перед глазами. При взгляде на источник света появляются специфические «радужные круги». Снижение остроты зрения обусловлено поражением хрусталика, повышением ВГД и атрофией сфинктера радужки. Нарушается аккомодационная способность, в дальнейшем расстройства аккомодации сопровождаются затуманиванием зрения, нарушением рефракции. Болевой синдром появляется только при повреждении связочного аппарата.
Заболевание очень медленно прогрессирует. Пациенты часто игнорируют клинические проявления. Помимо жалоб со стороны глаз при отложении белка во внутренних органах возникают симптомы их поражения. При депонировании амилоида в печени отмечается чувство тяжести в правом подреберье, реже – желтушность кожных покровов. Боль в пояснице по типу почечной колики, нарушения мочеиспускания являются типичными признаками скопления белковых масс в паренхиме почек. При распространении патологического процесса в толщу миокарда наблюдается ощущение сдавливания за грудиной, покалывание в области сердца. Доказано, что ПЭС широко распространена среди больных сенильной деменцией, когнитивными расстройствами, хронической ишемией головного мозга, болезнью Альцгеймера.
Осложнения
Отложение белка в толще хрусталиковых масс провоцирует развитие вторичной катаракты ядерного типа, которая зачастую сопровождается слабостью связочного аппарата. Это приводит к тому, что более чем у половины больных катарактой возникает сублюксация, реже – люксация хрусталика. В большинстве случаев патология осложняется офтальмогипертензией. Поражение трабекулярной сети ведет к возникновению псевдоэксфолиативной открытоугольной глаукомы, а с прогрессированием заболевания – к глаукомной оптической нейропатии или слепоте. Поражение мейбомиевых желез становится причиной ксерофтальмии.
Диагностика
Постановка диагноза на доклинической стадии затруднена. Выявить первые признаки можно только при помощи ультразвуковой биомикроскопии. Специфические методы диагностики включают:
- Биомикроскопию глаза. Позволяет визуализировать скопления белого или сероватого оттенка, напоминающи е хлопья на поверхности оболочек переднего отдела органа зрения. Хаотичные скопления пигмента могут формировать веретено Крукенберга. Псевдоэксфолиации по структуре похожи на воспалительные преципитаты.
- Гониоскопию. В передней камере определяются множественные включения, которые на поздних стадиях формируют крупные конгломераты. При нарушении проницаемости гематоофтальмического барьера в водянистой влаге обнаруживается взвесь крови. Объем камеры не изменен.
- Бесконтактную тонометрию. Характерно повышение внутриглазного давления, которое при вторичной глаукоме тяжело поддается снижению медикаментозным путем. При поражении дренажной системы дополнительно проводится электронная тонография.
- УЗИ глаза. При использовании ультразвуковой диагностики можно обнаружить разрыв цинновой связки с возникновением сферофакии. Из-за массивных отложений белка нарушается соотношение размеров переднего и заднего сегментов. Методика также применяется с целью обследования заднего сегмента глаз при снижении прозрачности оптических сред.
- Ультразвуковую биомикроскопию. Дает возможность выявить мелкоточечные включения слабой акустической плотности на оболочках глаза, разницу длины и лизис отдельных волокон цинновой связки.
- Скопаламиновую пробу. При 1 степени при проведении пробы зрачковое отверстие расширяется до 5 мм, при 2 – до 3,5-4 мм. При 3 степени патологии реакция зрачка отсутствует.
- Визометрию. Зрительная дисфункция наблюдается при помутнении оптических сред или вторичной глаукоме. При тяжелом течении острота зрения снижается вплоть до светоощущения.
- Периметрию. Определяется концентрическое сужение поля зрения. В ряде случаев удается диагностировать выпадение отдельных участков из зрительных полей, скотомы.
Пациентам с данной патологией в анамнезе показана консультация невропатолога, ревматолога, кардиолога, гастроэнтеролога, отоларинголога. Необходимость проведения комплексного обследования вызвана системным поражением фиброзной ткани. Часто выявление первых симптомов поражения глаза позволяет диагностировать отложения амилоида в других паренхиматозных органах.
Лечение псевдоэксфолиативного синдрома
Этиотропная терапия псевдоэксфолиативного синдрома не разработана. Цель консервативного лечения – предупредить развитие тяжелых осложнений. На ранних стадиях показано применение:
- Антиоксидантов. Используются лекарственные средства, в состав которых входит супероксиддисмутаза. СОД относится к классу металлопротеидов. Антиоксиданты вызывают разрушение активных форм кислорода, которые оказывают повреждающее влияние на ткани глаза.
- Антигипоксантов. С целью улучшения метаболизма и стимуляции процесса тканевого дыхания применяется цитохром С. Инстилляции препарата способствуют ускорению эпителизации и репарации повреждений структур передних сегментов глаз.
- Гипотензивных средств. Показаны при повышении внутриглазного давления, признаках офтальмогипертензии и начальных стадиях развития псевдоэксфолиативной глаукомы.
- Витаминотерапии. Доказана эффективность применения метилэтилпиридинола (структурный аналог витамина В6), который обладает фибринолитическим и антиоксидантным действием. В окислительно-восстановительных процессах также участвует витамин А (ретинола ацетат) и Е (токоферола ацетат).
При длительном течении патологии целью лечения является устранение или снижение выраженности вторичных осложнений. Медикаментозная терапия псевдоэксфолиативной глаукомы зачастую не оказывает должного эффекта. Возникает необходимость в лазерном или хирургическом вмешательстве. Наиболее целесообразно проведение ранней лазерной трабекулопластики, однако спустя 3-4 года возникают рецидивы повышения ВГД. При выборе метода удаления сублюксированного хрусталика следует отдавать предпочтение факоэмульсификации. Методикой резерва остается экстракапсулярная экстракция.
Прогноз и профилактика
Исход заболевания зависит от степени тяжести, характера поражения структур переднего отдела глаз и типа осложнений. При своевременной диагностике и лечении осложнений прогноз в отношении зрительных функций благоприятный. Возникновение вторичной глаукомы ассоциировано с резистентностью к консервативной терапии и риском необратимой потери зрения. Специфическая профилактика не разработана. Даже при ранних симптомах псевдоэксфолиативного синдрома необходима постановка на диспансерный учет у офтальмолога из-за высокой вероятности развития глаукомы. Показан регулярный контроль внутриглазного давления. Больные должны проходить комплексное офтальмологическое обследование не реже, чем два раза в год.
Источник
Многочисленные публикации различных авторов свидетельствуют о большой частоте операционных и послеоперационных осложнений при экстракции катаракты при ПЭС [10, 14-16, 27, 37-39, 46, 47, 52-54, 69, 75, 84, 85, 91, 112, 127, 133, 140, 141, 154, 159, 174, 175, 180, 183, 185, 193, 195, 199, 209].
Частота операционных осложнений нередко в 4-5 раз превышает таковые при хирургии сенильных катаракт [12, 37, 109, 205]. Среди характерных осложнений при ПЭС были отмечены: реактивная гипертензия, гифема, разрывы капсулы хрусталика, выпадение стекловидного тела, интраоперационное и послеоперационное смещение хрусталика, экссудативную реакцию. Закономерно, что частота операционных и послеоперационных осложнений во многом зависят от выраженности ПЭС [6, 12, 37, 69, 74, 96, 109, 125]. В тоже время, в научной литературе присутствуют публикации, в которых не выявлена существенная разница в частоте операционных и послеоперационных осложнений в глазах с ПЭС и без него [12, 86].
С внедрением непрерывного переднего капсулорексиса (ПК) факоэмульсификация катаракты сделала большой шаг вперед, т.к. он принес большое преимущество для стабильной и долгосрочной центрации ИОЛ [8, 11, 108, 147, 170]. Однако офтальмологи получили новое осложнение – синдром сокращения капсулы [108, 130, 175, 183, 195, 228]. В последние годы с большим интересом обсуждается проблема контрактуры капсульного мешка после факоэмульсификации катаракты с имплантацией ИОЛ. Понятие «контрактура капсульного мешка» или «синдром сокращения капсулы» впервые введено J. Davison в 1993 году [175]. Контрактура капсульного мешка не идентична понятию «помутнение капсульного мешка», хотя в литературе многие авторы не всегда их строго дифференцируют. Фактически это стадии одного процесса, который включает пролиферацию клеток капсулярного эпителия с формированием волокон, которые в дальнейшем приводят к уплотнению капсулы с последующим сокращением капсульного мешка и формированием контрактуры [92, 108, 183, 216, 228]. Патогенетический механизм контрактуры капсулы заключается в пролиферации эпителиальных хрусталиковых А-клеток, расположенных под передней капсулой хрусталика, и Е-клеток, расположенных в экваториальной зоне хрусталика. Клетки после хирургической травмы становятся активными и трансформируются в фибробласты и миофибробласты, которые продуцируют коллагеновые волокна вокруг края переднего капсулотомического отверстия. Новообразованные волокна слипаются с капсулой, формируют закрытое пространство, в котором эпителиальные хрусталиковые клетки дифференцируются в хрусталиковые волокна. Регенерированные хрусталиковые волокна формируют кольцо Зоммеринга [132, 175, 194, 216, 228]. Эпителиальные хрусталиковые клетки при контакте с ИОЛ продуцируют цитокины, такие как интерлейкины IL-1, IL-6, IL-8, трансформирующий фактор роста – (3 (TGF-p), основной фибробласт растущий фактор ф – TGF), а также простагландин Е 2 (PGE 2). Все они стимулируют синтез коллагена эпителиальными клетками хрусталика. Помимо цитокинов А-клетки выделяют трансферрины и различные клеточные адгезивные молекулы, такие как интегрин, ICAM-1, CD44. Эти клеточные адгезивные молекулы способствуют прикреплению эпителиальных клеток к капсуле хрусталика [108, 132, 157, 216, 228].
Помутнение листков передней капсулы, как правило, сопровождается контрактурой капсульного мешка, приводящей к ухудшению зрения и децентрации ИОЛ. Указанные изменения капсульного мешка в настоящее время определяют основные показания к лазерным и хирургическим вмешательствам по репозиции ИОЛ, а в некоторых случаях ее замене или удалению [33, 38, 39,85, 127, 140, 142, 174]. Фиброз капсульного мешка диагностируется в различные сроки после операции, чаще от 3-х месяцев до 5-ти лет в 50% случаев имеется тенденция к прогрессированию с увеличением послеоперационного срока наблюдения [33, 75, 157, 174, 183, 195]. Так, по данным Schaumberg, частота осложнений через 1 год после операции составляет 11,8%; через 3 года – 20,7% и 28,5% – через 5 лет. Проведенные рядом авторов исследования переднего капсулотомического отверстия после факоэмульсификации катаракты с имплантацией ИОЛ показали, что идеальный размер капсулорексиса – 5,0-5,5 мм, при этом сокращение капсулорексиса к 3-м месяцам после операции доходит до 15% [104, 118, 124]. Таким образом, диаметр капсулорексиса к 3-м месяцам должен быть равен приблизительно 4,5-4,7 мм. При меньшем диаметре переднего капсулорексиса происходит адгезия листка передней капсулы с оптикой ИОЛ и отмечается не только предрасположенность к контрактуре, но и большая частота помутнения задней капсулы [17, 42, 118, 216, 228].
Патогенетические механизмы изменения капсульного мешка обусловлены процессами пролиферации, миграции и метаплазии эпителиальных клеток хрусталика. При стандартном выполнении факоэмульсификации сенильных катаракт с визуальным контролем полноты удаления хрусталиковых масс и вакуумной очистке капсулы в большинстве случаев удается добиться высоких зрительных функций. Вместе с тем процесс пролиферации остаточных хрусталиковых клеток может быть активным. К факторам, стимулирующим пролиферацию и последующую метаплазию хрусталиковых клеток относят возраст, этиологию катарактального процесса, выраженность послеоперационной воспалительной реакции, состояние местного и общего иммунного статуса, материал ИОЛ, конструкцию оптической и опорной частей линзы [75, 157, 188,193, 221]. Многократно подтверждена большая частота помутнений задней капсулы у детей и пациентов относительно молодой возрастной группы 40-50 лет.
Высокая предрасположенность объясняется возрастной регенераторной активностью капсулярного эпителия и сопутствующими иммунными нарушениями при катарактах этого возраста. После 60-ти лет тенденция к фиброзу капсульной сумки и развитию вторичной катаракты в 3 раза ниже, чем у больных моложе сорока лет. Частота помутнений задней капсулы при ПЭС диагностируется в 10-50% случаев [17, 157, 165]. Исследованиями различных авторов доказана высокая частота изменений капсульного мешка у пациентов с системными, синдромными заболеваниями, наличием сопутствующей патологии глаза; при глаукоме, миопии высокой степени, диабетических, травматических и увеальных катарактах, пигментной абиотрофии сетчатки [142]. Частота возникновения фиброза капсульного мешка по данным различных авторов, колеблется в широком диапазоне от 10 до 70 % случаев [28, 34, 142, 157, 174]. Отмечается также увеличение поздних послеоперационных осложнений в глазах с ПЭС – задняя дислокация комплекса «ИОЛ-капсульный мешок», которое обусловлено прогрессированием дистрофического процесса. Частота осложнения, согласно публикациям, не превышает 1-2 %, однако оно не ординарно по методам устранения и является наиболее частой причиной замены и удаления ИОЛ [16, 38, 39, 46, 47, 52, 127, 140, 141, 159, 174, 180, 185, 193, 197].
В настоящее время для стабилизации положения ИОЛ и предупреждения децентрации используются внутрикапсульные кольца, однако мнения ученых о возможности профилактики контракции капсульного мешка при помощи ВК противоречивы [27, 53, 74, 152, 197]. Для профилактики риска послеоперационной контракции КМ предложены лазерные послабляющие насечки в раннем послеоперационном периоде после хирургии катаракты. Авторами показано, что YAG-лазер был эффективным для предотвращения контракции у пациентов с высоким риском развития пролиферации, и не имел отрицательных воздействий [179]. В то же время, другие исследования выявили что, проведение подобного лазерного вмешательства связано с риском развития таких осложнений, как макулярный отек, отслойка сетчатки, реактивный подъем внутриглазного давления, повреждение ИОЛ [201].
Несмотря на повышенный риск осложнений, широкое внедрение современных технологий ФЭК обеспечило возможность неосложненного выполнения хирургического вмешательства при ПЭС [5, 8, 101, 102, 109, 118]. Однако, несмотря на это, доказано, что прогрессирование дистрофии радужки с нарушением ее диафрагмальной функции, нарастание симптоматики несостоятельности связочного аппарата зависят от стадии ПЭС и остаются факторами риска послеоперационных осложнений и в современной хирургии катаракты [69, 74, 96, 105, 116]. В литературе встречаются единичные работы, в которых упоминается о возможности имплантации псевдоаккомодирующих ИОЛ при ПЭС и слабости связочного аппарата хрусталика [67, 136, 137], однако исследований, направленных на формирование четких критериев отбора пациентов на имплантацию мультифокальных ИОЛ после факоэмульсификации с учетом стадии ПЭС не проводилось.
Эффективность проводимых мер профилактики операционных и послеоперационных осложнений зависит от уровня диагностики ПЭС, выявления ранних симптомов несостоятельности связочного аппарата хрусталика [26, 32, 93, 110, 111, 217]. Диагностика ПЭС на доклинических и ранних клинических стадиях заболевания с использованием общепринятых методов клинико-фунциональных исследований остается непростой задачей. Классическая клиническая картина синдрома при биомикроскопии не соответствует стадии выраженных деструктивных изменений структур глаза [43, 44, 135, 217]. Не случайно, поэтому усилилось внимание к прогностически неблагоприятным ситуациям в возникновении осложнений при ПЭС. При этом оценка состояния и степени вовлечения в дистрофический процесс структур переднего сегмента глаза с использованием современного информативного метода ультразвуковой биомикроскопии позволяет выявить патологические изменения раньше, чем световая биомикроскопия [43, 44, 134, 135, 217]. УБМ позволяет на качественном более высоком диагностическом уровне не только визуализировать структуры переднего сегмента глаза в пространственном функциональном взаимодействии друг с другом, но и дать им четкие цифровые выражения [43, 44, 118, 134, 217]. Наиболее частыми осложнениями позднего послеоперационного периода после факоэмульсификации катаракты на глазах с псевдоэксфолиативным синдромом, приводящими к значительному снижению зрительных функций, являются фиброз капсульного мешка, сужение (фимоз) кольца капсулорексиса, сопутствующее прогрессирование недостаточности связочного аппарата хрусталика и, как следствие, децентрация (дислокация) комплекса ИОЛ-капсульный мешок. Указанные особенности течения послеоперационного периода являются противопоказанием к современной методике зрительной реабилитации с использованием мультифокальных ИОЛ у значительного количества пациентов с катарактой. В то же время четкие показания и противопоказания к имплантации мультифокальных ИОЛ в зависимости от стадии ПЭС в доступной литературе отсутствуют. Для профилактики контракции капсульного мешка после факоэмульсификации катаракты в сочетании с псевдоэксфолиативным синдромом предложена методика YAG-лазерной дисцизии передней капсулы хрусталика, однако результаты применения данной методики противоречивы и не позволяют сделать однозначных выводов о целесообразности ее применения [201].
Таким образом, восстановление или сохранение аккомодационной функции хрусталика после ФЭК с ИОЛ является одной из самых сложных и актуальных проблем в хирургии катаракты, которая представляет не только научный, но и практический интерес. Использование для этой цели ИОЛ, создающих в глазу сразу несколько фокусов, дает возможность приблизиться к решению этого вопроса наиболее оптимальным и современным путем. Применение в клинической практике мультифокальных ИОЛ определяет уровень катарактальной хирургии клиник и офтальмохирургов [67, 114]. К настоящему моменту выполнены многочисленные исследования, направленные на оценку клинико-функциональных результатов применения мультифокальных ИОЛ в хирургии неосложненной катаракты [9, 49, 67, 70, 121]. В то же время, в доступной литературе присутствуют лишь единичные исследования, рассматривающие эффективность применения мультифокальных ИОЛ у пациентов с осложненной катарактой и сопутствующим ПЭС, распространенность и актуальность которого на сегодняшний день не вызывает сомнений. Поэтому изучение возможности зрительной реабилитации у пациентов с осложненной катарактой в сочетании с псевдоэксфолиативным синдромом на основе факоэмульсификации с имплантацией мультифокальных ИОЛ, определение четких показаний и противопоказаний к операции с учетом стадии патологического процесса и разработка методики профилактики поздних послеоперационных осложнений представляется актуальной задачей.
Источник
