Невус хориоидеи код мкб


Описание
Представлены доброкачественными (невусы) и злокачественными (меланома) формами.
D31 Доброкачественное новообразование глаза и его придаточного аппарата
D31.3 Сосудистой оболочки.
Невус – наиболее часто встречающаяся доброкачественная опухоль, локализирующаяся в заднем отделе глазного дна (89%), около 11% невусов располагается в области экватора и в преэкваториальной зоне. Офтальмоскопически невусы выявляют у 1-2% взрослого населения, у лиц старшего возраста частота их выявления увеличивается, а на аутопсии частота невусов в хориоидее возрастает до 6.5-20%.
Не проводят.
Невусы подразделяют на стационарные и прогрессирующие.
Большая часть невусов возникает с рождения, но пигментация их появляется значительно позже, и обнаруживают их после 30 лет. У мужчин и женщин невусы выявляются одинаково часто, нередки случаи билатеральных невусов.
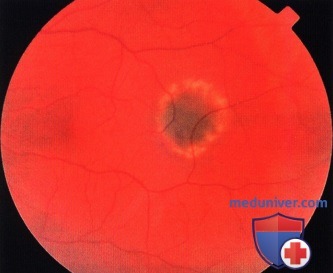
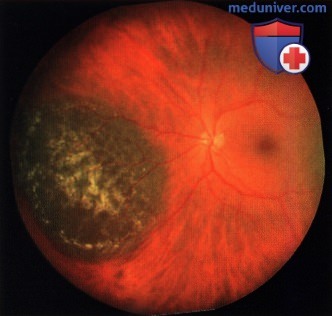
Нередко невусы бывают предметом случайной находки при офтальмоскопии. Они представлены плоскими или слегка выступающими очагами (до 1 мм) сероватого или серо-зелёного цвета с перистыми и чёткими границами, диаметр их 1-6 мм (рис. 36-39).
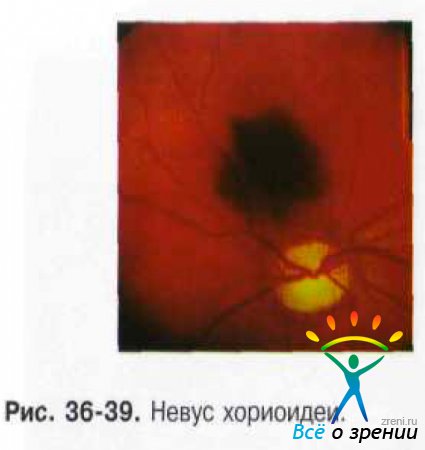
Перистость границ обусловлена просвечиванием красно-оранжевых сосудов хориоидеи в зоне пересечения края пигментации. Беспигментные невусы имеют овальную или округлую форму, границы их кажутся более ровными, но менее чёткими в связи с отсутствием пигмента. На поверхности невуса могут присутствовать друзы. Такие невусы определяют как стационарные.
По мере увеличения размеров невуса усиливаются дистрофические изменения в ПЭС, что приводит к увеличению друз стекловидной пластинки, появлению слабого субретинального экссудата, вокруг невуса возникает желтоватого цвета ореол. Изменяется окраска поверхности невуса, границы его становятся менее чёткими. Описанные изменения свидетельствуют о переходе стационарного невуса в прогрессирующий.
Жалобы отсутствуют.
- Определение остроты зрения.
- Офтальмоскопия.
Исследование глазного дна с цветными фильтрами. При офтальмоскопии в красном свете невус хориоидеи становится особенно отчётливо видимым, в то время как при исследовании в зелёном свете стационарный невус «исчезает», остаются видимыми лишь изменения в ретинальном пигментном эпителии при прогрессирующем невусе.
ФАГ при стационарных невусах демонстрирует гипофлюоресценцию на протяжении всего времени исследования, отсутствие изменений в окружающих сосудах, и хориоидее, особенно когда их локализация ограничена наружными отделами хориоидеи. При прогрессирующем невусе, когда возникают изменения в прилежащих сосудах хориоидеи, приводящих к появлению перифокального стаза, появляется пропотевание флуоресцеина.
Дифференцируют с начальной меланомой, метастатической карциномой, хориоидальной остеомой, отграниченной гемангиомой, врождённой локальной и реактивной гиперплазией ПЭС, субретинальным и субхориоидальным кровоизлиянием.
Предупреждение озлокачествления опухоли.
Отсутствуют.
Лазеркоагуляция при прогрессирующем невусе.
Три недели.
Показано динамическое наблюдение офтальмолога.
Стационарный невус имеет хороший прогноз. Прогрессирующий невус следует рассматривать как потенциально злокачественную опухоль.
С69 Злокачественное новообразование глаза и его придаточного аппарата.
С69.3 Сосудистой оболочки.
Меланома увеальная составляет 5% всей патологии органа зрения. Частота её растёт. В США за последние годы выявление меланомы хориоидеи по обращению увеличилось с 5,3 до 10,9 на 1 млн населения. В России этот показатель колеблется от 8 до 13,3 на 1 млн населения. Частота заболеваемости увеличивается с каждой декадой жизни, и после 70 лет ежегодно регистрируют 50 новых случаев опухоли на 1 млн населения.
Систематическая диспансеризация.
Не проводят.
Морфологически выделяют веретеноклеточную и эпителиоидную меланому. Смешанная меланома занимает промежуточное место, прогноз при ней зависит от преобладания веретенообразных или эпителиоидных клеток.
Опухоль в хориоидее развивается, как правило, спорадически. В редких случаях можно говорить о генетической предрасположенности: семейные формы меланомы составляют 0.37%.
В генезе меланомы возможны три механизма развития: de novo (чаще), на фоне предшествующего невуса хориоидеи и существующего окулодермального меланоза.
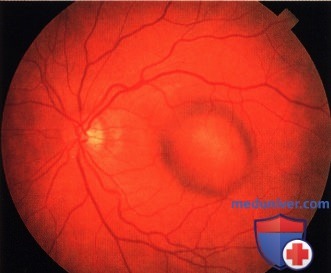
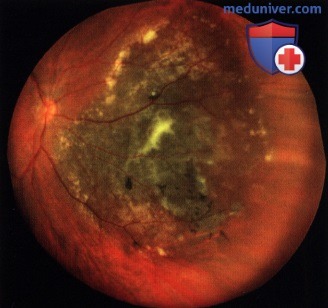
Чаще опухоль локализуется за экватором, растёт одиночным узлом. В начальной стадии представлена небольшим (не более 4-5 диаметров диска) округлой формы очагом желтовато-коричневого или серо-аспидного цвета: на поверхности и вокруг него видны друзы стекловидной пластинки. Возможна очаговая пролиферация ПЭС. Поля оранжевого пигмента на поверхности меланом обусловлены отложением зёрен липофусцина на уровне ПЭС (рис. 36-40).
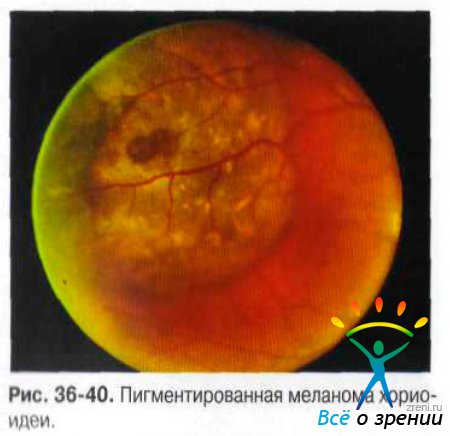
В опухоли развивается хаотичная сеть новообразованных сосудов. Сосуды сетчатки над опухолью уплощаются, при толщине опухоли более 6 мм исчезает их параллакс. При больших меланомах возможен разрыв сетчатки, и гладкая, блестящая поверхность опухоли проминирует в СТ. в котором становятся видимыми комплексы опухолевых клеток или дисперсия пигмента.
Диагноз меланомы хориоидеи остаётся сложным, процент клинически нераспознанных, но доказанных гистологически случаев колеблется от 3,6 до 12%.
Более половины больных жалуются на ухудшение зрения.
- Определение центрального и периферического зрения.
- Биомикроскопия, биомикроофтальмоскопия.
- Прямая и непрямая офтальмоскопия.
- Диафамоскопия.
- ФАГ.
- УЗИ, эхобиометрия.
- КТ и МРТ исследование.
Дифференцируют с другими опухолями, опухолеподобными заболеваниями, регматогенной отслойкой сетчатки.
Консультация онколога.
Ликвидация опухоли.
Энуклеация, брахитерапия, транспупиллярная термотерапия.
Зависят от вида лечения. После энуклеации — 2 нед. После локального разрушения период нетрудоспособности затягивается на 2-3 мес.
Обязательно динамическое наблюдение офтальмолога, онколога.
Не рекомендована работа в горячих цехах, длительное пребывание на солнце.
Зависит от гистологического типа опухоли, её размеров, локализации. Принято считать, что 40% больных погибают в течение 10 лет с момента постановки диагноза в результате гематогенного метастазирования в печень, лёгкие.
Доброкачественная опухоль с торпидным ростом, приводит к тотальной отслойке сетчатки.
D18.0 Гемангиома любой локализации.
Среди глаз, удалённых по поводу внутриглазных опухолей, составляет 0,76%. Возраст больных 10-60 лет.
Не проводят.
Выделяют отграниченную и диффузную гемангиомы.
Врождённая опухоль типа гамартом.
Жалобы на снижение зрения ранний симптом гемангиомы у взрослых, у детей косоглазие. В хориоидее гемангиома представлена двумя клиническими формами.
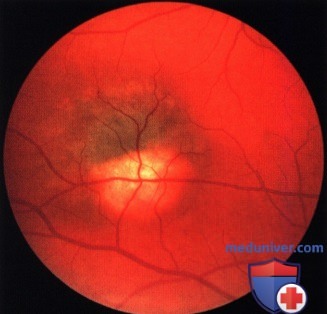
- Отграниченная гемангиома представлена одиночным узлом с чёткими границами, округлой или овальной формы, максимальный диаметр опухоли — 3-15 мм. Толщина опухоли — 1-6 мм. Окраска опухоли чаще светлая, цвет колеблется от беловато-серого до розово-красного (рис. 36-41).
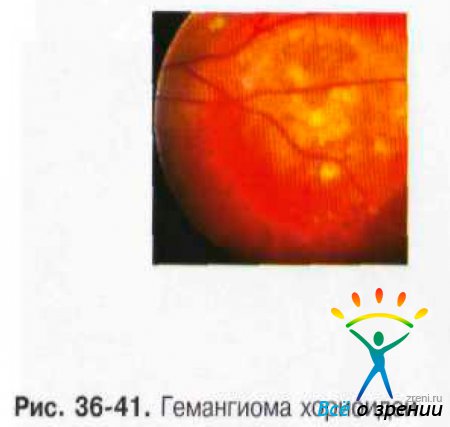
В трети случаев опухоль имеет тёмно-красный цвет с аспидным оттенком, что обусловлено пролиферацией ПЭС. Вторичную отслойку сетчатки наблюдают практически у всех больных, при больших, длительно существующих опухолях она становится пузыревидной. Калибр сосудов сетчатки, в отличие от меланомы хориоидеи, не меняется, на поверхности опухоли могут быть мелкие геморрагии. При слабо выраженном субретинальном экссудате кистовидная дистрофия сетчатки создаёт картину «ажурности» опухоли. Субретинальный экссудат иногда по толщине может значительно превышать толщину самой опухоли. Описаны случаи оссификации гемангиом.
- Диффузная гемангиома нередко сочетается с синдромом Стёрджа-Вебера (энцефало-фациальный ангиоматоз). Характерно красно-оранжевое окрашивание всей поверхности глазного дна до экватора, отслойка сетчатки с вторичными дистрофическими изменениями, диффузное утолщение хориоидеи выявляемое при УЗИ, ярко-красное свечение зрачка на стороне поражения.
Диагноз кавернозной гемангиомы труден. Клинико-гистологические расхождения достигают 18,5%.
Жалобы на снижение зрения.
- Исследование центрального и периферического зрения.
- Офтальмоскопия, биомикроофтальмоскопия.
- УЗИ.
- ФАГ.
Необходимо исключить беспигментную и слабопигментированную меланому хориоидеи, метастатический рак, задний склерит, серозную хориоретинопатию, дисциформную макулярную дегенерацию, центральную серозную ретинопатию и регматогенную отслойку сетчатки, у лиц молодого возраста – ретинобластому.
Ликвидация опухоли для предупреждения тотальной отслойки сетчатки.
Хирургическое лечение (брахитерапия, транспупиллярная термотерапия).
До 2 мес после локального лечения.
Показано динамическое наблюдение офтальмолога.
Для зрения неблагоприятный, для жизни хороший.
Злокачественная, быстрорастущая опухоль в хориоидее в результате гематогенного переноса опухолевых клеток из основного узла опухоли.
Частота метастазов в орган зрения достигает 6,5%. До 9% больных узнают о своём онкологическом заболевании от офтальмолога, а метастатический характер опухоли распознают при гистологическом исследовании, и только после этого начинают поиск первичного опухолевого узла.
В хориоидею метастазируют практически все злокачественные опухоли, чаще раки, кожные меланомы. Известно, что до 2,5% всех больных с метастатической болезнью к моменту смерти имеют внутриглазной метастаз. У 3,3% больных при обнаружении метастаза в хориоидее не удаётся выявить первичный узел.
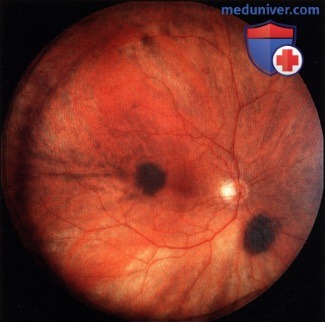
Характерен небольшой слегка проминирующий очаг беловато-розового или жёлтого цвета с нечёткими границами, локализующийся почти в 80% случаев между экватором и макулярной областью (рис. 36-42).
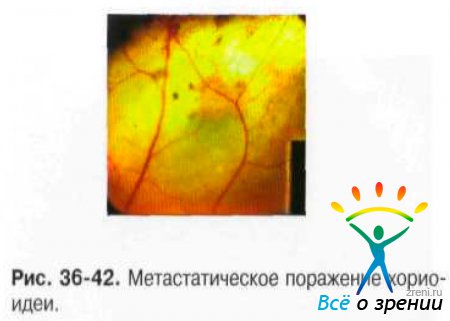
В начале заболевания толщина опухоли незначительна, но процесс прогрессирует быстро, и в течение нескольких месяцев, а иногда и недель может достигать 6-8 мм. Рано появляется вторичная отслойка сетчатки с большим количеством субретинальной жидкости. Многофокусность поражения наблюдают у 1/3 больных, чаще при билатеральном поражении. Плоские интенсивно пигментированные опухоли типичны для метастазов из кожной меланомы.
Жалобы па перемежающиеся метаморфопсии с последующим прогрессирующим ухудшением зрения. Процесс билатеральный в 29% случаев.
- Определение остроты зрения.
- Офтальмоскопия.
- Исследование глазного дна с цветными фильтрами: красным и зелёным.
- ФАГ.
Хориоидальные метастазы необходимо дифференцировать с отграниченной гемангиомой хориоидеи, беспигментным невусом, астроцитарной гамартомой, беспигментной и пигментированной меланомой, неспецифической гранулёмой, центральной серозной хориоидопатией, идиопатической склерохориоидальной кальцификацией, мультифокальной хориоидальной дистрофией, задним склеритом.
Паллиативное лечение опухоли, направленное на улучшение зрения.
Наружное облучение глаза.
Больной с гематогенными метастазами нетрудоспособен.
Показано динамическое наблюдение онколога и офтальмолога.
Для зрения временно хороший, для жизни неблагоприятный.
—
Статья из книги: Офтальмология. Национальное руководство | Аветисов С.Э.
Источник
Невус хориоидеи: признаки, гистология, лечение, прогнозМеланоцитарный невус хориоидеи – наиболее часто встречающаяся первичная внутриглазная опухоль, которой посвящено множество публикаций (1-42). Частота этого новообразования среди взрослых европеоидов составляет около 7% (3). Вероятно, невус хориоидеи является источником большинства меланом сосудистой оболочки (1, 4-7), что определяет актуальность этой патологи и ее вариантов для клиницистов.
а) Клиническая картина. Хотя невус хориоидеи может быть врожденным, он редко встречается у маленьких детей (1). Клетки-предшественники невуса могут присутствовать с рождения, но до пубертатного периода они клинически никак не проявляют себя, возможно, отчасти из-за того, что в этот период происходит накопление пигмента в изначально беспигментном новообразовании. Невус хориоидеи обычно впервые выявляется во взрослом возрасте, он может быть пигментным или амеланотическим, плоским или минимально выступать в стекловидную камеру. На основании результатов популяционного исследования Синей горы (Blue Mountain population-based study), Sumich et al. (3) установили, что невус хориоидеи был диагностирован у 7% европеоидов старше 49 лет, размеры невуса состав ляли в среднем 1,5 мм. В большом клиническом исследовании, выполненном Shields et al. (1), средний возраст пациентов с невусом хориоидеи, направлявшихся в центр онкологии глаза, составил 60 лет, средний размер невуса составил 5,5 мм. Большинство невусов хориоидеи имеют толщину менее 2 мм. Со временем на поверхности невуса появляются друзы. Приблизительно в 10% случаев развивается отслойка пигментного эпителия сетчатки (26, 27), хориоидальная неоваскуляризация на поверхности невуса встречается менее чем в одном проценте случаев (1, 36-39). Некоторые невусы хориоидеи имеют крупные размеры (> 10 мм в диаметре), но не сопровождаются другими факторами риска и поэтому классифицируются как гигантские невусы хориоидеи (14). Другим интересным симптомом является наличие вокруг невуса беспигментного кольца («halo», гало), встречающегося в 5% случаев невуса хориоидеи (13). Выявлена связь беспигментного кольца (гало) вокруг невуса с ранее диагностированной меланомой кожи, таким образом, не исключено, что гало развивается в результате аутоиммунной реакции. Кроме того, гало вокруг невуса является благоприятным прогностическим признаком, снижающим вероятность озлокачествления новообразования. Несколько работ посвящены оценке частоты роста или перерождения невуса в меланому (2-7). Математически частота развития меланомы из невуса хориоидеи оценивается как 1 на 8845 (7). Основные статистические факторы риска, позволяющие выявить подозрительную с точки зрения перерождения в меланому опухоль, включают в себя толщину опухоли более 2 мм, скопление субретинальной жидкости, наличие жалоб, появление на поверхности невуса оранжевого пигмента и локализация невуса в 3 мм от диска зрительного нерва или ближе (1, 4-6, 10). Недавно были выявлены дополнительные факторы, повышающие вероятность роста опухоли, в том числе акустическая пустота при ультразвуковом исследовании, отсутствие гало и друз (6). Считается, что увеличение размеров невуса хориоидеи с высокой вероятностью указывает на его озлокачествление и развитие меланомы. Однако некоторые невусы в течение многих лет могут демонстрировать медленный рост, около 1 мм или менее, и все же оставаться доброкачественными (12). Клинические примеры невуса хориоидеи:
КЛИНИЧЕСКИЕ ВАРИАНТЫ НЕВУСА ХОРИОИДЕИ
б) Диагностика. В последнее время в диагностике невуса хориоидеи были достигнуты заметные успехи. Изменения, наблюдаемые при флюоресцентной ангиографии, варьируют от гипофлюоресценции более мелких и более темных новообразований до более интенсивной гиперфлюоресценции более крупных менее пигментированных невусов. Диагностическое значение ультразвукового исследования невелико, но с его помощью можно измерять толщину невуса при первичном обследовании и позже в процессе наблюдения. Все шире применяется оптическая когерентная томография с увеличенной глубиной проникновения (enhanced depth imaging optical coherence tomography-EDI-OCT), она позволяет на ранней стадии заболевания выявлять такие факторы риска, как скопление субретинальной жидкости, кистозный отек сетчатки и отложения оранжевого пигмента на поверхности невуса (24-28). Исследование аутофлюоресценции чаще выполняется с целью выявления на поверхности невуса отложений оранжевого пигмента, которые также являются одним из прогностических факторов малигнизации (29-32). в) Патологическая анатомия. Гистологически невус хориоидеи образован высокодифференцированными веретеновидными, овоидными или округлыми меланоцитами с различной степенью выраженности пигментации цитоплазмы (33). Специфический клинико-гистологический вариант невуса-меланоцитома- обсуждается ниже. Вторичные изменения прилегающих структур (34) также описаны ниже в разделе, посвященном патологической анатомии меланомы заднего отдела сосудистой оболочки. г) Лечение. Типичный невус хориоидеи обычно не требует активного лечения. При первичном обследовании фотографируется глазное дно, исследуется аутофлюоресценция, выполняется ультразвуковое исследование и ОКТ с увеличенной глубиной проникновения (EDI-OCT), после чего пациент проходит контрольные обследования каждые полгода-год с целью ранней диагностики роста новообразования или выявления других факторов риска роста и метастазирования. При выявлении скопления субретинальной жидкости или хориоретинальной неоваскуляризации, вызывающих жалобы, применяются такие методы лечения, как лазерная фотокоагуляция, транспупиллярная термотерапия, фотодинамическая терапия или инъекция ингибиторов эндотелиального фактора роста сосудов (anti-vascular endothelial growth factor – anti-VEGF), позволяющие добиться резорбции субретинальной жидкости (1,36-39). Активное лечение показано при новообразованиях, демонстрирующих рост, или при наличии двух и более факторов риска роста или метастазирования; предполагается, что такое новообразование может оказаться ранней стадией меланомы (4-6), которую мы обсудим далее. д) Список использованной литературы: – Также рекомендуем “Меланоцитома диска зрительного нерва и сосудистой оболочки: признаки, гистология, лечение, прогноз” Редактор: Искандер Милевски. Дата публикации: 2.6.2020 |
Источник