Первичная цилиарная дискинезия синдром картагенера
Первичная цилиарная дискинезия (Primary ciliary dyskinesia, PCD) представляет собой генетически гетерогенное, обычно аутосомно-рецессивное расстройство, характеризующееся цилиарной дисфункцией и нарушенным мукоцилиарным клиренсом, что приводит к множеству клинических нарушений, включая хронический бронхит, ведущий к бронхоэктазам, хронический риносинусит, хронический средний отит, транслокацию внутренних органов (примерно в 50 % случаев) и мужское бесплодие. Частота PCD оценивается в 1:16000 новорожденных на основе распространенности зеркального расположения внутренних органов и образования бронхоэктазов. Однако у немногих пациентов с PCD диагноз подтвержден, так как данное заболевание трудно диагностируется. Первый случай этой патологии, о котором сообщалось в начале 1900-х годов, характеризовался триадой симптомов: хронический синусит, бронхоэктазы и неправильное расположение внутренних органов. Впоследствии она стала известна как синдром Картагенера. Некоторое время спустя у пациентов с синдромом Картагенера, а также у пациентов с хроническим синуситом и бронхоэктазами, отмечалось наличие «неподвижных» ресничек и дефектов в их организации. Первоначально для описания этого расстройства использовался термин «синдром неподвижной реснички»; однако более поздние исследования показали, что большинство ресничек сохраняли активность, но демонстрировали жесткий, нескоординированный и/или неэффективный ритм. Название было изменено на «первичную цилиарную дискинезию», чтобы более адекватно описать ее генетическую природу и цилиарную дисфункцию и отличить ее от вторичных цилиарных дисфункций, обусловленных повреждением мерцательного эпителия разного генеза. «Золотым стандартом» диагностических тестов для PCD был электронный микроскопический ультраструктурный анализ респираторных ресничек, полученных путем биопсии бронха. Недавние исследования выявили мутации в нескольких генах, кодирующих структурные и/или функциональные белки в ресничках. Измерение назальной концентрации оксида азота (NO) использовалось в качестве скринингового теста на PCD, поскольку назальный NO чрезвычайно низкий (10-20 % от нормы) у пациентов с PCD.
Нормальная структура подвижных ресничек
Ресничка и жгутик являются эволюционно древними органеллами, чьи структура и функция были неизменны в течении их филогенеза. Исторически признана их роль в подвижности клеток и переносе жидкостей через поверхности слизистой оболочки, также у ресничек недавна была обнаружена сенсорная функция. И подвижные, и сенсорные реснички состоят из высокоорганизованных структур микротрубочек и вспомогательных элементов. Микротрубочки, образованные из α- и β-мономеров тубулина, сконфигурированы в спиральные конфигурации протофиламентов. Периферические микротрубочки в типичной структуре (9+2 подвижных ресничек), усеянные динеиновыми ручками, которые содержат аденозинтрифосфатазы, действуют как молекулярные двигатели для осуществления скольжения периферических дуплетов микротрубочек относительно друг друга. Внешние динеиновые ручки (ODA) расположены ближе к мерцательной мембране, внутренние динеиновые ручки (IDA) расположены проксимально относительно центрального аппарата α-микротрубочек. Динеиновые ручки — это большие белковые комплексы, включающие несколько тяжелых, легких, и промежуточных цепей. Исследования изолированных аксонем, избавленных от вспомогательных структур, показали, что в присутствии аденозинтрифосфата пары микротрубочек скользят относительно друг друга до исчезновения видимого света. Считается, что некоторые вспомогательные структуры, в том числе звенья нексина, радиальные спицы и мерцательная мембрана обеспечивают силы сдвига, которые переводят скользящее действие в упругую характеристику мерцательной волны.
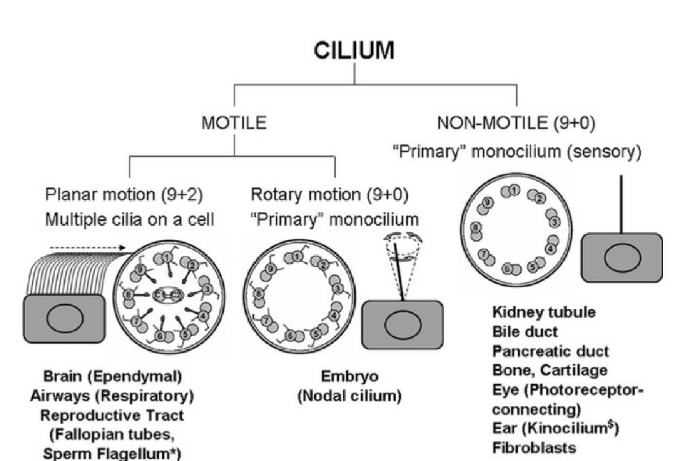
Рис. 1
Разнообразие аксонем различных ресничек. Локализация подвижных ресничек (9+2) — мозг (клетки нейроглии), воздухоносные пути, репродуктивный тракт (фаллопиевы трубы, жгутик сперматозоида); подвижных ресничек (9+0) — эмбрион. Локализация неподвижных ресничек (9+0) — почечные канальца, желчный проток, вирсунгов проток, глаз, ухо (киноцилии), фибробласты.
Генетика
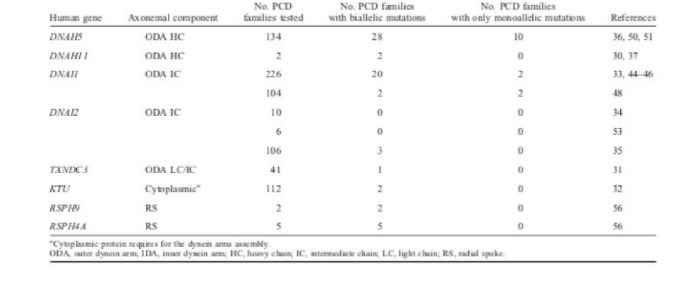
Дисфункция структуры аксонемы связана с классом расстройств, коллективно известных как «цилиопатии», который включает в себя: PCD / синдром Картагенера, синдром Барде — Бидля, гидроцефалия, поликистозное заболевание почек, поликистозное заболевание печени, нефронофтиз, синдром Меккеля — Грубера, синдром Жубера, синдром Альстрома, синдром Джеуна. PCD была первым человеческим расстройством, связанным с дисфункцией подвижных ресничек. До сих пор были идентифицированы мутации в девяти генах, являющихся причиной PCD (DNAI1, DNAH5, ДНКH11, ДНКI2, KTU, RSPH9, RSPH4A и TXNDC3, PIH1D3), но не были определены ассоциации генотипа/фенотипа.

Рис. 2
ODA — внешние динеиновые ручки, IDA — внутренние динеиновые ручки, HC — тяжелая цепь, LC — легкая цепь, IC — средняя цепь, CA — центральный аппарат.
Роль эпителиальных клеток воздухоносных путей у пациентов с PCD и CF (кистозный фиброз)
Эпителиальные клетки дыхательных путей создают несколько препятствий в защите против возбудителей. Секреция клеточных муцинов образует жидкий барьер; слизь необходима для захвата вредных патогенов и частиц. Кроме того, эпителиальные клетки дыхательных путей высвобождают антимикробные продукты и несколько провоспалительных хемокинов, таких как CXCL5/ENA-78, CXCL8/IL-8, монокристалл C-C лиганд 2 / моноцит-хемоаттрактант-белок-1 (CCL2/MCP-1) и CCL5/RANTES, для привлечения иммунных клеток. Несколько исследований показали, что P. aeruginosa стимулирует транскрипцию и чрезмерное производство нескольких цитокинов в эпителиальных клетках дыхательных путей. In vitro было установлено, что эпителиальные клетки дыхательных путей, несущие мутантный CFTR, продуцируют больше CXCL8/IL-8, IL-6 и гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) по сравнению с нормальным эпителием. Как упоминалось выше, CXCL8/IL-8 регулирует хемотаксическую миграцию нейтрофилов в место локализации инфекции, тогда как GM-CSF задерживает апоптоз нейтрофилов. Известно, что отсутствие или недостаток CFTR в эпителиальных клетках связаны с сокращением производства противовоспалительного медиатора IL-10 и оксида азота (NO). IL-10 и NO ингибируют ядерный фактор-κB (NF-κB), ядерный фактор транскрипции, который активирует экспрессию гена синтез провоспалительных цитокинов эпителиальными клетками дыхательных путей и макрофагами. Поэтому даже без экзогенной стимуляции эпителиальные клетки производят высокие уровни CXCL8/IL-8 и других провоспалительных цитокинов у пациентов с МВ. Индуцируемая NO-синтаза (NOS2) конститутивно экспрессируется эпителиальными клетками дыхательных путей. NO играет роль в защите организма, регулировании производства цитокинов и подвижности ресничек в респираторной системе. У пациентов с PCD и CF обнаружен более низкий уровень NO в конденсате выдыхаемого воздуха (EBC).
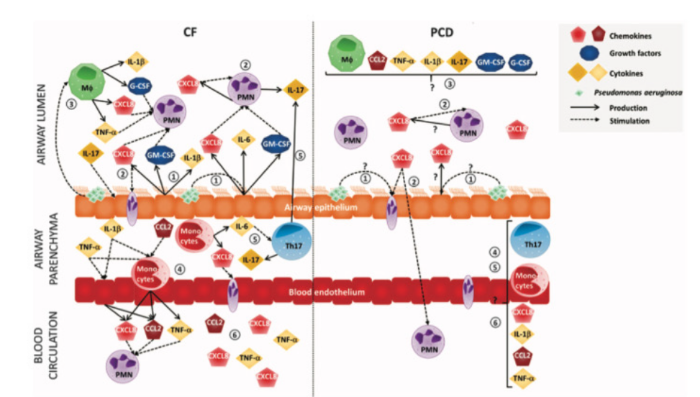
Рис. 3
Цитокины и хемоаттрактанты, способствующие воспалению нейтрофильных дыхательных путей при CF и PCD. На рисунке показана связь между воспалительными медиаторами и (иммунными) клетками в дыхательных путях и кровообращением пациентов с CF и PCD. Сплошные стрелки указывают на цитокины, тогда как пунктирные стрелки указывают на стимуляцию клеток цитокинами или патогенами. При CF эпителиальные клетки дыхательных путей, несущие дефектный канал CFTR, производят CXCL8, GM-CSF и IL-6 даже без внешних раздражителей. Кроме того, P. aeruginosa постоянно стимулирует эпителиальные клетки дыхательных путей для секреции высоких уровней провоспалительных цитокинов и хемоаттрактантов, таких как IL-1β, GMCSF и CXCL8 (1). Нейтрофилы (PMN) в легких при CF также продуцируют CXCL8 и IL-17 и, следовательно, усиливают их собственную активацию и притяжение к легким (2). Колонии P. aeruginosa провоцируют альвеолярные макрофаги (Mφ) для получения высоких концентраций G-CSF, TNF-α, IL-1β и CXCL8, увеличивая активность нейтрофилов (3). Моноциты с неисправными каналами CFTR менее эффективно перемещаются через в просвет дыхательных путей и накапливаются в паренхиме дыхательных путей. Эти моноциты выделяют большое количество провоспалительных медиаторов, например, CXCL8, CCL2, IL-6 и TNF-α, которые активируют нейтрофилы периферической крови (4). IL-6 способствует дифференцировке Th17 клеток в легких. В свою очередь клетки Th17 продуцируют высокие уровни IL-17, которые косвенно стимулируют миграцию и активацию нейтрофилов (5). Аналогичным образом, образование CXCL8 нейтрофилами или макрофагами в легких при PCD и его роль в активации нейтрофилов неизвестны.
Источники
- Leigh M. W. et al. Clinical and genetic aspects of primary ciliary dyskinesia/Kartagener syndrome // Genetics in Medicine. – 2009. – Т. 11. – №. 7. – С. 473.
- Cockx M. et al. Chemoattractants and cytokines in primary ciliary dyskinesia and cystic fibrosis: key players in chronic respiratory diseases //Cellular & molecular immunology. – 2018. – Т. 15. – №. 4. – С. 312.
- Olcese C. et al. X-linked primary ciliary dyskinesia due to mutations in the cytoplasmic axonemal dynein assembly factor PIH1D3 //Nature communications. – 2017. – Т. 8. – С. 14279.
Источник
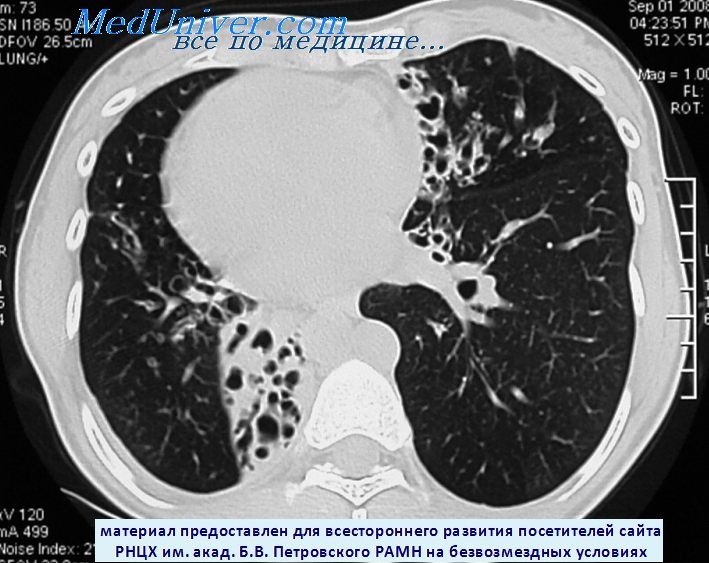
Причины, частота, диагностика и лечение синдрома Картагенера – цилиарной дискинезииПервичная цилиарная дискинезия, также известная под названиями «синдром неподвижных ресничек» или синдром Картагенера, является наследственным аутосомно-доминантным заболеванием, поражающим дыхательный тракт (включая полость носа и околоносовые пазухи), уши и половые органы. Мутации в двух генах приводят к возникновению структурных дефектов наружных деиновых структурах ресничек. В результате реснички оказываются неспособны совершать колебательные движения. Критерием диагностики этого заболевания является обнаружение структурных дефектов при электронной микроскопии. Из-за дисфункции ресничек нарушается нормальное эмбриональное развитие, что проявляется зеркальным расположением органов (situs inversus, транспозиция внутренних органов). Предсказать наличие данной аномалии невозможно, она встречается примерно у половины детей с первичной цилиарной дискинезией. Также может встречаться декстрокардия (правостороннее расположение сердца). а) Патофизиология и патогенез. Дисфункция ресничек приводит к застою слизи в легких, полости носа и околоносовых пазухах. Возможно развитие хронической или рецидивирующей пневмонии, бронхэктазов, риносинусита. б) Симптомы и клиника синдрома Картагенера. И хотя данное заболевание встречается крайне редко, его следует подозревать у детей с рецидивированием пневмонии и синуситов. Для этих пациентов типично хроническое нарушение носового дыхания, закупорка и застой. Попытки предшествующей антибиотикотерапии не дали результата. в) Диагностика. Для постановки диагноза первичной цилиарной дискинезии необходим высокий уровень подозрения, поскольку требуется проведение специальных тестов. На рентгенограмме органов грудной клетки может определяться декстрокардия, которая хоть и повышает вероятность диагноза, но не гарантирует его. Для диагностики используются биопсии слизистой с последующей электронной микроскопией, на которой определяются характерные деформации ресничек. Наиболее часто биопсия берется со слизистой полости носа, трахеи и бронхов. В полости носа и в легких могут обнаруживаться участки со сниженным количеством ресничек (следствие хронического бактериального воспаления). Более предпочтительным методом забора тканей на исследование является соскоб в полости носа при помощи биопсийной бронхиальной щеточки. При помощи данного метода с большей долей вероятности будет забрано необходимое количество материала для исследования, допустимо выполнение в амбулаторных условиях, общей анестезии не требуется. Для постановки окончательного диагноза необходимо обнаружение характерных аномалий при электронной микроскопии, а также наличие в анамнезе рецидивирующих пневмоний и синуситов. г) Лечение цилиарной дискинезии. Преимущественно симптоматическое. Также выполняется хирургическое расширение соустий околоносовых пазух.
– Также рекомендуем “Причины, частота, диагностика и лечение юношеской ангиофибромы носоглотки” Оглавление темы “Болезни носа, горла у детей”:
|
Источник
1. 2017 European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia Eur Respir J. 2017 Jan 4;49(1):1-25
Статья подготовлена д.м.н., проф. Самородской И.В.
Согласно рекомендациям – первичная цилиарная дискинезия (ПЦД) – клинически и генетически гетерогенная группа респираторных цилиопатий с уменьшенным мукоцилиарным клиренсом дыхательных путей. Различные мутации приводят к различным клиническим и патологическим проявлениям, что обуславливает проблемы с диагностикой. Нет единственного стандартного исследования для диагностики ПЦД. Установление диагноза требует сочетания технически сложных исследований.
Резюме рекомендаций
Каких пациентов следует направлять на диагностическое тестирование?
Основываясь на умеренной уверенности в доказательствах эксперты рекомендуют провести исследования на выявление ПЦД, если у пациента есть несколько из следующих признаков:
- постоянный влажный кашель;
- аномалии расположения органов;
- врожденные пороки сердца;
- стойкий ринит;
- хроническая болезнь среднего уха с или без потери слуха;
- наличие в анамнезе с младенческого возраста респираторных заболеваний верхних и нижних дыхательных путей или применения интенсивной терапии в период новорожденности (сильная рекомендация).
Братья и сестры пациентов с ПЦД должны быть обследованы на наличие ПЦД, особенно если у них есть соответствующие симптомы (сильная рекомендация).
Для идентификации пациентов, которым следует провести соответствующее диагностическое тестирование рекомендуется использовать клинические симптомы и прогностические инструменты (например, PICADAR) (слабая рекомендация).
Следует ли использовать измерение уровня оксида азота в выдыхаемом назальном воздухе (nNO) в качестве диагностического инструмента при подозрении на наличие ПЦД?
Основываясь на умеренной уверенности в доказательствах эксперты рекомендуют оценивать уровень nNO при подозрении на ПЦД как часть диагностики:
- у детей в возрасте > 6 лет и взрослых, предпочтительно с использованием хемилюминесцентного анализатора с использованием метода «velum closure techniques» (сильная рекомендация).
- у детей в возрасте
Если результаты теста нормальные, но у пациента есть клинические данные в пользу заболевания, то рекомендуется продолжить обследование, даже если результаты nNO являются нормальными (слабая рекомендация).
nNO является высокоточным тестом для диагностики ПЦД, если используется стационарный хемилюминесцентный анализатор с использованием метода «velum closure techniques» с чувствительностью 0,90-1,0 и специфичностью 0,75-0,97. Другие методики или использование переносных анализаторов менее чувствительны и специфичны. В разных исследованиях использовались разные методы и значения критерия «норма/патология», что затрудняет определение пороговых значений.
Следует ли использовать высокоскоростной видеоанализ в качестве диагностического инструмента при подозрении на наличие ПЦД?
Основываясь на низкой достоверности доказательств, эксперты рекомендуют:
- Высокоскоростной видеоанализ (оценка высокоскоростного видеофильмирования) использовать как часть диагностического процесса при подозрении на ПЦД (слабая рекомендация).
- Оценку двигательной активности ресничек не следует использовать без оценки модели движения ресничек при диагностике ПЦД (сильная рекомендация).
Высокоскоростной видеоанализ – это точный тест для ПЦД, если его проводят опытные исследователи, сочетающие оценку двигательной активности ресничек с анализом частоты и модели движения (чувствительность 0,95-1,00 и специфичность 0,93-0,95). В то же время метод недостаточно стандартизован для того, чтобы им можно было пользоваться как самостоятельным методом диагностики ПЦД. Высокоскоростной видеоанализ должен выполняться опытным персоналом в рамках процесса диагностики .
Следует ли использовать трансмиссионную электронную микроскопия (ТЭМ) в качестве диагностического инструмента при подозрении на наличие ПЦД?
Основываясь на низкой достоверности доказательств, эксперты рекомендуют:
- Использовать ТЭМ как часть диагностического процесса (сильная рекомендация).
- Дальнейшие диагностические исследования должны проводиться у пациентов с нормальной ультраструктурой, если есть клинические данные за ПЦД (сильная рекомендация).
- У пациентов с характерными признаками нарушения цилиарной ультраструктуры дальнейшие подтверждающие диагностические исследования не требуются (сильная рекомендация).
ТЭМ является очень специфическим тестом для подтверждения диагноза и является ключевым элементом диагностики. Однако у некоторых пациентов с ПЦД, по-видимому, может быть нормальная ультраструктура, и поэтому ТЭМ не следует использовать изолированно для того, чтобы исключить диагноз.
Следует ли использовать генетические исследования в качестве диагностического инструмента при подозрении на наличие ПЦД?
Не было проведено исследований, по результатам которых можно было бы дать ответ на вопрос: следует ли использовать генотипирование в качестве диагностического инструмента при подозрении на ПЦД.
Следует ли использовать методы иммунофлуоресценции в качестве диагностического инструмента при подозрении на наличие ПЦД?
Не было проведено исследований, по результатам которых можно было бы дать ответ на вопрос: следует ли использовать методы иммунофлуоресцентного анализа в качестве диагностического инструмента при подозрении на ПЦД. Эксперты считают, что иммунофлюоресценция может быть полезна, иммунофлуоресцентные методы дешевле и проще, чем другие диагностические тесты, обеспечивая потенциальную пользу в условиях ограниченных ресурсов.
Критерии установления диагноза ПЦД
Следующие результаты подтверждают диагноз ПЦД:
- Типичные для данного заболевания ультраструктурные дефекты при проведении ТЭМ.
- Недвусмысленные биаллельные мутации в генах, вызывающих ПЦД.
Целевая группа не достигла консенсуса (80%), что любое другое исследование, выполненное в качестве единственного теста или в комбинации с другим могло бы свидетельствовать об убедительном диагнозе.
Диагноз весьма вероятен:
у пациентов с наличием соответсвующего анамнеза ПЦД следующие результаты диагностических тестов делают диагноз ПЦД весьма вероятным, но не доказывают наличие ПЦД.
- Очень низкий уровень nNO в сочетании с изменениями, выявленными при высокоскоростном видеоанализе.
- Очень низкие значения nNO в сочетании с изменениями, выявленными при высокоскоростном видеоанализе, согласующиеся с вероятностью ПЦД после культивирования клеток.
Если диагноз «очень вероятен», но не является окончательным, пациентам следует сообщить, что диагноз вероятен, но с учетом ограничений диагностических тестов, диагноз не является 100% определенным и может потребовать подтверждения, когда лучшие методы исследования станут доступными. Следует исключить другие причины имеющихся клинических симптомов, в то же время пациентов следует лечить в таких случаях также как ПЦД. По мере появления новых диагностических тестов необходимо провести дополнительные исследования
Исключение диагноза ПЦД
Эксперты не достигли консенсуса (80%) в вопросе о том, что любое отдельное исследование или их комбинация не могут исключить диагноз ПЦД. Однако, основываясь на доказательствах, они согласились с тем, что существуют условия, при которых диагноз «крайне маловероятен» (если клинические симптомы небольшие/умеренные, nNO является высоким/нормальным, результаты высокоскоростного видеоанализа нормальные). Пациенту можно сказать, что диагноз крайне маловероятен и что дальнейшее тестирование не оправдано. Если клиническое симптомы указывают на высокую вероятность диагноза (например, синдром Картагенера, оценка PICADAR ≥ 10),следует иметь ввиду, что перечисленные диагностические тесты недостаточно точны для того, чтобы исключить диагноз.
Эксперты считают, что диагностические тесты должны проводиться только в лабораториях, имеющих опыт работы в этой области. Результаты должны интерпретироваться специалистами, имеющими опыт в области ПЦД. Диагностические тесты для диагностики ПЦД в настоящее время несовершенны. По мере того, как будут улучшаться методы диагностики и лечения ПЦД, пациентам с высокой вероятностью наличия заболевания по клиническим признакам, но неубедительными результатами исследований может быть предложено повторное обследование. Ряд пациентов имеют диагностические тесты, которые не удовлетворяют критериям положительного диагноза. Целесообразно, чтобы этих пациентов наблюдал и лечил специалист, имеющим опыт в области ПЦД.
Источник