Респираторный дистресс синдром у плода
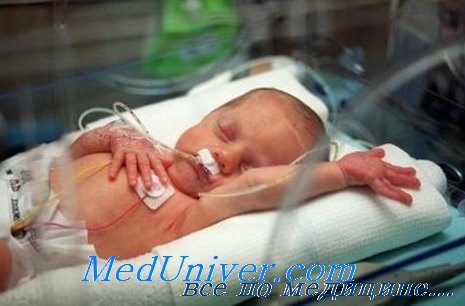
Респираторный дистресс-синдром (РДС) у недоношенных детей
Синдром дыхательных расстройств или «респираторный дистресс-синдром» новорожденного представляет собой расстройство дыхания у недоношенных детей в первые дни жизни, обусловленное первичным дефицитом сурфактанта и незрелостью легких. Это один из самых распространенных диагнозов у детей, родившихся на сроке менее 34 недель гестации. РДС является наиболее частой причиной возникновения дыхательной недостаточности в раннем неонатальном периоде у новорожденных. Встречаемость его тем выше, чем меньше гестационный возраст и масса тела ребенка при рождении.
Причины развития РДС у новорожденных
Основные причины развития РДС у новорожденных – это нарушение образования в альвеолах легких специального вещества – сурфактанта, связанное с функциональной и структурной незрелостью легочной ткани. Сурфактант представляет собой природное вещество, состояще из фосфолипидов и четырех видов белка, которое покрывает стенки дыхательных пузырьков – альвеол.
Легкие плода до родов находятся в спавшемся состоянии , легочные пузырьки – альвеолы напоминают сдувшиеся воздушные шарики. После рождения ребенок делает первый вдох, легкие расправляются и из сдувшихся шарики должны превратиться в надутые. Однако все структуры легких у малышей с массой тела менее 1500 г при рождении незрелые. Они менее воздушные и более полнокровные, а самое главное, в них отмечается недостаток сурфактанта.
Развитие дыхательных нарушений связано с тем, что несмотря на активное дыхание, у ребенка не хватает сил, чтобы расправить спавшиеся альвеолы. При возникновении респираторного дистресс синдрома у ребенка появляется одышка, возникающая в возрасте от первых минут до первых часов жизни, может отмечаться «стонущее дыхание» за счет компенсаторного спазма голосовой щели на выдохе. Дыхательные нарушения проявляются западением грудной клетки на вдохе (втягивание мечевидного отростка грудины, подложечной области, межреберий, надключичных ямок), которые могут сопровождаться возникновением напряжения крыльев носа, раздувания щек (дыхание «трубача»); может отмечаться цианоз (синюшность кожных покровов прежде всего в области дистальных отделов конечностей – ладошек и стоп и носогубного треугольника) при дыхании воздухом с нарастающей потребностью в дополнительной подаче кислорода.
Рентгенологическая картина РДС зависит от тяжести заболевания – от небольшого уменьшения пневматизации до «белых легких». Характерными признаками являются: диффузное снижение прозрачности легочных полей, ретикулогранулярный рисунок и полоски просветлений в области корня легкого (воздушная бронхограмма).
Профилактика и лечение РДС у недоношенных детей
При угрозе преждевременных родов на 32 неделе гестации и менее беременная женщина должна быть госпитализирована в акушерский стационар III уровня (в перинатальный центр), где имеется отделение реанимации новорожденных. Риск развития РДС тем выше, чем более недоношенным рождается ребенок. Но этот риск можно снизить. Для этого всем беременным женщинам на сроке гестации 23-34 недели при угрозе преждевременных родов проводят курс гормональной терапии кортикостероидами для профилактики РДС недоношенных и снижения риска возможных неблагоприятных осложнений у ребенка таких, как ВЖК и НЭК. Возможны две альтернативные схемы пренатальной профилактики РДС: Бетаметазон – 12 мг внутримышечно через 24 часа, всего 2 дозы на курс; или Дексаметазон – 6 мг внутримышечно через 12 часов, всего 4 дозы на курс. Стероидные гормоны ускоряют созревание легких у плода. Максимальный эффект терапии развивается спустя 24 часа после начала терапии и продолжается неделю. К концу второй недели эффект от терапии стероидами значительно снижается. Повторный курс профилактики РДС рекомендован только спустя 2-3 недели после первого в случае повторного возникновения угрозы преждевременных родов на сроке беременности менее 33 недель.
Профилактически уже в первые 20 минут жизни всем детям, родившимся на сроке гестации 26 недель и менее при отсутствии проведения их матерям полного курса антенатальной профилактики стероидами проводится введение сурфактанта в легкие. Также сурфактант в родильном зале вводится всем новорожденным гестационного возраста ≤ 30 недель, потребовавшим интубации трахеи в родильном зале. Наиболее эффективное время введения первые 20 минут жизни. Недоношенным детям гестационного возраста > 30 недель, потребовавшим интубации трахеи в родильном зале при сохраняющейся зависимости от FiО2 > 0,3-04. Наиболее эффективное время введения – первые два часа жизни. Недоношенным детям на стартовой респираторной терапии методом СРАР в родильном зале при потребности в FiО2 ≥ 0,5 и более для достижения SpО2 = 85% к 10 минуте жизни и отсутствии регресса дыхательных нарушений, а так же улучшения оксигенации в последующие 10-15 минут.
В неонатологии используют сурфактант, получаемый из легких животных, свиней или коров. Вещество проходит тщательную очистку от любых инфекционных агентов (вирусов, бактерий), в также специфических животных белков, что исключает развитие аллергических реакций. Сурфактант представляет собой белый раствор, который вводится через трубочку прямо в легкие ребенка. Он быстро распространяется по всем дыхательным путям и буквально на глазах увеличивает насыщение крови кислородом. В некоторых случаях ребенок нуждается в двухкратном или даже трехкратном введении сурфактанта.
Повторное введение сурфактанта с лечебной целью рекомендовано: детям гестационного возраста ≤35 недель на СРАР, уже получившим первую дозу сурфактанта, при переводе их на искусственную вентиляцию легких в связи с нарастанием дыхательных нарушений
Недоношенным, родившимся на сроке гестации 32 недели и менее в случае отсутствия дыхания или при нерегулярном дыхании в первые 20 секунд проводится продленный вдох для наиболее эффективного расправления альвеол и формирования функциональной остаточной емкости легких. После восстановления спонтанного дыхания проводится респираторная терапия с положительным давлением в дыхательных путях методом СРАР (Сontinuous Positive Airway Pressure), что помогает поддерживать легкие в расправленном состоянии даже когда ребенок делает выдох.
Искусственная вентиляция легких у недоношенных проводится при сохраняющейся на фоне респираторной терапии нерегулярности сердцебиения иили отсутствии самостоятельного дыхания.
Потребность в дополнительной оксигенации до 45-50%, а так же в высоком давлении к концу вдоха у недоношенных новорождённых является показанием для перевода на высокочастотную осцилляторную вентиляцию легких (ВЧОВЛ).
Высокочастотная ИВЛ – это особый, высокотехнологичный метод проведения искусственной вентиляции легких. При ВЧОВЛ отсутствуют привычные дыхательные движения, так как здесь не происходит привычного вдоха и выдоха. Газообмен обеспечивается за счет высокочастотных колебаний воздушной смеси – осцилляций. При этом можно увидеть, как грудная клетки ребенка колеблется. Преимуществом такой респираторной терапии является то, что газообмен в легких происходит практически непрерывно, что необходимо в тех случаях когда легкие ребенка очень незрелые и ли в них имеется воспалительный процесс.
При ВЧО ИВЛ за счет стабилизации объема альвеол происходит уменьшение ателектазов (участков слипания легочных альвеол), увеличение площади газообмена и улучшение легочного кровотока. В результате правильно проводимой терапии достигается уменьшение вентиляционно-перфузионного соотношения, уменьшается потребность в высокой концентрации кислорода. При этом уменьшается дыхательный объем, снижается перерастяжение легких и уменьшается риск повреждения легких за счет баро – и волюмотравмы.
Источник
Оглавление темы “Лечение угрожающих и начинающихся преждевременных родов. Ведение преждевременных родов.”:
1. Лечение угрожающих и начинающихся преждевременных родов. Cредства снижающие активность матки. Токолитики. Показания и противопоказания к использованию токолитиков.
2. Побочные действия токолитиков. Осложнения от токолитиков. Оценка результатов токолиза. Этанол как токолитик.
3. Атозибан, НПВС ( нестероидные противовоспалительные средства ), нифедипин, нитроглицерин при преждевременных родах.
4. Лечение бактериального вагиноза во время беременности и при преждевременных родах. Электрорелаксация матки.
5. Иглоукалывание при преждевременных родах. Чрескожная электростимуляция при угрозе преждевременных родов.
6. Профилактика респираторного дистресс-синдрома (РДС) при преждевременных родах. Кортикостероидная ( глюкокортикоидная ) терапия при угрозе преждевременных родов. Противопоказания к гормональной терапии.
7. Ведение преждевременных родов. Факторы риска при преждевременных родах. Коррекция родовой деятельности при ее аномалиях.
8. Ведение быстрых или стремительных преждевременных родов. Профилактика родового травматизма плода.
9. Оперативные вмешательства при преждевременных родах. Реанимационные мероприятия при преждевременных родах. Внутричерепные кровоизлияния у недоношенных.
10. Ведение преждевременных родов при преждевременном разрыве плодных оболочек. Диагностика виутриматочной инфекции.
Профилактика респираторного дистресс-синдрома (РДС) при преждевременных родах. Кортикостероидная ( глюкокортикоидная ) терапия при угрозе преждевременных родов. Противопоказания к гормональной терапии.
При угрозе преждевременных родов неотъемлемой частью терапии должна быть профилактика респираторного дистресс-синдрома у новорожденных назначением глюкокор-тикоидных препаратов, которые способствуют синтезу сур-фактанта и более, быстрому созреванию легких плода.
Сурфактант (смесь липидов и белков) синтезируется в больших альвеолах, покрывает их; он способствует открытию альвеол и препятствует их коллапсу при вдохе. При сроке беременности 22-24 нед сурфактант продуцируется с участием метил-трансферазы, с 35-й недели внутриутробной жизни он осуществляется с участием фосфохолилтрансферазы. Последняя система более устойчива к ацидозу и гипоксии,
Беременным па курс лечения назначают 8-12 мг дексаметазона (по 4 мг 2 раза в сутки внутримышечно 2-3 дня или в таблетках по 2 мг 4 раза в сутки в 1-й день, по 2 мг 3 раза во 2-й день, по 2 мг 2 раза в 3-й день).
Применение дексаметазона с целью ускорения созревания легких плода имеет смысл при продолжении терапии в течение 2-3 суток. Поскольку не всегда удается предупредить развитие преждевременных родов, кортикостероиды следует назначать всем беременным, которым вводят токолитики. Кроме дексаметазона, можно использовать преднизалон в дозе 60 мг в сутки в течение 2 дней,

По данным Национального института здоровья США (Hayward P.E., Diaz-Rosselln J.L., 1995;” Grimes D.A., 1995; Crowley P.A., 1995), достигнут консенсус по использованию кортикостероидов с целью профилактики РДС при угрозе преждевременных родов.
При сроке беременности 24-34 иед с этой целью рекомендуется 5 мг дексаметазона вводить внутримышечно через 12 ч 4 раза. Если, несмотря на терапию, угроза преждевременных родов сохраняется, то целесообразно терапию глюкокор-тикоидами повторить через 7 дней. На основании проведен ных исследований респираторный дистресс-синдром и неона-тальная смертность уменьшились па 50%, снизилось количество внутрижелудочковых кровоизлияний. Эффект при преждевременном разрыве плодных оболочек отсутствовал, если после введения глюкокортикоидов проходило менее 24 ч или в том случае, когда родоразрешение проводили через 7 дней после введения глюкокортикоидов, а также при сроке беременности более 34 иед.
После введения бетаметазона (12 мг через 24 ч) установлено снижение частоты сердечных сокращений у плода, двигательной активности плода и дыхательных движении. Указанные изменения возвращаются к исходным данным на 2-ой день и указывают на физиологический ответ плода на стероидную терапию (Mulder Е.П. etal., 1997; Magel LA. el al., 1997).
По данным S.Chapman ct al. (1996), кортикостероидная терапия неэффективна при преждевременном разрыве оболочек и массе плода менее 1000 г. При наблюдении за детьми до 12 лет, матери которых с профилактической целью получали кортикостероиды, не выявлено их отрицательного влияния на интеллектуальное развитие ребенка, их поведение, моторную и сенсорную функции.
Противопоказаниями к глюкокортикоидной терапии являются язвенная болезнь желудка и двенадцатиперстной кишки, недостаточность кровообращения III степени, эндокардит, нефрит, активная фаза туберкулеза, тяжелые формы диабета, остеопороз, тяжелая форма гестоза, открытие шейки матки более 5 см, наличие признаков инфекции. При противопоказаниях к применению глюкокортикоидов можно использовать эуфиллин в дозе 10 мл 2,4% раствора в 10 мл 20% раствора глюкозы в течение 3 дней.

Лазолван (амбраксол) не уступает по эффективности глюкокортикоидным препаратом и практически не имеет противопоказаний. Используется в дозе c 800-1000 мг в сутки в течение 5 дней внутривенно капельно.
D.В.Knight et al. (1994) с целью профилактики РДС у плода при угрозе преждевременных родов вводили внутривенно 400 мг тиреотропного рилизинг-гормона отдельно или в комбинации с бетаметазоном и получили положительные результаты. Однако С.A. Crowther et al. (1995) подобных результатов не выявили.
Для профилактики РДС используют сурфактант по 100 ЕД внутримышечно 2 раза в сутки в течение 3-х дней. При необходимости указанные дозы повторяют через 7 дней. Профилактика РДС эффективна при сроках беременности 28-33 нед: в более ранние сроки требуется более длительное использование препарата.
В тех случаях, когда нет возможности пролонгировать беременность, сурфактаит необходимо использовать для лечения РДС у новорожденного.
Что касается профилактического применения ампициллина и метронидазола при преждевременных родах, то при рандомизированном многоцентровом исследовании установлено пролонгирование беременности, снижение частоты оказания интенсивной помощи новорожденным, но материнская и не-онатальная инфекционная заболеваемость не снизились (SvareJ.ctaL, 1997).
– Также рекомендуем “Ведение преждевременных родов. Факторы риска при преждевременных родах. Коррекция родовой деятельности при ее аномалиях.”
Источник
Причины респираторного дистресс-синдрома (РДС) у доношенных новорожденных. Особенности
У новорождённых с нарушениями дыхания развиваются следующие признаки респираторного дистресса:
• Тахипноэ (<60 в минуту).
• Затруднённое дыхание с западением грудной клетки (особенно впадение грудинных и субкостальных промежутков) и расширением ноздрей.
• Стонущее дыхание на выдохе.
• В тяжёлых случаях цианоз.
Причины респираторного дистресс-синдрома у рождённых в срок младенцев перечислены ниже.
I. Типичные легочные причины респираторного дистресс-синдрома у новорожденных: рранзиторное тахипноэ новорождённых
II. Менее типичные легочные причины респираторного дистресс-синдрома у новорожденных:
– Аспирация мекония
– Пневмония РДС
– Пневмоторакс
– ПЛГН
– Аспирация молока
III. Редкие легочные причины респираторного дистресс-синдрома у новорожденных:
– Диафрагмальная грыжа
– ТЭС
– Гипоплазия лёгких
– Обструкция дыхательных путей, например атрезия хоан
– Лёгочное кровотечение
IV. Внелёгочные причины респираторного дистресс-синдрома у новорожденных:
– Врождённые пороки сердца
– Внутричерепная родовая травма / энцефалопатия
– Тяжёлая анемия
– Метаболический ацидоз

Младенцы с этими нарушениями должны быть помещены в неонатальное отделение для мониторинга сердечного и дыхательного ритма, оксигена-ции и кровообращения. Рентгенография грудной клетки может потребоваться в целях установления причин, требующих немедленной терапии, например пневмоторакса или диафрагмальной грыжи. Дополнительное поступление кислорода извне, механическая вентиляция и поддержка кровообращения применяются по мере необходимости.
Транзиторное тахипноэ новорождённых как причина респираторного дистресс-синдрома (РДС). Это наиболее распространённая причина РДС новорождённых, рождённых в срок. Она возникает в результате задержки резорбции жидкости в лёгких и наиболее часто наблюдается у детей, родившихся посредством кесарева сечения. На рентгенограммах грудной клетки выявляется жидкость в горизонтальной борозде. Может потребоваться поступление кислорода извне. Этот диагноз устанавливается после оценки и исключения всех остальных причин.
Аспирация мекония как причина респираторного дистресс-синдрома (РДС). Меконий выделяется до рождения у 8-20% младенцев. Он редко формируется у недоношенных младенцев, и его образование прямо пропорционально гестационному возрасту, выявляясь в 20-25% случаев при родах на сроке родов 42 нед. Он может выделяться в ответ на гипоксию плода. При рождении эти младенцы могут ингалировать твёрдый меконий.
При асфиксии младенцы могут начать задыхаться и аспирировать меконий до рождения. Меконий раздражает лёгкие и приводит как к механической обструкции, так и к химическому пневмониту, равно как и предрасполагает к инфицированию. При аспирации мекония лёгкие перерастянуты, вперемешку с участками коллапсов и уплотнений. Имеется высокая распространённость утечки воздуха, приводящая к пневмотораксу и пневмомедиастинуму. Часто требуется ИВЛ.
У младенцев с аспирацией мекония может развиваться персистирующая лёгочная гипертензия новорождённых (ПЛГН), которая может создавать сложности для адекватной оксигенации несмотря на высокое давление вентиляции (см. ниже). Тяжёлая аспирация мекония сопровождается высокой распространённостью патологии и смертности.
Пневмония как причина респираторного дистресс-синдрома (РДС). Длительный разрыв плодных оболочек, хорионамнионит и НВР предрасполагают к пневмонии. Новорождённым с РДС обычно требуется обследование для выявления любой инфекции. Начинают раннее введение антибиотиков широкого спектра действия до того, как будут получены результаты инфекционного обследования.
Пневмоторакс как причина респираторного дистресс-синдрома (РДС). Пневмоторакс может развиваться спонтанно до 2% родов. Он обычно бессимптомный, однако может вызывать респираторный дистресс-синдром. Пневмоторакс также происходит вторично по отношению к аспирации мекония, РДС или как осложнение ИВЛ. Лечение описано в соответствующей главе.
Аспирация молока как причина респираторного дистресс-синдрома (РДС). Это происходит чаще у недоношенных младенцев и у имеющих респираторный дистресс-синдром или неврологические повреждения. У младенцев с БПД часто наблюдается ГЭР, который создаёт предпосылки для аспирации. Младенцы с «волчьей пастью» имеют склонность к аспирации респираторных секретов или молока.
Персистирующая лёгочная гипертензия новорождённых (ПЛГН) как причина респираторного дистресс-синдрома (РДС). Это жизнеугрожающее состояние обычно связано с асфиксией в родах, аспирацией мекония, септицемией или РДС. Иногда оно развивается как первичное заболевание. В результате высокого сопротивления легочных сосудов имеется право-левый сброс в лёгких и на уровне предсердий и протока.
Цианоз развивается вскоре после рождения. Сердечные шумы и признаки сердечной недостаточности часто отсутствуют. На рентгенограмме грудной клетки выявляется нормальный размер сердца и может присутствовать лёгочная олигемия. Необходимо проведение экстренной ЭхоКГ для установления, что у ребёнка отсутствуют врождённые пороки сердца.
Большинству младенцев требуются механическая вентиляция и поддержка кровотока в целях достижения адекватной оксигенации. Ингаляция оксида азота, потенциального вазодилататора, часто приносит улучшение. Другой вазодилататор, силденафил, стал применяться недавно. Иногда помогает высокочастотная или осциллирующая вентиляция.
Экстракорпоральная мембранная оксигенация (ЭКМО), когда ребёнку проводится шунтирование сердца и лёгких в течение нескольких дней, показана в тяжёлых случаях, однако проводится лишь в некоторых специальных центрах.
Диафрагмальная грыжа как причина респираторного дистресс-синдрома (РДС). Патология выявляется приблизительно у 1 из 4000 новорождённых. В настоящее время во многих случаях диафрагмальная грыжа диагностируется при антенатальном УЗИ. В период новорождённое™ она обычно проявляется РДС. В большинстве случаев происходит левостороннее выбухание содержимого брюшной полости через заднелатеральное отверстие в диафрагме.
Пульсация верхушки сердца и сердечные тоны могут быть смещены в правую часть грудной клетки, снижена вентиляцией левого лёгкого. Неумелая реанимация может вызвать пневмоторакс в нормальном лёгком, таким образом, способствуя ухудшению ситуации. Диагноз подтверждается рентгенографией грудной клетки и живота. При предположении этого диагноза вводится широкая назогастральная трубка и проводится аспирация для предотвращения растяжения внутригрудной части кишечника.
После стабилизации диафрагмальная грыжа устраняется хирургически, однако у большинства новорождённых с этим состоянием основной проблемой является гипоплазия лёгких — когда сдавление грыжевым содержимым (из внутренних органов) во время беременности нарушило развитие лёгких у плода. Если имеется гипоплазия лёгких, смертность высока. Для дыхательной поддержки применяется до- и постоперационная ЭКМО.
Другие причины респираторного дистресс-синдрома (РДС). Другие причины РДС перечислены выше. Если он связан с сердечной недостаточностью, на аускультации могут выслушиваться патологические сердечные тоны и/или сердечные шумы. Полезным признаком является увеличение печени вследствие венозного застоя.
Необходимо пропальпировать бедренные артерии у всех младенцев с РДС, поскольку коарктация аорты и коарктация дуги аорты являются значимыми причинами сердечной недостаточности у новорождённых.
– Также рекомендуем “Причины инфекции у новорожденных. Определяемся”
Оглавление темы “Особенности недоношенных новорожденных”:
- Проблемы новорожденных с очень низким весом при рождении (ОНВР). На что обратить внимание?
- Причина желтухи у новорожденного младенца. Как определить?
- Лечение желтухи у новорожденного ребенка. Рекомендации
- Причины респираторного дистресс-синдрома (РДС) у доношенных новорожденных. Особенности
- Причины инфекции у новорожденных. Определяемся
- Инфицирование новорожденного стрептококком группы В. Причины
- Инфицирование новорожденного моноцитогенной листерией. Причины
- Конъюнктивит, пупочные инфекции новорожденного. Причины
- Инфицирование новорожденного вирусом простого герпеса (ВПГ), гепатитом В. Причины
- Причины судорог у новорожденных. Неонатальные судороги
Источник
