Сердце плода при синдроме дауна

Хорошо известно, что врожденные аномалии сердца встречаются почти у половины детей с синдромом Дауна и оказывают большое влияние на младенческую выживаемость. С середины прошлого столетия проводилось множество исследований по выявлению частоты, специфичности и характера пороков сердца у этих детей. Так, в период 1970–1980-х гг. отмечалось повышение распространенности врожденных аномалий сердечнососудистой системы у пациентов с синдромом Дауна. Связано это было в основном с улучшением диагностики открытого артериального протока и дефекта межпредсердной перегородки (M. J. Khoury, J. D. Erickson, 1992). По данным зарубежных авторов, при синдроме Дауна наиболее часто встречаются дефект межжелудочковой перегородки, дефект межпредсердной перегородки, общий открытый атриовентрикулярный канал, тетрада Фалло и другие пороки, составляющие менее 1 %.
За годы научных наблюдений стало очевидным, что для выявления врожденного порока сердца у новорожденного с синдромом Дауна физическое обследование, включающее осмотр и аускультацию, является обязательным, но недостаточным. Так, McElhinney и др. установили, что информативность физического обследования для выявления сердечных аномалий у детей с синдромом Дауна не превышает 80 %. Оказалось, что 15 из 114 исследуемых детей при осмотре не имели признаков врожденных пороков сердца, но при ультразвуковом исследовании у них были диагностированы сердечные аномалии, а девяти из них в дальнейшем потребовалось оперативное лечение.
Материалы и методы
Нами проведено исследование частоты встречаемости и особенностей клинической картины врожденных пороков сердца и персистирующих фетальных коммуникаций у 522 детей с синдромом Дауна в возрасте от 0 до 8 лет, воспитывающихся в домашних условиях. Дети получали медико-психолого-педагогическую помощь в Центре ранней помощи Благотворительного фонда «Даунсайд Ап», где наблюдались с момента обращения (возраст при первом посещении варьировал от 0 до 7 лет) до 8 лет. При первичном обращении проводился сбор анамнеза, клиническое обследование, анализ медицинской документации. Все дети, даже в случае отсутствия клинически выраженных симптомов порока сердца, направлялись на электрокардиографическое и эхокардиографическое обследования и, при необходимости, на лечение в соответствующие профильные кардиологические стационары и диспансеры.
Результаты
У всех пациентов синдром Дауна был подтвержден хромосомным исследованием. Регулярная трисомия 21-й хромосомы была выявлена у 499 детей (499/522), что составило 90,4 %, транслокационная форма – у 24 (4,3 %), мозаицизм – у 28 (5,1 %), у одного ребенка трисомии 21-й и Х хромосом (кариотип 48,ХХХ,+21) – 0,2 %.
Получены результаты эхокардиографического исследования 428 детей (см. рис.). Врожденные пороки сердца диагностированы у 195 (195/428), что составило 45,6 %. В структуре этих аномалий у детей с синдромом Дауна чаще отмечался дефект межпредсердной перегородки (ДМПП), а именно в 30,2 % (59/195) случаев. Общий атриовентрикулярный канал (ОАВК) составил 24,1 % (47/195), дефект межжелудочковой перегородки (ДМЖП) – 23,1 % (45/195), сочетание дефектов межпредсердной и межжелудочковой перегородок (ДМПП+ДМЖП) – 10,8 %. Другие пороки, такие как тетрада Фалло, стеноз легочной артерии и др., в сумме составили 11,8 % (23/195). Персистенция гемодинамически значимого открытого артериального протока (ОАП), потребовавшего оперативного вмешательства, была выявлена в 2,8 % (12/428).
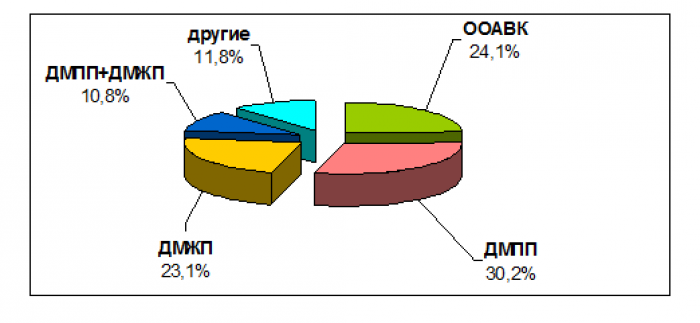 Структура сердечных аномалий у детей с синдромом Дауна
Структура сердечных аномалий у детей с синдромом Дауна
Почти все исследуемые нами дети родились доношенными. Срок родов составил 38,2 ± 1,3 недель. Однако при оценке антропометрических данных новорожденных с синдромом Дауна и врожденными пороками сердца оказалось, что их физическое развитие страдает еще внутриутробно. Задержка физического развития (ЗВУР) – масса тела при рождении ниже 10 перцентилей в соответствии со сроком гестации в сравнении с показателями физического развития Г. М. Дементьевой, Е. В. Короткой – отмечалась у 18,7% детей. У всех новорожденных с сердечными аномалиями наблюдалась асимметричная форма ЗВУР (Pounderal Index, PI>25). Вероятно, задержка физического развития формировалась под влиянием, в основном, не генетического фактора.
Известно, что у новорожденных с синдромом Дауна нередко отмечается морфофункциональная незрелость (по нашим данным, она встречается в 17,9 % случаев). У детей с морфофункциональной незрелостью часто недооцениваются размеры дефекта межпредсердной перегородки, который рассматривают как открытое овальное окно даже при гемодинамической его значимости, и артериального протока, в то время как имеет место недостаточность кровообращения. Застойная легочная гипертензия приводит к развитию пневмонии. Возникновение и затяжное течение пневмонии у детей с синдромом Дауна объясняется характерными для них иммунологическими нарушениями.
Хорошо известно, что манифестация сердечной недостаточности у детей раннего возраста, в отличие от детей старшего возраста, может протекать под маской других состояний. Помимо классических симптомов, таких как тахикардия (учащение сердцебиения), тахипноэ (увеличение частоты дыхания), цианоз кожи и слизистых, типичны вялое сосание, снижение темпов физического и психомоторного развития. В подобных случаях у педиатров возникают определенные затруднения в проведении дифференциальной диагностики при наличии у ребенка синдрома Дауна. У таких детей клинические симптомы недостаточности кровообращения могут расцениваться как проявления особенностей психомоторного развития, типичных для синдрома Дауна. Так, если возникают трудности вскармливания: ребенок вялый, неохотно берет грудь или соску, вяло сосет, не может высосать необходимый объем питания, вплоть до полного отказа от кормлений, такие проблемы часто объясняются мышечной гипотонией, общей вялостью, характерной для детей с синдромом Дауна, с последующим назначением общеукрепляющего массажа, что ухудшает состояние ребенка. В дальнейшем отмечается плохая прибавка в весе. Она направляет клиницистов на выявление патологии со стороны желудочно-кишечного тракта, гипогалактии у матери, исследования качества молока, его инфицированности. В борьбе с прогрессирующей гипотрофией младенца нередко переводят на искусственные смеси. Важно отметить, что гипотрофия может стать причиной отсрочки оперативного лечения порока сердца и/или неблагоприятно повлиять на его исход.
Таким образом, слабая нацеленность педиатров на выявление симптомов недостаточности кровообращения у ребенка с синдромом Дауна затрудняет ее своевременную диагностику, а следовательно, и адекватное лечение врожденного порока сердца.
Наглядным примером будет анализ истории болезни.
Андрей Б., от первой, физиологично протекавшей беременности. Роды в срок. Вес мальчика при рождении – 3000 г., рост – 51см, оценка по шкале АПГАР 88б. Состояние ребенка после рождения удовлетворительное. Отмечались признаки морфофункциональной незрелости, фенотипические признаки синдрома Дауна. С целью подтверждения хромосомной патологии была взята кровь для определения кариотипа. Выявлена регулярная трисомия 21-й хромосомы. С первых суток жизни отмечался систолический шум при аускультации грудной клетки. Для исключения аномалий развития сердца проведено ЭХОКГ и обнаружено открытое овальное окно размером 4 мм. Ребенок был выписан домой под наблюдение участкового педиатра и кардиолога по месту жительства. В дальнейшем мальчик стал вялым, неохотно брал грудь, отмечались частые срыгивания, редкий стул. За месяц ребенок прибавил в весе 210 г. При осмотре обращали на себя внимание признаки недостаточности кровообращения: одышка в покое, умеренная тахикардия. Мальчик был направлен в НЦССХ им. Бакулева, где диагностирован порок развития сердца – дефект межпредсердной перегородки размером 6 мм со значительным нарушением сердечной гемодинамики. Рентгенограмма грудной клетки показала расширение корней легких, КТИ = 57 %. По данным ЭКГ: отклонение электрической оси сердца вправо. В возрасте 4 месяцев проведено оперативное лечение дефекта межпредсердной перегородки.
Успехи в области кардиохирургии за последние десятилетия позволили повысить выживаемость младенцев с синдромом Дауна и патологией сердечнососудистой системы с 78 % в 1985 г до 90 % к 2004 г. (Claire Irving и др., 2008).
Hijii Т. и др. (1997) сообщили, что до 24-летнего возраста доживают 87,8 % пациентов с синдромом Дауна, перенесших оперативное лечение врожденного порока сердца.
При сравнении течения и исходов оперативного лечения полной формы атривентрикулярного канала у младенцев с синдромом Дауна и без синдрома, в работе, проведенной на базе НЦССХ им. Бакулева, Т. И. Задко отмечает, что у детей с синдромом Дауна быстрее развивается легочная гипертензия, важным механизмом в развитии которой, очевидно, является окислительный стресс. Генетически обусловленные особенности антиоксидантной системы, в том числе изначально низкий уровень глутатиона и более высокая антиоксидантная активность сыворотки у детей с синдромом Дауна (Н. П. Котлукова, О. И. Артеменко и др., 2008), свидетельствуют о более высоком окислительном стрессе при развитии легочной гипертензии при пороках сердца с легочной гиперволемией.
Из ранних осложнений хирургической коррекции атриовентрикулярного канала у детей с синдромом Дауна чаще встречаются инфекционно-септические осложнения, тогда как у детей без синдрома – острая сердечная недостаточность (Т. И. Задко, 2005). Это обстоятельство объясняется анатомическими особенностями порока и имеющимися иммунологическими нарушениями у младенцев с трисомией 21-й хромосомы.
Выводы
Полученные нами данные частоты сердечных аномалий не противоречат уже известным в литературе. Около половины детей с синдромом Дауна имеют патологию сердечнососудистой системы: 45,5 % – врожденные пороки сердца, 2,8 % – гемодинамически значимый открытый артериальный проток.
Анализ данных проведенных исследований, а также собственные полученные результаты делают очевидной необходимость раннего кардиологического обследования всех новорожденных с синдромом Дауна, включающего помимо осмотра и аускультации проведение эхокардиологического и электрокардиологического исследований. Внимательный подход и оценка клинических симптомов, а также знание генетически обусловленных особенностей детей с синдромом Дауна помогут своевременно диагностировать недостаточность кровообращения и начать адекватную терапию. Все дети с выявленными пороками сердца должны быть консультированы кардиохирургом для определения необходимости и сроков оперативного лечения.
Литература
- Задко Т. И. Синдром Дауна в сочетании с полной формой атриовентрикулярной коммуникации: актуальность, диагностика, сопутствующая патология, анатомия, особенности естественного течения, результаты хирургического лечения // Детские болезни сердца и сосудов. – 2005. – № 6. – С. 10–18.
- Роль окислительного стресса и антиоксидантной системы в патогенезе врожденных пороков сердца / Н. П. Котлукова, О. И. Артеменко, М. П. Давыдова, О. Н. Ильина, Л. А. Курбатова // Педиатрия. – 2009. – Т. 87, № 1. – С. 24–28.
- Cassidy S. B., Allanson J. E. Management of Genetic Syndromes. 2-nd ed. – P. 191–210. URL: https://www.wiley.com/en-us/Management+of+Genetic+Syndromes%2C+3rd+Edition-p-9780470191415
- Correlation between abnormal cardiac physical examination and echocardiographic findings in neonates with Down syndrome / D. B. McElhinney, M. Straka, E. Goldmuntz, E. H. Zackai // American Journal of Medical Genetics. – 2002. – Part A. – P. 238–241.
- Khory M. J., Erickson J. D. Improved ascertainment of cardiovascular malformation in infants with Down syndrome, Atlanta, 1968 through 1989 // Epidemiology. – 1992. – Vol. 136. – P. 1457–1464.
- Life expectancy and social adaptation in individuals with Down syndrome and without surgery for congenital heart disease / T. Hijii, J. Fukushige, H. Igarashi et al. // Clinical Pediatrics. – 1997. –Vol. 36. – P. 327–332.
- Twenty-year trends in prevalence and survival of Down syndrome / C. Irving, A. Basu, S. Richmond et al. // European Journal of Human Genetics. – 2008. – Vol. 16. – P. 1336–1340.
Источник

УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
В многочисленных исследованиях зарубежных и отечественных коллег неоднократно формулировались и изучались различные группы риска по возникновению ВПС. Это делалось для того, чтобы потенциально сузить группу беременных женщин, которым показана эхокардиография в специализированном центре. Среди этих групп риска выделяли:
- Семьи, имеющие ребенка с ВПС.
- Семьи с ВПС у одного или обоих супругов.
- Женщин, страдающих сахарным диабетом, системными заболеваниями соединительной ткани, гипотиреозом.
- Беременных с тератогенной экспозицией в ранние сроки беременности (герпес ранее 6-7-й недели) [2].
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): “Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга”.
Главная цель пренатальной диагностики сформулирована специалистами пренатальной диагностики всего мира – это обеспечение женщины максимально возможной информацией о пороке как можно раньше. Мы должны дать право женщине и семье в целом решать вопрос о пролонгировании беременности с грубыми пороками развития у плода [4].
С каждым годом все большее количество публикаций посвящается диагностике ВПС в ранние сроки – в I триместре беременности [5-8]. Практически ни один из выпусков журнала ISUOG (Ultrasound In Obstetrics and Gynecology, или “белого” журнала, как его называют специалисты) не обходит своим вниманием тему ранней диагностики врожденных пороков развития.
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат “перу” специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
При эхокардиографии изучались четырехкамерный срез сердца плода (рис. 1) и срез через три сосуда (рис. 2). УЗИ проводилось трансабдоминальным датчиком, лишь при необходимости (затрудненная визуализация) использовался внутриполостной датчик. Четырехкамерный срез сердца плода при ультразвуковом сканировании трансабдоминальным датчиком визуализировался в 85% случаев, срез через сосуды – в 73%, при использовании трансвагинального датчика эти цифры существенно возрастали до 100 и 91% соответственно. Оптимизация пренатальной диагностики ВПС может быть достигнута путем строгого соблюдения основных методических правил. При оценке четырехкамерного среза плода необходимо оценить нормальное расположение сердца плода, исключив его эктопию (рис. 3), положение оси сердца плода, что не представляет никаких трудностей, нормальные пропорции и размеры камер сердца, движение створок атриовентрикулярных клапанов должно быть свободным, септальная створка трикуспидального клапана должна располагаться ближе к верхушке сердца (рис. 4). При оценке среза через три сосуда необходимо оценить взаиморасположение сосудов и их диаметр.

Рис. 1. Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.

Рис. 2. Беременность 12 недель. Срез через три сосуда. Визуализируются аорта, легочной ствол. Сосуды расположены в одну линию и имеют нормальные размеры.

Рис. 3. Беременность 8 недель. Эктопия сердца. Сердце расположено снаружи грудной полости.


Рис. 4. Беременность 13 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца. Положение атриовентрикулярных клапанов.
Расширенная эхокардиография предполагает применение дополнительных режимов и срезов – среза через дугу аорты (рис. 5), среза через выносящий тракт левого желудочка (рис. 6), режима ЦДК (рис. 7), импульсной допплерометрии, технологии STIC (рис. 8-11). Это обследование проводится при обнаружении аномальных скрининговых проекций сердца плода, маркеров ХА [расширение толщины воротникового пространства – ТВП, гипоплазия/отсутствие носовой кости (рис. 12, 13), регургитации в венозном протоке (рис. 14), трикуспидальной регургитации (рис. 15)] и/или врожденных пороков развития плода.

Рис. 5. Беременность 13 недель. Срез через дугу аорты. Отчетливо видны три плечеголовных сосуда, отходящих от дуги.

Рис. 6. Беременность 12 недель. Тетрада Фалло. Режим ЦДК. Срез через выносящий тракт левого желудочка. Видна “аорта-наездница”, сидящая над ДМЖП. Случай опубликован на сайте www.thefetus.net.

Рис. 7. Беременность 13 недель. Двойной выход сосудов из правого желудочка. Режим ЦДК. Параллельный выход сосудов из правого желудочка.

Рис. 8. Беременность 12 недель. Атриовентрикулярная коммуникация (АВК) при синдроме Дауна. Режим STIC.

Рис. 9. Беременность 12 недель. Тетрада Фалло. Режим STIC. Аорта “наездница”, сидящая над ДМЖП. Случай опубликован на сайте www.thefetus.net.

Рис. 10. Беременность 13 недель. Транспозиция магистральных сосудов. Режим STIC. Виден параллельный ход выносящих сосудов, верхний из которых выходит из левого желудочка и делится на бифуркацию (легочная артерия).

Рис. 11. Беременность 12 недель. Общий артериальный ствол. Режим STIC. Виден единый выносящий сосуд из двух желудочков.

Рис. 12. Беременность 11,4 недель. Множественные маркеры ХА. Синдром Патау (трисомия 13). Увеличение ТВП, аномальный профиль с гипоплазией носовой кости, протуберансом на верхней челюсти (признак расщелины лица), полидактилия. У плода выявлена гипоплазия левых отделов сердца.

Рис. 13. Беременность 12 недель. Множественные маркеры ХА. Синдром Дауна (трисомия 21). Увеличение ТВП, аномальный профиль с гипоплазией носовой кости. У плода выявлена АВК.

Рис. 14. Беременность 12 недель. Реверсный кровоток в венозном протоке у плода с гетеротаксией.

Рис. 15. Беременность 12 недель. Трикуспидальная регургитация у плода с общим артериальным стволом.
Нозология выявленных нами ВПС была следующей:
- синдром гипоплазии левых отделов сердца (СГЛОС) – 29 случаев (рис. 16);
- атриовентрикулярная коммуникация (АВК) – 23 (рис. 17, 18);
- дефект межжелудочковой перегородки (ДМЖП) – 19 (рис. 19);
- патология магистральных сосудов – 19 (из них транспозиция – 3, двойное отхождение сосудов из правого желудочка – 2, тетрада Фалло – 5, общий артериальный ствол – 9);
- патология правых отделов сердца (патология трикуспидального клапана) – 3;
- синдром гетеротаксии – 6;
- единственный желудочек – 4;
- эктопия сердца – 7;
- сочетанные формы ВПС встретились в 15 случаях.

Рис. 16. Беременность 13 недель. Синдром гипоплазии левых отделов сердца у плода с синдромом Тернера (45Х). Единый поток через трикуспидальный клапан. Сброс крови в гипоплазированный левый желудочек через ДМЖП.

Рис. 17. Беременность 11,4 недель. Четырехкамерный срез сердца. Единый атриовентрикулярный клапан. Отсутствует “крест” нормального взаимоотношения атриовентрикулярных клапанов и сердечных перегородок.

Рис. 18. Беременность 11,4 недель. Четырехкамерный срез сердца. Режим ЦДК. Единый атриовентрикулярный клапан.

Рис. 19. Беременность 12 недель. Режим ЦДК. Обширный ДМЖП у плода с синдромом Эдвардса (трисомия 18).
При кариотипировании плодов с пренатально установленным диагнозом ВПС в 11-14 недель было диагностировано 68 хромосомных аномалий:
- трисомия 21 (синдром Дауна) выявлена в 23 (34%) случаях,
- трисомия 18 (синдром Эдвардса) – в 19 (28%);
- трисомия 13 (синдром Патау) – в 7 (10%);
- моносомия Х (синдром Тернера) – в 6 (9%);
- триплоидия – в 8 (12%);
- другие хромосомные дисбалансы – в 5 (7%).
Особо следует отметить, что в 8 случаях обнаруженных ХА показанием к кариотипированию было выявление ВПС. У этих плодов было нормальное значение как ТВП, так и длины носовой кости.
При ХА выявленные ВПС по нозологии имели следующие особенности: у большинства плодов с синдромом Дауна диагностировались АВК и ДМЖП; с синдромом Патау – СГЛОС и ДМЖП; с синдромом Эдвардса – ДМЖП, тетрада Фалло и ОАС; при синдроме Тернера – СГЛОС и патология аорты – коарктация аорты в типичном месте (рис. 20).

Рис. 20. Беременность 12 недель. Срез через дугу аорты. Режим ЦДК. Сужение аорты в “типичном” месте у плода с синдромом Тернера (45Х).
Необходимо отдельно рассмотреть вопрос верификации ультразвукового диагноза. Все беременности с изолированными ВПС в I триместре пролонгировались до срока II триместра, когда возможна 100% морфологическая верификация диагноза. В современных условиях верификация диагнозов после прерывания беременности в I триместре представляет довольно значимую проблему. Однако при специализированном обучении специалистов-морфологов верификация ВПС возможна и при прерывании беременности в I триместре (рис. 21, 22). Это, несомненно, зависит от качества полученного материала, квалификации морфолога и специального оборудования, необходимого в некоторых случаях, а также от общих методологических подходов к анатомо-морфологической диагностике независимо от срока гестации.

Рис. 21. Беременность 13 недель. Увеличенная ТВП у плода с гипоплазией левых отделов сердца.

Рис. 22. Тот же плод. Морфологическое обследование – гипоплазия восходящей аорты и кистозные полости (отмечены стрелками).
Заключение
Из сказанного выше можно сделать следующие выводы.
Сердце плода необходимо оценивать у всех беременных при скрининговом осмотре в I триместре (11-14 нед). Так как современная концепция развития пренатальной диагностики в рамках “пилотного” проекта МЗ РФ подразумевает скрининговое обследование в I триместре врачом-экспертом, именно он и должен оценить сердце плода и заподозрить ВПС уже в конце I триместра беременности.
Для исключения летальной и клинически значимой сердечной патологии в I триместре обязательна оценка четырехкамерной проекции сердца плода и среза через три сосуда.
Расширенная эхокардиография должна проводиться при обнаружении аномальных скрининговых проекций сердца плода, маркеров ХА и/или ВПР плода.
При выявлении ВПС в I триместре показано кариотипирование плода.
Литература
- Office for National Statistics. Mortality Statistics. Childhood, Infancy and Perinatal. Series DH3. Stationary Office: London, 2007; 40.
- Новикова И.В., Прибушеня О.В., Румянцева Н.В. Формирование групп риска по дородовой диагностике врожденных пороков сердца. Инструкция по применению. Минск, 2004.
- Carvalho J.S., Moscoso G., Tekay A. et al. Clinical impact of first and early second trimester fetal echocardiography on high risk pregnancies. Heart. 2004; 90: 921-926.
- Becker R., Wegner R.-D. Detailed screening for fetal anomalies and cardiac defects at the 11-13 week scan. Ultrasound Obstet Gynecol 2006; 27; 613-618.
- Allan L.D., Sharland G.K., Milburn A. et al. Prospective diagnosis of 1,006 consecutive cases of congenital heart disease in the fetus. J Am Coll Cardiol 1994; 23: 1452-1458.
- Huggon I.C., Ghi T., Cook A.C. et al. Fetal cardiac abnor-malities identified prior to 14 weeks’ gestation. Ultrasound. Obstet. Gynecol. 2011; 20: 22-29.
- Persico N., Moratalla J., Lombardi C.M. et al. Fetal echocardiography at 11-13 weeks by transabdominal high-frequency ultrasound Ultrasound Obstet. Gynecol. 2011; 37: 296-301
- Allan L.D. Echocardiographic detection of congenitalheart disease in the fetus: present and future. Br. Heart. J. 1995; 74: 103-106.

УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Источник
