Синдром черджа стросса где лечить
Синдром Черджа-Стросс – воспалительно-аллергическое поражение мелких и средних сосудов (капилляров, венул, артериол), протекающее с образованием некротизирующих эозинофильных гранулем. Для синдрома Черджа-Стросс характерны гиперэозинофилия, поражение бронхо-легочной системы, сердца, ЖКТ, центральной и периферической нервной системы, кожи и суставов. Диагноз синдрома Черджа-Стросс основан на данных анамнеза, клинической картины, лабораторных исследований, рентгенографии органов грудной клетки, биопсии легких. В качестве основной терапии синдрома Черджа-Стросс показано назначение системных глюкокортикостероидов и цитостатиков.
Общие сведения
Синдром Черджа-Стросс – разновидность системного васкулита с гранулематозным воспалением сосудов среднего и мелкого калибра и преимущественным поражением респираторного тракта. Синдром Черджа-Стросс относится к полисистемным нарушениям, чаще всего затрагивающим органы с богатым кровоснабжением – кожу, легкие, сердце, нервную систему, ЖКТ, почки. Синдром Черджа-Стросс во многом напоминает узелковый периартериит, но в отличие от него поражает не только мелкие и средние артерии, но и капилляры, вены и венулы; характеризуется эозинофилией и гранулематозным воспалением, преимущественным поражением легких. В ревматологии синдром Черджа-Стросс встречается редко, ежегодная заболеваемость составляет 0,42 случая на 100 тыс. населения. Синдромом Черджа-Стросс страдают люди от 15 до 70 лет, средний возраст пациентов составляет 40-50 лет; у женщин заболевание выявляется несколько чаще, чем у мужчин.
Синдром Черджа-Стросс
Причины
Причины синдрома Черджа-Стросс неизвестны. Патогенез связан с иммунным воспалением, пролиферативно-деструктивными изменениями и повышением проницаемости сосудистой стенки, тромбообразованием, кровоизлияниями и ишемией в зоне повреждения сосудов. Важную роль в развитии синдрома Черджа-Стросс играет повышенный титр антинейтрофильных цитоплазматических антител (ANCA), антигенными мишенями которых являются ферменты нейтрофилов (главным образом, протеиназа-3 и миелопероксидаза). ANCA вызывают преждевременную дегрануляцию и нарушение трансэндотелиальной миграции активированных гранулоцитов. Сосудистые изменения приводят к появлению многочисленных эозинофильных инфильтратов в тканях и органах с образованием некротизирующих воспалительных гранулем.
На первый план при синдроме Черджа-Стросс выходит поражение легких. При гистологическом исследовании выявляются интерстициальные и периваскулярные эозинофильные инфильтраты в стенках легочных капилляров, бронхов, бронхиол и альвеол, перивазальных и перилимфатических тканях. Инфильтраты имеют разнообразную форму, обычно локализуются в нескольких сегментах легкого, но могут распространяться на всю легочную долю. Кроме острофазных воспалительных реакций, отмечаются рубцовые склеротические изменения в сосудах и легочной ткани.
Спровоцировать развитие синдрома Черджа-Стросс могут вирусная или бактериальная инфекция (например, гепатит В, стафилококковое поражение носоглотки), вакцинация, сенсибилизация организма (аллергические заболевания, лекарственная непереносимость), стрессы, охлаждение, инсоляция, беременность и роды.
Симптомы
В своем развитии синдром Черджа-Стросс проходит три стадии.
Продромальная стадия может длиться несколько лет. При типичном течении синдром Черджа-Стросс начинается с поражения респираторного тракта. Появляются аллергический ринит, симптомы носовой обструкции, полипозные разрастания слизистой носа, рецидивирующие синуситы, затяжные бронхиты с астматическим компонентом, бронхиальная астма.
Вторая стадия синдрома Черджа-Стросс характеризуется повышением уровня эозинофилов в периферической крови и тканях; проявляется тяжелыми формами бронхиальной астмы с сильными приступами кашля и экспираторного удушья, кровохарканьем. Приступы бронхоспазма сопровождаются выраженной слабостью, длительной лихорадкой, миалгией, похуданием. Хроническая эозинофильная инфильтрация легких может привести к развитию бронхоэктатической болезни, эозинофильной пневмонии, эозинофильного плеврита. При появлении плеврального выпота отмечаются боли в грудной клетке при дыхании, усиление одышки.
Третья стадия синдрома Черджа-Стросс характеризуется развитием и доминированием признаков системного васкулита с полиорганным поражением. При генерализации синдрома Черджа-Стросс степень тяжести бронхиальной астмы уменьшается. Период между появлением симптомов бронхиальной астмы и васкулита составляет в среднем 2-3 года (чем короче промежуток, тем неблагоприятнее прогноз заболевания). Отмечается высокая эозинофилия (35-85%). Со стороны сердечно-сосудистой системы возможно развитие миокардита, коронарита, констриктивного перикардита, недостаточности митрального и трехстворчатого клапанов, инфаркта миокарда, пристеночного фибропластического эндокардита Леффлера. Поражение коронарных сосудов может стать причиной внезапной смерти больных синдромом Черджа-Стросс.
Для поражения нервной системы характерны периферическая нейропатия (мононейропатия, дистальная полинейропатия «по типу перчаток или чулок»; радикулопатии, нейропатия зрительного нерва), патология ЦНС (геморрагический инсульт, эпилептические приступы, эмоциональные расстройства). Со стороны ЖКТ отмечается развитие эозинофильного гастроэнтерита (абдоминальные боли, тошнота, рвота, диарея), реже – кровотечения, перфорация желудка или кишечника, перитонит, кишечная непроходимость.
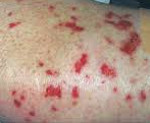
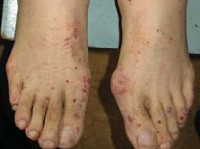
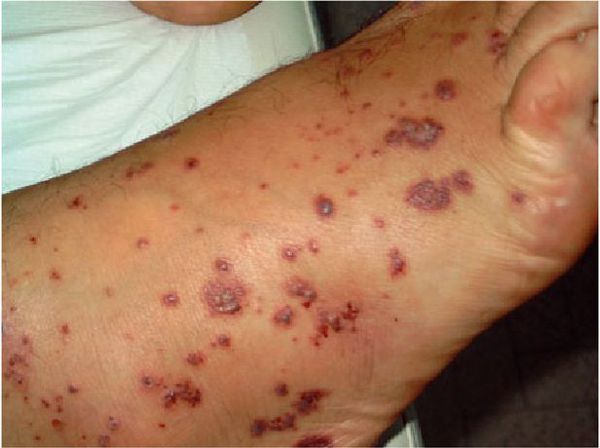
При синдроме Черджа-Стросс возникает полиморфное поражение кожи в виде болезненной геморрагической пурпуры на нижних конечностях, подкожных узелков, эритемы, крапивницы и некротических пузырьков. Часто наблюдаются полиартралгии и непрогрессирующий мигрирующий артрит. Поражение почек встречается редко, носит невыраженный характер, протекает в форме сегментарного гломерулонефрита и не сопровождается ХПН.
Диагностика
Больные синдромом Черджа-Строcс за первичной помощью обычно обращаются к различным специалистам – отоларингологу, пульмонологу, аллергологу, неврологу, кардиологу, гастроэнтерологу и поздно попадают к ревматологу. Диагностика синдрома Черджа-Стросс основана на клинико-лабораторных данных и результатах инструментальных исследований. Диагностическими критериями синдрома Черджа-Стросс считаются: гиперэозинофилия (>10% от общего числа лейкоцитов), бронхиальная астма, моно- или полинейропатия, синусит, эозинофильные инфильтраты в легких, экстраваскулярные некротизирующие гранулемы. Наличие не менее 4-х критериев подтверждает диагноз в 85% случаев.
При синдроме Черджа-Стросс также выявляется анемия, лейкоцитоз, повышение СОЭ и уровня общего IgE. Для более половины случаев синдрома Черджа-Стросс характерно обнаружение перинуклеарных антител с антимиелопероксидазной активностью (рANCA).
Рентгенография органов грудной клетки при синдроме Черджа-Стросс позволяет обнаружить быстро исчезающие, ограниченные затемнения и очаговые тени в легких, наличие плеврального выпота. При биопсии легкого определяется гранулематозное воспаление мелких сосудов, инфильтраты в околососудистом пространстве, содержащие эозинофилы. Дифференциальную диагностику синдрома Черджа-Стросс следует проводить с узелковым полиартериитом, гранулематозом Вегенера, хронической эозинофильной пневмонией, идиопатическим гиперэозинофильным синдромом, микроскопическим полиангиитом.
Лечение синдрома Черджа-Стросс
Лечение предполагает длительное назначение высоких доз системных глюкокортикостероидов. По мере улучшения состояния дозу препаратов снижают. При наличии поражений сердечно-сосудистой системы, легких, множественного мононеврита возможно применение пульс-терапии метилпреднизолоном. При неэффективности глюкокортикостероидов используются цитостатики (циклофосфамид, азатиоприн, хлорбутин), которые способствуют более быстрой ремиссии и снижению риска рецидивов, но создают высокий риск инфекционных осложнений. Перед началом терапии отменяются все лекарственные препараты, к которым у больного выявлена сенсибилизация.
Прогноз
Без лечения прогноз синдрома Черджа-Стросс неблагоприятный. При полиорганном поражении происходит быстрое прогрессирование синдрома Черджа-Стросс с высоким риском смертельного исхода от сердечно-легочных нарушений. При адекватном лечении 5-летняя выживаемость составляет 60-80%.
Источник
Дата публикации 9 июня 2020Обновлено 9 июня 2020
Определение болезни. Причины заболевания
Синдром Чёрджа — Стросса, или эозинофильный гранулематоз с полиангиитом (ЭГПА, англ. Churg — Strauss syndrome) — это воспаление мелких и средних кровеносных сосудов, сопровождающееся бронхиальной астмой и/или аллергическими реакциями. Для заболевания характерно образование некротизирующих эозинофильных гранулём (очагов воспаления в виде узелков) [2].
Синдром Чёрджа — Стросса относится у группе системных васкулитов. Это группа патологий, при которых ишемия (снижение кровоснабжения) и некроз (омертвение) тканей возникают из-за воспаления кровеносных сосудов.
Впервые это заболевание описали в 1951 году американские патологи Якоб Чёрдж и Лотте Стросс по данным аутопсии (посмертного исследования) 13 пациентов. Они указали на тяжёлое течение бронхиальной астмы с высоким содержанием эозинофилов (разновидность лейкоцитов, выполняющих защитную функцию), лихорадкой, сердечной и почечной недостаточностью и периферической нейропатией. Периферическая нейропатия — это поражение периферических нервов, которое часто проявляется слабостью, онемением и болью, как правило, в руках и ногах [2].
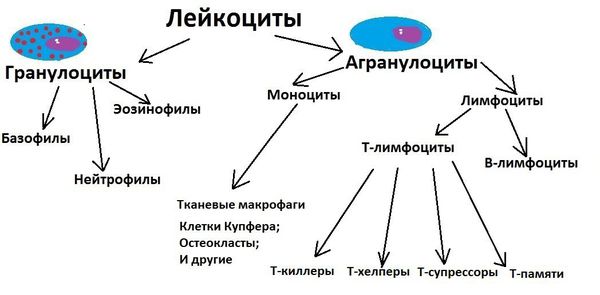
Заболевание относится к аутоиммунным патологиям, при которых иммунная система человека воспринимает собственные ткани как чужеродные и начинает вырабатывать к ним антитела. Причина возникновения ЭГПА неизвестна. В большинстве случаев ему предшествует непереносимость лекарств, аллергические риниты, крапивница, отёк Квинке (отёк слизистой рта и подкожно-жировой клетчатки лица, шеи, рук), пищевая аллергия. Пусковым моментом может быть перенесённая острая респираторная инфекция, переохлаждение, инсоляция (солнечные ванны), беременность, роды. Встречаются случаи начала заболевания после введения сывороток и вакцин [2]. Заболевание может начинаться остро или постепенно. Чаще всего на фоне частых приступов удушья появляется чувство жжения в конечностях и различного рода высыпания на коже.
Распространённость заболевания составляет 1-3 человека на миллион взрослых во всём мире [16]. Средний возраст начала заболевания от 38 до 54. Мужчины и женщины болеют примерно с одинаковой частотой [15].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы синдрома Черджа — Стросса
Одним из первых симптомов чаще всего является аллергический ринит, который осложняется полипозом слизистой носа, или бронхиальная астма, устойчивая к обычной терапии. Постепенно появляется лихорадка, боли в суставах (артралгии) и мышцах (миалгии), больной теряет в весе, увеличивается скорость оседания эритроцитов (СОЭ) в общем анализе крови (ОАК) [4].
Очень часто при синдроме Чёрджа — Стросса поражается кожа. Причём кожные симптомы могут быть самыми разнообразными: от болезненной пурпуры (скопления крови в тканях, под кожей и слизистыми оболочками) и зуда на нижних конечностях до инфарктов и язв на коже. Но всё же самые частые изменения — это кровоизлияния типа пурпуры и подкожные узелки. С появлением васкулита (воспаления стенок кровеносных сосудов), как правило, приступы бронхиальной астмы уменьшаются или даже купируются, но причины этого неизвестны.
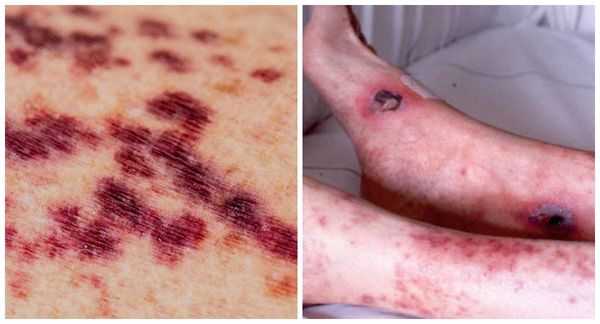
Больше чем у половины больных поражается нервная система. Чаще всего развивается клиника периферической нейропатии — мононейропатия (воспаление одного нерва), дистальная полинейропатия (множественное поражение нервов, сопровождающееся чувством жжения в конечностях, “ползаньем мурашек”). Может поражаться и центральная нервная система, при этом возможны различные проявления: от расстройств в эмоциональной сфере до острого нарушения мозгового кровообращения (инсульта) и эпилептических приступов [2].
Синдром Чёрджа — Стросса может поражать и сердце, что приводит к нарушению его сократительной способности, нарушению ритма и проводимости. Эозинофилы инфильтрируют (просачиваются) во внутреннюю и среднюю оболочку сердца — эндокард и миокард. Это вызывает эндокардит (воспаление эндокарда) и рестриктивную кардиомиопатию, которые проявляются нарастающей одышкой и отёками на ногах. Воспаление коронарных сосудов может привести к инфаркту миокарда, а поражение сосочковых мышц — к недостаточности митрального, а иногда и трикуспидального клапанов сердца (также проявляется одышкой и отёками нижних конечностей).
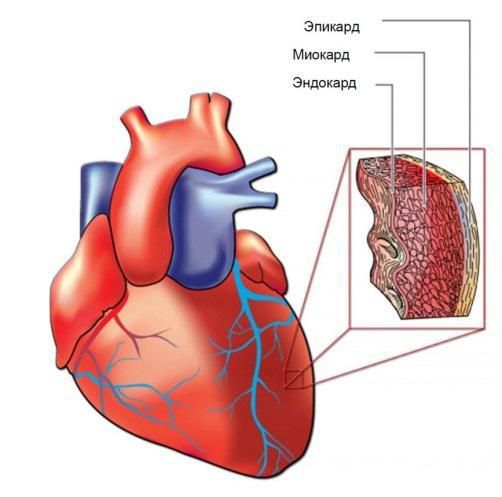
Самые типичные жалобы при поражении сердечно-сосудистой системы — тупая боль в сердце, сердцебиение, одышка. Врач клинически определяет увеличение размеров сердца, тахикардию, глухость тонов, иногда систолический шум и нарушение ритма [2].
Данный васкулит может поражать и желудочно-кишечный тракт. Пациент при этом почувствует боли в животе, возможно появление диареи. В тяжёлых случаях может развиться перфорация (образование сквозного отверстия) желудка и кишечника с развитием кровотечения.
Реже других наблюдается поражение урогенитального тракта и простаты, что проявляется уменьшением количества отделяемой мочи. Описаны случаи поражения зрительного нерва, которые сопровождаются нарушениями зрения, вплоть до слепоты [5][6].
Патогенез синдрома Черджа — Стросса
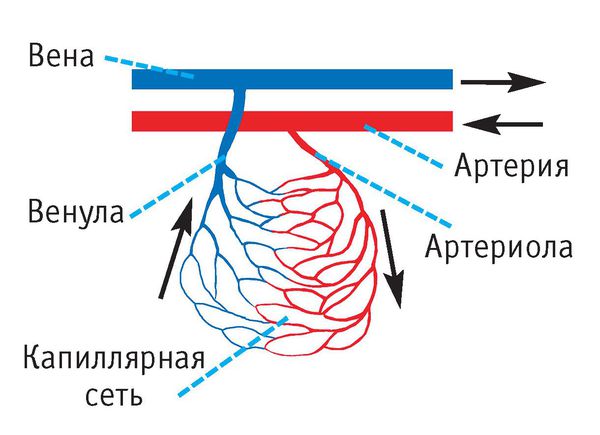
Ведущим в патогенезе эозинофильного гранулематоза является воспаление мелких и средних кровеносных сосудов — артериол, венул, капилляров. Стенки сосудов инфильтрируются нейтрофилами и эозинофилами, в сосудах появляются тромбы и участки кровоизлияний.

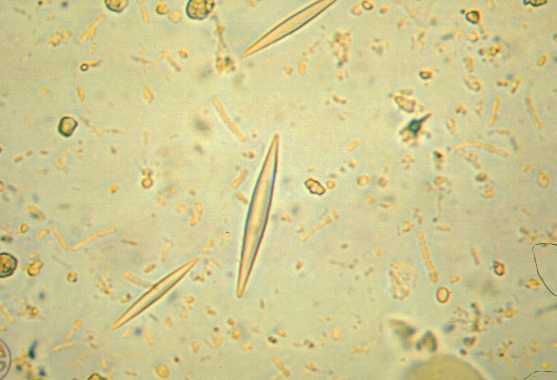
Вне сосудов могут образовываться гранулёмы (очаги воспаления), но они не являются универсальным морфологическим признаком синдрома Чёрджа — Стросса. Такая гранулёма имеет зону некроза, которая окружена эпителиоидными гистиоцитами (разновидность макрофагов – клеток, которые захватывают и перерабатывают чужеродные и токсические частицы в организме человека). Кроме того, для этих гранулём типично значительное содержание эозинофилов и кристаллов Шарко-Лейдена (белка, который образуется при распаде эозинофилов) [14].
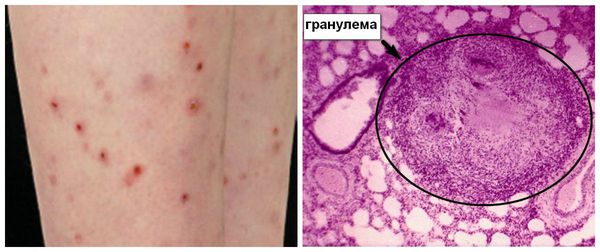
У ряда больных (50-70 %) определённую роль в развитии заболевания оказывают антинейтрофильные цитоплазматические антитела (антитела к цитоплазме нейтрофилов — АНЦА, ANCA). Существует две основных гипотезы, которые объясняют роль АНЦА в механизме развития васкулитов.
Первая гипотеза. Из гранул нейтрофилов или из лизосом моноцитов высвобождаются антигенные вещества, которые иммунная система воспринимает как чужеродные. Эти антигены связываются с сосудистой стенкой и образуют иммунные комплексы (комплекс антиген-антитело). Этот комплекс запускает работу системы комплемента — защитных белков, которые участвуют в реализации иммунного ответа организма. Если иммунный комплекс попадает на клетку, белки комплемента разрушают её мембрану. Когда комплексов антитело-антиген в организме становится слишком много, они скапливаются в мелких сосудах (например в коже) и вызывают локальные очаги воспаления.
Вторая гипотеза. АНЦА взаимодействуют с нейтрофилами, которые затем начинают повреждать клетки эндотелия (внутреннего слоя сосудов). AНЦА-активированные нейтрофилы дополнительно вырабатывают провоспалительные цитокины, которые инициируют воспалительную реакцию, что и вызывает сосудистое повреждение [12].
Классификация и стадии развития синдрома Черджа — Стросса
В зависимости от наличия антител к цитоплазме нейтрофилов (АНЦА) выделяют два варианта васкулита:
- АНЦА-позитивный. Для него характерно развитие гломерулонефрита (поражения клубочков почки), множественного мононеврита (одновременного или последовательного поражения более чем одной группы нервов), частых обострений.
- АНЦА-негативный [11]. Характеризуется более неблагоприятным прогнозом, связанным с высокой частотой кардиомиопатии [7].
Заболевание, как правило, протекает с последовательной сменой трёх фаз.
- Первая фаза заболевания может протекать несколько лет, и основным её проявлением будет бронхиальная астма с тяжёлым течением, требующим назначения гормональной терапии в нарастающей дозе.
- Во вторую фазу (эозинофилия) повышается уровень эозинофилов в периферической крови, и они же мигрируют в ткани. В это время формируется хроническая эозинофильная инфильтрация лёгких и желудочно-кишечного тракта.
- Третья фаза (васкулит) характеризуется частыми и тяжёлыми приступами бронхиальной астмы и присоединением системного поражения органов [2].
Осложнения синдрома Черджа — Стросса
При отсутствии своевременного лечения синдром Чёрджа — Стросса прогрессирует, вызывая осложнения со стороны многих систем организма. Часто присоединяется вторичная инфекция (например, инфекционный эндокардит или инфицированные язвы кожи), что усложняет лечение и ухудшает прогноз для пациента.
При распространении процесса на плевру (серозную оболочку, покрывающую лёгкие) появляется плевральный выпот (свободная жидкость в плевральной полости с повышенным содержанием эозинофилов) и нарастает дыхательная недостаточность. Редко встречается распад инфильтратов в лёгких с образованием полостей, сопровождающийся кровохарканьем.
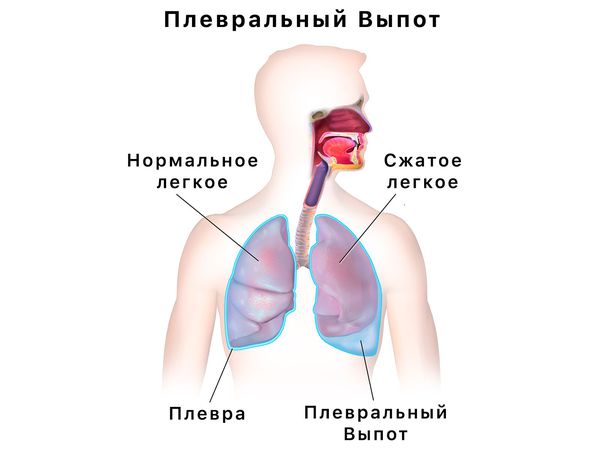
Самые тяжёлые осложнения со стороны сердечно-сосудистой системы — это инфаркт миокарда и внезапная сердечная смерть. При поражении клапанного аппарата и присоединении вторичной инфекции может развиться бактериальный эндокардит.
Со стороны нервной системы — это инсульты и ишемия зрительного нерва (слепота).
Кровоточащая язва желудочно-кишечного тракта может привести к перфорации желудка или кишечника. Эти осложнения могут быть непосредственной причиной смерти больного.
При поражении урогенитального тракта может развиться анурия (значительное уменьшение или отсутствие мочи) [2].
Диагностика синдрома Черджа — Стросса
Синдром Чёрджа — Стросса встречается достаточно редко (1-3 человека на миллион населения), поэтому диагностика этого заболевания вызывает трудности [12].
Для постановки диагноза используются классификационные критерии, разработанные Американской коллегией ревматологов в 1990 году. Наличие у больного четырёх и более признаков позволяет ставить диагноз с чувствительностью 85 % (способность правильно определять тех, у кого есть заболевание) и специфичностью 99 % (способность правильно определять, у кого нет болезни) [1].
| Критерий | Определение |
|---|---|
| Астма | Затруднение дыхания или диффузные хрипы при выдохе. |
| Эозинофилия | Более 10 % при подсчёте лейкоцитов в ОАК. |
| Аллергия в анамнезе | Любая, кроме лекарственной. |
| Мононейропатия или полинейропатия | Мононейропатия (поражение одного нерва), множественная мононейропатия (поражение двух и более периферических нервов, отдаленно друг от друга расположенных), полинейропатия по типу перчаток/чулок (множественное поражение нервов, характеризующееся нарушением их чувствительной и двигательной функции, начинается с кончиков пальцев верхних и нижних конечностей). |
| Лёгочные инфильтраты | Мигрирующие или транзиторные лёгочные инфильтраты, выявляемые при выполнении рентгенологического исследования. |
| Синуситы | Воспаление слизистой оболочки пазух носа (гайморовой, лобной, решетчатой, клиновидной). Характеризуется болями в синусах или изменениями на рентгеновских снимках. |
| Внесосудистые эозинофилы | Скопления эозинофилов во внесосудистом пространстве (по данным биопсии). |
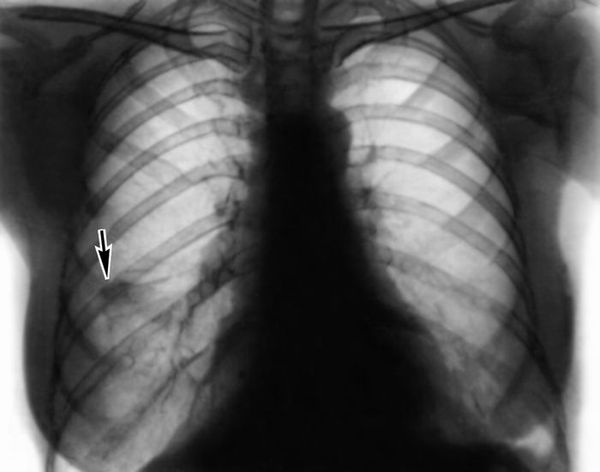
Кроме этого диагностика синдрома Чёрджа — Стросса основывается на клинико-лабораторных данных и результатах инструментальных исследований. При обследовании пациента прицельное внимание направлено на респираторный тракт. Так как клинические проявления могут быть весьма скудными, необходимо выполнение риноскопии (инструментального исследования носовой полости), ларингоскопии (исследования гортани), компьютерной томографии (КТ) придаточных пазух и лёгких. Рентгенография в данной ситуации не всегда достаточно информативна.
Приблизительно у 70 % пациентов по данным КТ наблюдаются рецидивирующие лёгочные эозинофильные инфильтраты, которые быстро исчезают после назначения глюкокортикоидов. Инфильтраты в лёгких имеют различную форму и локализацию и могут появляться на разных этапах болезни, как в самом начале, так и в период развёрнутой клинической картины [2].
Среди лабораторных отклонений на первое место выходит эозинофилия (повышение уровня эозинофилов) крови. Границы процентного соотношения эозинофилов при данном синдроме — от 11 до 77 %. При этом при назначении глюкокортикоидов уровень эозинофилов быстро приходит в норму. Но если на фоне адекватной индукционной иммуносупрессивной терапии эозинофилия сохраняется, то следует исключить гематологические заболевания (заболевания крови) [8].
Кроме того, в начале заболевания или при рецидиве часто повышается общий уровень лейкоцитов крови, ускоряется СОЭ, повышается уровень С-реактивного белка (СРБ), уровень общего иммуноглобулина Е (IgE).
Больше чем у половины больных в патологический процесс вовлекаются почки. Выявляется протеинурия (белок в моче), гематурия (эритроциты в моче), повышение системного артериального давления и признаки почечной недостаточности. Однако эти изменения не влияют на прогноз данного заболевания, так как тяжёлая почечная недостаточность развивается только у 6 % больных [2].
Особое внимание в лабораторной диагностике отводят обнаружению АНЦА, так как наличие этих антител позволяет не только выяснить форму васкулита, но и помочь в выборе терапии. При анализе кала выявляют кристаллы Шарко — Лейдена.
ЭКГ— изменения присоединяются, когда заболевание поражает сердце и эти изменения неспецифичны: опущение интервала ST или инверсия зубца Т на кардиограмме. При эхокардиографии (ЭХОКГ) на поздних стадиях заболевания выявляется расширение полостей сердца, пристеночный эндокардит, наличие тромбов. При УЗИ внутренних органов может наблюдаться увеличение печени и селезёнки [3].
В тех случаях, когда отсутствуют классические клинические проявления заболевания, рекомендовано выполнение биопсии. Место биопсии выбирается индивидуально. Это может быть кожа, периферические нервы и мышцы. Возможна биопсия почки, желудочно-кишечного тракта, эндомиокарда [3].
Синдром Чёрджа — Стросса часто приходится дифференцировать с микроскопическим полиангиитом и гранулематозом Вегенера, но для этих васкулитов характерно более тяжёлое поражение органов дыхания и почек. При проведении дифференциальной диагностики с другими заболеваниями необходимо выполнить следующие исследования:
- серологические тесты на токсокароз и вирус иммунодефицита человека (ВИЧ);
- обследование на грибковое заболевание — аспергиллёз: анализ на содержание общего иммуноглобулина Е и G (IgE и IgG) к грибку Aspergillus spp. в крови, мокроте и/или бронхоальвеолярном смыве;
- анализ на фермент триптазу (временное повышение его уровня характерно для анафилактического шока) и витамин В12 в крови;
- ОАК, компьютерная томография лёгких. Дополнительные исследования назначаются индивидуально [7].
Лечение синдрома Черджа — Стросса
Чем быстрее удаётся поставить диагноз и начать лечение, тем больше шансов избежать тяжёлого течения заболевания. Лечением системных васкулитов занимается врач ревматолог в специализированном центре или ревматологическом отделении, при необходимости привлекаются другие специалисты.
Обычно в лечении аутоиммунных заболеваний особое место отводят активности процесса. В настоящее время надёжные биомаркеры активности синдрома Чёрджа — Стросса отсутствуют. Такие лабораторные показатели, как содержание IgE, СОЭ и С-реактивный белок не позволяют надёжно оценить активность заболевания и прогнозировать развитие рецидивов [7]. Единственным маркером можно считать общее число эозинофилов. Нарастание уровня эозинофилов говорит о повышении активности заболевания, что требует соответствующего лечения.
Существует две фазы лечения:
- индукция ремиссии — интенсивная терапия, направленная на достижение ремиссии (от трёх до шести месяцев);
- поддержание достигнутого эффекта (около двух лет, нередко — пожизненно) [8].
При наличии у пациента поражения сердца, полинейропатии, гломерулонефрита, высокой активности заболевания лечение начинают с пульс-терапии. Это активная гормональная (глюкокортикоидная) и цитостатическая терапия циклофосфаном в условиях стационара. Циклофосфан является эффективным иммуносупрессором — средством, подавляющим иммунитет.
До начала и во время лечения циклофосфаном (через 7-9 дней после каждого внутривенного введения) проверяют лабораторные показатели безопасности и эффективности лечения: мочевой осадок, уровень гемоглобина, число лейкоцитов, тромбоцитов, уровень креатинина, активность печёночных ферментов (АЛТ, АСТ). Кроме того, дозу циклофосфана изначально снижают у больных пожилого возраста и у пациентов с нарушением функции печени [13].
Когда терапия циклофосфаном неэффективна или по каким-либо причинам невозможна, прибегают к генно-инженерной терапии ритуксимабом [16]. Ритуксимаб вводится внутривенно дважды по 1000 мг с интервалом в 2 недели. Противопоказанием для назначения ритуксимаба является наличие положительной пробы манту, инфицирование вирусом гепатита В, значительное снижение содержания в сыворотке крови IgG и нейтрофилов в ОАК.
При достижении ремиссии дозу глюкокортикоидов постепенно снижают, а цитостатические препараты продолжают принимать от полугода до двух лет, но циклофосфан заменяют на менее токсичные препараты. К ним относят азатиоприн, микофенолата мофетил, лефлуномид.
Чаще других в поддерживающей терапии используют азатиоприн в дозе 2 мг/кг/сутки с возможным снижением до 1,5 мг/кг/сутки через год. Другим препаратом, которым можно заменить азатиоприн, является микофенолата мофетил. Применение — 2 г/сутки в один или несколько приёмов с продолжительностью лечения не менее 6 месяцев [1]. При наличии противопоказаний или при плохой переносимости азатиоприна можно использовать лефлуномид 20-30 мг/сутки под контролем лабораторных показателей безопасности лечения [2].
В случае рецидива заболевания дальнейшее активное лечение проводится по той же схеме. О возможном начале обострения заболевания будет свидетельствовать нарастание уровня эозинофилов крови.
К альтернативным методам лечения рефрактерных или рецидифирующих форм синдрома относят проведение плазмафереза (забора крови, очищения и возвращения её обратно в кровоток) и введение нормального иммуноглобулина человека. Нормальный иммуноглобулин человека вводится внутривенно 0,4-2 г/кг 1 раз в сутки 3-5 раз. Возможно проведение повторных курсов 1 раз в месяц в течение 6 месяцев. Такое лечение является вспомогательным и его назначают в случае присоединения серьёзных инфекционных осложнений [2].
Плазмаферез (7-10 процедур) проводится в течение 14 суток с удалением 60 мл/кг плазмы и замещением равным объёмом 4,5-5 % альбумина человека. Плазмаферез присоединяют при прогрессирующем снижении функции почек на фоне иммуносупрессивной терапии [2].
Прогноз. Профилактика
Прогноз при эозинофильном гранулематозе более благоприятный, чем при других системных васкулитах. При своевременной диагностике и лечении ремиссии удаётся достигнуть более чем у 80 % пациентов. Однако без лечения двухлетняя выживаемость составляет не больше 20 % [2].
Факторы, которые ухудшают прогноз заболевания:
- кардиомиопатия (сердечная недостаточность или инфаркт миокарда);
- поражение центральной нервной системы (острое нарушение мозгового кровообращения);
- поражение почек (снижение скорости клубочковой фильтрации или протеинурия >1 г в сутки);
- желудочно-кишечное кровотечения (перфорация или некроз) [12].
Так как причина этого васкулита неизвестна, то и профилактика заболевания не проводится. Однако следует избегать факторов, провоцирующих обострение болезни при установленном диагнозе Чёрджа — Стросса: стресс, инсоляция, немотивированный приём медикаментов, курение (в том числе и пассивное), избыточная масса тела.
Источник
