Синдром дауна и порок сердца у плода

Хорошо известно, что врожденные аномалии сердца встречаются почти у половины детей с синдромом Дауна и оказывают большое влияние на младенческую выживаемость. С середины прошлого столетия проводилось множество исследований по выявлению частоты, специфичности и характера пороков сердца у этих детей. Так, в период 1970–1980-х гг. отмечалось повышение распространенности врожденных аномалий сердечнососудистой системы у пациентов с синдромом Дауна. Связано это было в основном с улучшением диагностики открытого артериального протока и дефекта межпредсердной перегородки (M. J. Khoury, J. D. Erickson, 1992). По данным зарубежных авторов, при синдроме Дауна наиболее часто встречаются дефект межжелудочковой перегородки, дефект межпредсердной перегородки, общий открытый атриовентрикулярный канал, тетрада Фалло и другие пороки, составляющие менее 1 %.
За годы научных наблюдений стало очевидным, что для выявления врожденного порока сердца у новорожденного с синдромом Дауна физическое обследование, включающее осмотр и аускультацию, является обязательным, но недостаточным. Так, McElhinney и др. установили, что информативность физического обследования для выявления сердечных аномалий у детей с синдромом Дауна не превышает 80 %. Оказалось, что 15 из 114 исследуемых детей при осмотре не имели признаков врожденных пороков сердца, но при ультразвуковом исследовании у них были диагностированы сердечные аномалии, а девяти из них в дальнейшем потребовалось оперативное лечение.
Материалы и методы
Нами проведено исследование частоты встречаемости и особенностей клинической картины врожденных пороков сердца и персистирующих фетальных коммуникаций у 522 детей с синдромом Дауна в возрасте от 0 до 8 лет, воспитывающихся в домашних условиях. Дети получали медико-психолого-педагогическую помощь в Центре ранней помощи Благотворительного фонда «Даунсайд Ап», где наблюдались с момента обращения (возраст при первом посещении варьировал от 0 до 7 лет) до 8 лет. При первичном обращении проводился сбор анамнеза, клиническое обследование, анализ медицинской документации. Все дети, даже в случае отсутствия клинически выраженных симптомов порока сердца, направлялись на электрокардиографическое и эхокардиографическое обследования и, при необходимости, на лечение в соответствующие профильные кардиологические стационары и диспансеры.
Результаты
У всех пациентов синдром Дауна был подтвержден хромосомным исследованием. Регулярная трисомия 21-й хромосомы была выявлена у 499 детей (499/522), что составило 90,4 %, транслокационная форма – у 24 (4,3 %), мозаицизм – у 28 (5,1 %), у одного ребенка трисомии 21-й и Х хромосом (кариотип 48,ХХХ,+21) – 0,2 %.
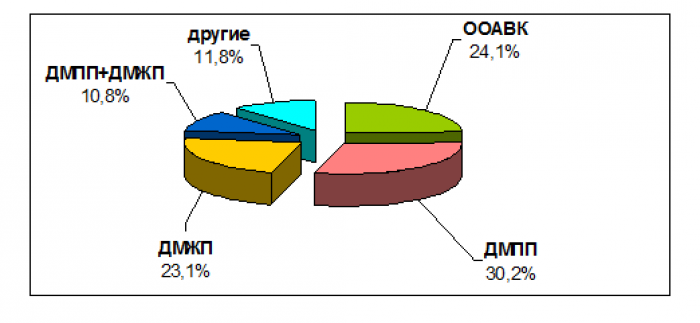
Получены результаты эхокардиографического исследования 428 детей (см. рис.). Врожденные пороки сердца диагностированы у 195 (195/428), что составило 45,6 %. В структуре этих аномалий у детей с синдромом Дауна чаще отмечался дефект межпредсердной перегородки (ДМПП), а именно в 30,2 % (59/195) случаев. Общий атриовентрикулярный канал (ОАВК) составил 24,1 % (47/195), дефект межжелудочковой перегородки (ДМЖП) – 23,1 % (45/195), сочетание дефектов межпредсердной и межжелудочковой перегородок (ДМПП+ДМЖП) – 10,8 %. Другие пороки, такие как тетрада Фалло, стеноз легочной артерии и др., в сумме составили 11,8 % (23/195). Персистенция гемодинамически значимого открытого артериального протока (ОАП), потребовавшего оперативного вмешательства, была выявлена в 2,8 % (12/428).
 Структура сердечных аномалий у детей с синдромом Дауна
Структура сердечных аномалий у детей с синдромом Дауна
Почти все исследуемые нами дети родились доношенными. Срок родов составил 38,2 ± 1,3 недель. Однако при оценке антропометрических данных новорожденных с синдромом Дауна и врожденными пороками сердца оказалось, что их физическое развитие страдает еще внутриутробно. Задержка физического развития (ЗВУР) – масса тела при рождении ниже 10 перцентилей в соответствии со сроком гестации в сравнении с показателями физического развития Г. М. Дементьевой, Е. В. Короткой – отмечалась у 18,7% детей. У всех новорожденных с сердечными аномалиями наблюдалась асимметричная форма ЗВУР (Pounderal Index, PI>25). Вероятно, задержка физического развития формировалась под влиянием, в основном, не генетического фактора.
Известно, что у новорожденных с синдромом Дауна нередко отмечается морфофункциональная незрелость (по нашим данным, она встречается в 17,9 % случаев). У детей с морфофункциональной незрелостью часто недооцениваются размеры дефекта межпредсердной перегородки, который рассматривают как открытое овальное окно даже при гемодинамической его значимости, и артериального протока, в то время как имеет место недостаточность кровообращения. Застойная легочная гипертензия приводит к развитию пневмонии. Возникновение и затяжное течение пневмонии у детей с синдромом Дауна объясняется характерными для них иммунологическими нарушениями.
Хорошо известно, что манифестация сердечной недостаточности у детей раннего возраста, в отличие от детей старшего возраста, может протекать под маской других состояний. Помимо классических симптомов, таких как тахикардия (учащение сердцебиения), тахипноэ (увеличение частоты дыхания), цианоз кожи и слизистых, типичны вялое сосание, снижение темпов физического и психомоторного развития. В подобных случаях у педиатров возникают определенные затруднения в проведении дифференциальной диагностики при наличии у ребенка синдрома Дауна. У таких детей клинические симптомы недостаточности кровообращения могут расцениваться как проявления особенностей психомоторного развития, типичных для синдрома Дауна. Так, если возникают трудности вскармливания: ребенок вялый, неохотно берет грудь или соску, вяло сосет, не может высосать необходимый объем питания, вплоть до полного отказа от кормлений, такие проблемы часто объясняются мышечной гипотонией, общей вялостью, характерной для детей с синдромом Дауна, с последующим назначением общеукрепляющего массажа, что ухудшает состояние ребенка. В дальнейшем отмечается плохая прибавка в весе. Она направляет клиницистов на выявление патологии со стороны желудочно-кишечного тракта, гипогалактии у матери, исследования качества молока, его инфицированности. В борьбе с прогрессирующей гипотрофией младенца нередко переводят на искусственные смеси. Важно отметить, что гипотрофия может стать причиной отсрочки оперативного лечения порока сердца и/или неблагоприятно повлиять на его исход.
Таким образом, слабая нацеленность педиатров на выявление симптомов недостаточности кровообращения у ребенка с синдромом Дауна затрудняет ее своевременную диагностику, а следовательно, и адекватное лечение врожденного порока сердца.
Наглядным примером будет анализ истории болезни.
Андрей Б., от первой, физиологично протекавшей беременности. Роды в срок. Вес мальчика при рождении – 3000 г., рост – 51см, оценка по шкале АПГАР 88б. Состояние ребенка после рождения удовлетворительное. Отмечались признаки морфофункциональной незрелости, фенотипические признаки синдрома Дауна. С целью подтверждения хромосомной патологии была взята кровь для определения кариотипа. Выявлена регулярная трисомия 21-й хромосомы. С первых суток жизни отмечался систолический шум при аускультации грудной клетки. Для исключения аномалий развития сердца проведено ЭХОКГ и обнаружено открытое овальное окно размером 4 мм. Ребенок был выписан домой под наблюдение участкового педиатра и кардиолога по месту жительства. В дальнейшем мальчик стал вялым, неохотно брал грудь, отмечались частые срыгивания, редкий стул. За месяц ребенок прибавил в весе 210 г. При осмотре обращали на себя внимание признаки недостаточности кровообращения: одышка в покое, умеренная тахикардия. Мальчик был направлен в НЦССХ им. Бакулева, где диагностирован порок развития сердца – дефект межпредсердной перегородки размером 6 мм со значительным нарушением сердечной гемодинамики. Рентгенограмма грудной клетки показала расширение корней легких, КТИ = 57 %. По данным ЭКГ: отклонение электрической оси сердца вправо. В возрасте 4 месяцев проведено оперативное лечение дефекта межпредсердной перегородки.
Успехи в области кардиохирургии за последние десятилетия позволили повысить выживаемость младенцев с синдромом Дауна и патологией сердечнососудистой системы с 78 % в 1985 г до 90 % к 2004 г. (Claire Irving и др., 2008).
Hijii Т. и др. (1997) сообщили, что до 24-летнего возраста доживают 87,8 % пациентов с синдромом Дауна, перенесших оперативное лечение врожденного порока сердца.
При сравнении течения и исходов оперативного лечения полной формы атривентрикулярного канала у младенцев с синдромом Дауна и без синдрома, в работе, проведенной на базе НЦССХ им. Бакулева, Т. И. Задко отмечает, что у детей с синдромом Дауна быстрее развивается легочная гипертензия, важным механизмом в развитии которой, очевидно, является окислительный стресс. Генетически обусловленные особенности антиоксидантной системы, в том числе изначально низкий уровень глутатиона и более высокая антиоксидантная активность сыворотки у детей с синдромом Дауна (Н. П. Котлукова, О. И. Артеменко и др., 2008), свидетельствуют о более высоком окислительном стрессе при развитии легочной гипертензии при пороках сердца с легочной гиперволемией.
Из ранних осложнений хирургической коррекции атриовентрикулярного канала у детей с синдромом Дауна чаще встречаются инфекционно-септические осложнения, тогда как у детей без синдрома – острая сердечная недостаточность (Т. И. Задко, 2005). Это обстоятельство объясняется анатомическими особенностями порока и имеющимися иммунологическими нарушениями у младенцев с трисомией 21-й хромосомы.
Выводы
Полученные нами данные частоты сердечных аномалий не противоречат уже известным в литературе. Около половины детей с синдромом Дауна имеют патологию сердечнососудистой системы: 45,5 % – врожденные пороки сердца, 2,8 % – гемодинамически значимый открытый артериальный проток.
Анализ данных проведенных исследований, а также собственные полученные результаты делают очевидной необходимость раннего кардиологического обследования всех новорожденных с синдромом Дауна, включающего помимо осмотра и аускультации проведение эхокардиологического и электрокардиологического исследований. Внимательный подход и оценка клинических симптомов, а также знание генетически обусловленных особенностей детей с синдромом Дауна помогут своевременно диагностировать недостаточность кровообращения и начать адекватную терапию. Все дети с выявленными пороками сердца должны быть консультированы кардиохирургом для определения необходимости и сроков оперативного лечения.
Литература
- Задко Т. И. Синдром Дауна в сочетании с полной формой атриовентрикулярной коммуникации: актуальность, диагностика, сопутствующая патология, анатомия, особенности естественного течения, результаты хирургического лечения // Детские болезни сердца и сосудов. – 2005. – № 6. – С. 10–18.
- Роль окислительного стресса и антиоксидантной системы в патогенезе врожденных пороков сердца / Н. П. Котлукова, О. И. Артеменко, М. П. Давыдова, О. Н. Ильина, Л. А. Курбатова // Педиатрия. – 2009. – Т. 87, № 1. – С. 24–28.
- Cassidy S. B., Allanson J. E. Management of Genetic Syndromes. 2-nd ed. – P. 191–210. URL: https://www.wiley.com/en-us/Management+of+Genetic+Syndromes%2C+3rd+Edition-p-9780470191415
- Correlation between abnormal cardiac physical examination and echocardiographic findings in neonates with Down syndrome / D. B. McElhinney, M. Straka, E. Goldmuntz, E. H. Zackai // American Journal of Medical Genetics. – 2002. – Part A. – P. 238–241.
- Khory M. J., Erickson J. D. Improved ascertainment of cardiovascular malformation in infants with Down syndrome, Atlanta, 1968 through 1989 // Epidemiology. – 1992. – Vol. 136. – P. 1457–1464.
- Life expectancy and social adaptation in individuals with Down syndrome and without surgery for congenital heart disease / T. Hijii, J. Fukushige, H. Igarashi et al. // Clinical Pediatrics. – 1997. –Vol. 36. – P. 327–332.
- Twenty-year trends in prevalence and survival of Down syndrome / C. Irving, A. Basu, S. Richmond et al. // European Journal of Human Genetics. – 2008. – Vol. 16. – P. 1336–1340.
Источник
Причины и механизм развития пороков сердца
Сердце формируется одним из первых из всех органов эмбриона. Уже в первом триместре оно начинает свою работу. Порок сердца при беременности у плода является чаще всего результатом наследственных факторов, болезней женщины, расплатой за вредный образ жизни будущей матери. Реже формирование ВПС связано с другими аномалиями развития эмбриона, например, с синдромом Дауна.
Женщины с высоким риском: кто подвержен опасности?
- перенесших выкидыши, мертворождения;
- возрастом старше 35 лет;
- куривших во время беременности;
- живущих в районах с неблагополучной экологией;
- переболевших на ранних сроках беременности краснухой;
- употреблявших во время беременности аспирин, сульфаниламидные препараты, антибиотики;
- имеющих тяжелый семейный анамнез по порокам сердца.
Врожденный порок сердца – дефект, находящийся в структуре сердца. По статистике, десять детей из тысячи будут иметь диагноз ВПС в своих медицинских картах. И число их будет расти, в основном по причине повышения доступности и эффективности диагностических методик. Сейчас диагноз можно поставить не дожидаясь рождения малыша, с помощью стандартных аналитических систем на различных сроках внутриутробного развития.
 Пороки сердца отличаются разнообразием семиотики. Врачи-кардиологи делят их на «бледные» и «синие». Для первых характерна бледность кожи. К ним относятся в основном дефекты сердечных перегородок. При «синих» кожа приобретает синюшный оттенок. Связано это с тем, что в крови недостаточно кислорода. К «синему» типу пороков относятся более тяжелые состояния: болезнь Фалло, транспозиция магистральных сосудов и другие.
Пороки сердца отличаются разнообразием семиотики. Врачи-кардиологи делят их на «бледные» и «синие». Для первых характерна бледность кожи. К ним относятся в основном дефекты сердечных перегородок. При «синих» кожа приобретает синюшный оттенок. Связано это с тем, что в крови недостаточно кислорода. К «синему» типу пороков относятся более тяжелые состояния: болезнь Фалло, транспозиция магистральных сосудов и другие.
К комбинированным принято относить патологии клапанов сердца. Они вызываются недоразвитием створок, а также их склеиванием, как правило, из-за перенесенной матерью при беременности вирусной инфекции.
Самый важный период в развитии сердца — с четырнадцатого по шестидесятый день от зачатия. Именно тогда сердце разделится перегородками и станет четырехкамерным, из общего артериального ствола выделится аорта и легочная артерия, образуется желудочек, сформируются клапаны.
Если в любой из этих важных для развития эмбриона дней беременный организм столкнется с угрозой, вполне возможны последствия в виде формирования дефекта в сердечно-сосудистой системе.
Как правило, о многих пороках сердца будущие родители узнают на первом скрининге, то есть, начиная с 12 недели беременности. Если аномалия слишком тяжела, после ряда уточняющих обследований матери будет предложено прервать беременность. Если ВПС будущего ребенка совместим с жизнью, у родителей будет время подготовиться к неизбежной после его рождения операции на сердце.
В некоторых регионах России уже сейчас проводятся внутриутробные операции на сердце, позволяющие малышу родиться полностью здоровым.
Клинические проявления во время беременности
 Как правило, беременность плодом с ВПС для женщины мало чем отличается от типичного варианта. Диагноз становится очевидным лишь при проведении УЗИ плода и его сердца, допплерографии или КТГ.
Как правило, беременность плодом с ВПС для женщины мало чем отличается от типичного варианта. Диагноз становится очевидным лишь при проведении УЗИ плода и его сердца, допплерографии или КТГ.
Плод, как правило, страдает от гипоксии и отличается отставанием в развитии. Возможно назначение беременной лекарственных средств, облегчающих работу сердца плода. Но о полной компенсации состояния речь, как правило, речь не идет.
Главная задача матери, вынашивающей ребенка с дефектом развития сердца, — максимально продлить срок беременности в динамике состояния плода.
Диагностика и детализация состояния плода
Основной показатель нормального развития плода – его сердечный ритм.
Нормальные уровни:
- 110-130 ударов до восьмой недели беременности;
- 175-185 до конца первого триместра;
- 145-160 до родов.
На пороки развития сердечно-сосудистой системы плода указывают:
- брадикардия или тахикардия;
- различные временные интервалы между ударами;
- приглушенные звуки сердцебиения – признак кислородного голодания плода.
 Порок сердца у плода на УЗИ становится очевидным в случае визуализации дефекта камер органа. ЧСС будущего ребенка можно посчитать уже в первом триместре беременности на рутинном обследовании при помощи акушерского стетоскопа. Более полную информацию о работе сердца плода даст КТГ, которое назначается после 32 недели беременности. Оценив его результаты, акушеры определяют параметры состояния малыша.
Порок сердца у плода на УЗИ становится очевидным в случае визуализации дефекта камер органа. ЧСС будущего ребенка можно посчитать уже в первом триместре беременности на рутинном обследовании при помощи акушерского стетоскопа. Более полную информацию о работе сердца плода даст КТГ, которое назначается после 32 недели беременности. Оценив его результаты, акушеры определяют параметры состояния малыша.
Основные заключения анализа показателей состояния плода:
- ниже 1,0 — норма;
- 0,8-1,0- пограничное состояние;
- до 2,0 — первичные отклонения. Показано повторное КТГ в течение недели;
- до 3,0 — тяжелые отклонения. Показано стационарное лечение;
- более 3,0- критичное состояние плода, указывающее на его выраженные страдания.
Это доступные и для пациентки, и для врача методики обследования. Они не требуют особой подготовки и не занимают много времени.
Но лидером в исследованиях гемодинамических процессов в сердце и сосудах плода считается доплер-эхокардиография.Этот метод оценивает три основных показателя –направление, скорость и характер кровотока. Процедура такова:на животе беременной устанавливается датчик УЗИ. На экран передается цветное изображение. Красным обозначается течение крови, которая двигается в сторону датчика.Синий цвет указывает на объем крови, идущий в обратном направлении. Максимальная интенсивность того или иного цвета обозначает повышенную гемодинамику.
Чрезвычайно ценную информацию о сердце и самом плоде дает ЭХО-КГ. Исследование может назначаться на любом сроке беременности, но, как правило, выполняется начиная с 12 недели после получения настораживающих показаний первого скрининга.
Это исследование определит:
- направление и скорость кровотока в сосудах;
- проходимость кровяного русла;
- соотношение объемов входящей и выходящей из сердца плода крови;
- ЧСС.
Лучше всего проводить процедуру на сроке от 18 до 24 недели, так как именно в этот срок обеспечивается максимальный визуальный эффект.
Исследования, проведенные ранее этого времени, не будут достаточно объективными из-за малых размеров сердца. К концу беременности ЭХО-КГ плода редко используется из-за большого объема живота, затрудняющего визуализацию органа.
К решению вопросов, касающихся результатов исследования плода с ВПС, привлекается детский кардиолог и кардиохирург.
Тактика ведения беременной
 Акушерская тактика ведения беременной, которая вынашивает плод с ВПС представляет собой постановку вопроса об амнио- или кордоцентезе после тщательного эхокардиографического исследования. Их цель — получить материал для проведения хромосомного анализа. Если дефект выявится у нежизнеспособного эмбриона, беременной будет предложен аборт. Срок при этом не имеет никакого значения, особенно если порок сердца будет сочетаться с генетическими аномалиями.
Акушерская тактика ведения беременной, которая вынашивает плод с ВПС представляет собой постановку вопроса об амнио- или кордоцентезе после тщательного эхокардиографического исследования. Их цель — получить материал для проведения хромосомного анализа. Если дефект выявится у нежизнеспособного эмбриона, беременной будет предложен аборт. Срок при этом не имеет никакого значения, особенно если порок сердца будет сочетаться с генетическими аномалиями.
Если ВПС совместим с жизнью, беременная будет до конца срока находится под усиленным наблюдением акушеров. По истечению сорока недель ей будет предложено госпитализироваться для родов в специализированный перинатальный центр. Как правило, у подобного плода показано родоразрешение при помощи кесарева сечения.
После родов малыш будет переведен для обследования, лечения и возможной хирургической операции в кардиологическое отделение детской больницы.
Выводы
Любой порок развития плода, выявленный при беременности, — это всегда сложная проблема и для будущей матери и для обеспечивающих ее течение врачей. Аномалия сердца — не исключение. Сейчас существует множество достоверных методик, позволяющих на ранних сроках опровергнуть или подтвердить диагноз ВПС, оценить состояние, сделать предположение о его жизнеспособности. Почти все они широко применяются и доступны пациенткам.
Источник
