Синдром делеции длинного плеча 22 хромосомы

Синдром Ди Джорджи — генетическое заболевание, первичный иммунодефицит, характеризующийся наличием у детей различных пороков развития. Неполноценный иммунный ответ обуславливает частые бактериальные и другие инфекции, которые отличаются тяжелым течением. При обследовании ребенка с заболеванием оценивается иммунологический статус, проводятся генетические анализы и исследования внутренних органов. Существующая терапия носит симптоматический характер: хирургические вмешательства с коррекцией пороков развития, а иммунодефицит устраняется с помощью иммунологического лечения.
Развитие болезни
Синдром Ди Джорджи характеризуется развитием иммунодефицита и присоединением вторичных инфекций
Ген TBX1 контролирует процесс эмбриогенеза во внутриутробном периоде. Он расположен на длинном плече 22 хромосомы. У пациентов с синдромом Ди Джорджи часто находят отдельные мутации в гене TBX1, что свидетельствует о его роли в развитии болезни. Следует отметить, что возможны и другие генетические аномалии, связанные с изменениями в других хромосомах.
Специалисты считают, что дефект возникает в процессе развития сперматозоидов или яйцеклеток. Изменения в них развиваются случайно, на фоне длительного воздействия негативных факторов. В небольшой части случаев, синдром Ди Джорджи носит наследственный характер с прослеживающимся семейным анамнезом.
Патогенез болезни связан с тем, что нарушения в гене TBX1 и его аналогах приводят к нарушению развития фарингеальных мешков. Они служат источников развития сердца, средостения, неба и других тканей. В результате этого при синдроме возникают аномалии их развития. В патогенезе иммунодефицита аналогичный механизм — у больных нарушается развитие тимуса, который ответственен за созревание лимфоцитов.
Клинические проявления
При синдроме Ди Джорджи часто возникают инфекции
Симптомы заболевания выявляются после рождения. Это касается аномалий лица: «заячья губа», расщепления неба и недоразвитие нижней челюсти. Многие дети с патологией имеют дефекты лицевого черепа. Врачи отмечают уменьшение размеров носа при сопутствующем увеличении переносицы, маленький рот и деформацию ушных хрящей. При легкой форме патологии изменения лица могут быть выражены слабо и не замечаются при внешнем осмотре специалистами.
Первый симптом патологии — изменения, связанные с врожденными пороками сердца. Последние могут носить различный характер. При незначительном дефекте отмечается незаращение Боталлова протока, дефекты перегородок и др. Тяжелые варианты патологии характеризуются тетрадой Фалло и другими комплексными пороками развития. Указанные состояния характеризуются симптомами сердечно-сосудистой недостаточности, в том числе цианозом. Если ребенку не будет вовремя оказана медицинская помощь, то возможна его ранняя гибель. В связи с нарушениями развития паращитовидных желез и развитием гипокальциемии у детей возникают судороги, что может приводить к ошибочной диагностике эпилепсии и других эндокринологических болезней.
Gрвичный иммунодефицит, связанный с неправильным формированием или полным отсутствием тимуса, характеризуется снижением выработки лимфоцитов. Такие пациенты часто болеют, для них характерно тяжелое течение и низкая эффективность проводимой терапии. Иммунодефицит схож с проявлениями патологии Чедиака-Хигаси и другими врожденными дефектами иммунитета.
Диагностические мероприятия
Диагностика патологии основывается на комплексном подходе. Обследование проводится по следующему алгоритму:
- Врач беседует с родителями ребенка. Необходимо установить давность наличия аномалий лица, а также симптомы, которые могут быть связаны с другими болезнями: цианоз, судорожные приступы и др. Родители отмечают, что дети часто болеют, а инфекции продолжаются несколько недель, несмотря на проводимое лечение.
- Внешний осмотр позволяет выявить характерные изменения лицевого скелета, в том числе, «заячью губу», изменения строения твердого неба и др.
- Ультразвуковое исследование тимуса выявляет уменьшение его размеров или полное отсутствие вилочковой железы. При проведении УЗИ области щитовидной железы врачи отмечают изменения в паращитовидных железах.
- При проведении ЭхоКГ и других методов обследования сердца выявляются его дефекты — открытое овальное окно, дефект межжелудочковой перегородки, стеноз аорты и пр. Характерно поражение крупных сосудов средостения.
- Анализ крови определяет снижение количества Т-лимфоцитов, которое происходит из-за недоразвития тимуса. При дополнительном обследовании выявляется уменьшение числа иммуноглобулинов. Эти белки обеспечивают гуморальный иммунный ответ. При биохимическом исследовании крови определяют снижение уровня паратгормона и кальция.
- Врач-генетик во время консультаций проводит исследование кариотипа — хромосомного набора в клетках ребенка. помощью ПЦР-исследования или проведения флуоресцентной гибридизации ДНК выявляется делеция в длинном плече 22 хромосомы.
На основании комплексной диагностики выставляется точный диагноз. Необходимо исключить другие генетически обусловленные патологии, имеющие схожие признаки — синдром Ангельмана, комбинированный врожденный иммунодефицит и пр.
Подходы к лечению
Полное выздоровление при заболевании невозможно. Клинические рекомендации направлены на устранение проявлений патологии. При выявлении пороков сердечно-сосудистой системы необходима их ранняя хирургическая коррекция. Декомпенсация работы сердца чревата гибелью ребенка в первые месяцы после рождения. С помощью оперативных вмешательств исправляют дефекты челюстно-лицевой области. Препараты кальция помогают справиться с гипокальцимией и предупредить приступы судорог.
Для устранения иммунологических нарушений и восстановления активности иммунитета проводят заместительную терапию донорскими иммуноглобулинами. Имеется возможность пересадки тимуса в детском возрасте, обеспечивающая созревание собственных Т-клеток у ребенка. Однако хирургическое вмешательство используется не во всех клиниках.
При возникновении у ребенка инфекционных заболеваний используют этиотропную терапию. Антибактериальные средства назначаются на фоне бактериальной инфекции. Грибковое поражение является показанием к назначению противогрибковых препаратов. Подбор лекарственных средств осуществляет только врач.
Прогноз для ребенка
Однозначно оценить прогноз для ребенка нельзя, так как эффективность проводимой терапии и продолжительность жизни зависит от большого числа факторов. Основную угрозу для жизни имеют осложнения сердечно-сосудистых пороков, в частности, при их комбинации. В отсутствии хирургического лечения гибель больного возможна в первые недели жизни.
При доброкачественном течении синдрома на фоне иммунодефицита необходимо соблюдать рекомендации по предотвращению инфицирования организма и раннему лечению инфекционных болезней. Это позволяет не допустить развитие тяжелых гнойных осложнений и сепсиса, которые являются основной причиной гибели детей в более старшем возрасте. Для предупреждения задержки интеллектуального развития проводятся занятия с психологом и упражнения на развитие когнитивных навыков.
Синдром Ди Джорджи в детском возрасте характеризуется выраженным иммунодефицитным состоянием, сприступами судорог и симптомами недостаточности сердечно-сосудистой системы. Для его выявления проводятся комплексные диагностические мероприятия с обязательным исключением патологий, имеющих схожие клинические признаки — болезни Брутона, агенезии тимуса и т.п. С помощью хирургических вмешательств устраняются пороки развития сердца и магистральных сосудов. Заместительная терапия иммуноглобулинами направлена на поддержание иммунитета и предупреждение развития инфекционных осложнений.
Читайте далее: рахит у детей
Источник
Кольцевая 22 хромосома – редкое расстройство, которое характеризуется аномалиями в 22 хромосоме. Сопутствующие симптомы и проявления могут быть очень разнообразными, от случая к случаю. Тем не менее, это расстройство, как правило, связано с развитием умственной отсталости от умеренной до тяжелой степени. Некоторые лица могут также иметь относительно мягкие, неспецифические физические (т.е. диспластические) проявления, в то время как другие могут иметь более отличительные, потенциально серьезные физические отклонения. Согласно информации, указанной в медицинской литературе, общие для всех пациентов проявления включают уменьшенный мышечный тонус (гипотония), нарушение координации, необычная манера ходьбы, трудности в речевой функции и / или некоторые пороки развития черепа и лицевой (черепно-лицевой) области. Такие черепно-лицевые аномалии могут включать в себя необычно маленькую голову (микроцефалия), аномальные складки кожи, которые могут охватывать внутренние углы глаз, необычно большие уши и / или другие пороки развития. Кольцевая 22 хромосома, как правило, вызывается спонтанными или «De Novo» ошибками в самом начале развития эмбриона, которые происходят случайным образом и пока по неизвестным причинам.
Кольцевая 22 хромосома. Эпидемиология
На основании наблюдаемых случаев, кольцевая 22 хромосома развивается у женщин чаще, чем у мужчин. В медицинской литературе зарегистрировано более 50 случаев.
Кольцевая 22 хромосома. Причины
Кольцевая 22 хромосома развивается из-за потери кусочков хромосомы на обоих концах 22 хромосомы, с последующим соединением этих концов.
У лиц с кольцевой 22 хромосомой, сопутствующие симптомы и проявления могут быть очень разнообразны, в зависимости от количества потерянного генетического материала в 22 хромосоме, стабильности кольцевой хромосомы во время последующих клеточных делений (т.е. митоза) и от других факторов.
Кольцевая 22 хромосома, как правило, развивается из-за спонтанных или «De Novo» ошибок в самом начале развития эмбриона. В таких случаях, родители больного ребенка, как правило, имеют нормальные хромосомы. Тем ни менее, были зарегистрированы случаи, в которых кольцевые 22 хромосомы были унаследованы от родителей (семейная передачи). В некоторых случаях, только определенный процент клеток родителя может содержать кольцевые 22 хромосомы, в то время как другие клетки могут иметь нормальные хромосомы (такое событие известно как «мозаицизм»).
Кольцевая 22 хромосома. Симптомы и проявления
Кольцевая 22 хромосома, как правило, характеризуется развитием умственной отсталости, связанной с различными физическими проявлениями, которые могут варьироваться от относительно мягких и неспецифических до более отличительных и потенциально серьезных для здоровья. Отчеты показывают, что физическое развитие и рост находятся норме даже у наиболее пострадавших лиц.

Девочка с кольцевой 22 хромосомой
В дополнение к умственной отсталости, общие черты, связанные с кольцевой 22 хромосомой включают низкий мышечный тонус (гипотония), плохую координацию, неуклюжую и неустойчивую походку, речевые проблемы. Некоторые лица также могут иметь поведенческие отклонения, такие как заметно повышенная двигательная активность и аутизм.
Многие люди с кольцевой 22 хромосомой также развивают пороки черепа и пороки лицевой (черепно-лицевой) области. Они обычно включают в себя аномально маленькую голову (микроцефалия), относительно длинное лицо, толстые, низкие брови, вертикальные складки кожи, которые могут охватывать внутренние уголки глаз и / или большие уши. Некоторые лица также могут иметь дополнительные черепно-лицевые дефекты, такие как большой нос в форме картошки, толстые, полные губы, широко расставленные глаза и / или короткие, узкие складки век. Другие особенности могут включать птоз, высокое нёбо и / или высунутый язык.
Некоторые лица могут также иметь нарушения рук и ног. Такие нарушения могут включать в себя срощение определенных пальцев рук или ног, особенно это касается второго и третьего пальца, недоразвитие костей, ногтей, тонкие пальцы и/или необычно большие руки и ноги.

Мальчик с кольцевой 22 хромосомой
В редких случаях могут наблюдаться другие, более серьезные физические аномалии, такие как структурные пороки развития сердца (врожденные сердечные дефекты), дефекты почек, частичное или полное закрытие анального отверстия тонкой мембраной или ненормальное накопление лимфы в тканях и связанный с ним отек (лимфедема).
В некоторых случаях, некоторые из особенностей, связанные с кольцевой 22 хромосомой, могут напоминать те, которые развиваются у людей с моносомией 22 или с синдромом кошачьего глаза.
Кольцевая 22 хромосома. Похожие расстройства
Симптомы и проявления следующих расстройств могут быть аналогичны тем, которые развиваются у лиц с кольцевой 22 хромосомой. Сравнения могут быть полезными для дифференциальной диагностики:
Моносомия по 22 хромосоме. Это редкое расстройство характеризуется полным отсутствием одной 22-й хромосомы или ее части. В большинстве случаев, у пациентов отсутствует длинное плечо 22-й хромосомы, а у небольшого числа пациентов только часть в этом длином плече. Нарушения могут быть переменными, всё зависит от конкретного места хромосомной делеции. Тем не менее, многие пациенты могут иметь умственную отсталость, тяжелые задержки речи, дефицит роста, снижение мышечного тонуса (гипотония), и / или черепно-лицевые пороки развития – аномально маленькую голову (микроцефалия), большие уши, плоский носовой мост, широко разнесенные глаза (глазной гипертелоризм), вертикальные складки кожи и / или другие проявления. У некоторых пациентов также может быть отсутствие (агенезия) тимуса и паращитовидных желез. Тимус играет важную роль в развитии иммунной системы в период от внутриутробного развития и до периода полового созревания.
Синдром Диджорджи. Этот синдром связан с делецией в локусе 22q11.2. Синдром характеризуется задержками развития, ускоренным ростом, речевыми задержками, мышечной слабостью (миотония) и мягкими структурными дефектами (дисморфизмы).
Синдром кошачьих глаз является редким хромосомным расстройством, при котором одни люди могут иметь легкие симптомы и проявления, в то время как другие могут иметь более серьезные пороки развития, особенно черепно-лицевой области, желудочно-кишечного тракта, сердца и / или почек. Аномалии лицевой области могут включать в себя депрессию носа, косые складки век, широко расставленные глаза, односторонние или двусторонние колобомы, небольшие челюсти (микрогнатия) и / или ненормальные наросты кожи и мелкие углубления перед ушами. Дополнительные физические аномалии могут включать структурные аномалии сердца, неразвитость (гипоплазия) и / или отсутствие (агенезия) почек, невысокий рост и / или другие особенности. Расстройство часто связано с умственной отсталостью.
Кольцевая 22 хромосома. Диагностика
В некоторых случаях диагноз кольцевой 22 хромосомы может быть поставлен еще до рождения (пренатально) при выполнении УЗИ, амниоцентеза, и / или биопсии хориона. С помощью УЗИ можно выявить характерные проявления, которые будут свидетельствовать о хромосомных аномалиях. После чего, врачи могут провести амниоцентез (сбор околоплодной жидкости) или сбор ворсинок хориона для последующего хромосомного анализа, во время которого будет определена кольцевая структура 22 хромосомы.
Диагноз также может быть подтвержден после рождения, на основе тщательного клинического обследования, выявления характерных физических проявлений и на основе того же хромосомного анализа.
Кольцевая 22 хромосома. Лечение
Лечение этого расстройства направлено только на контроль и избавление от конкретных симптомов и проявлений. Такое лечение может потребовать скоординированных усилий команды медицинских работников, таких как педиатров, хирургов и других специалистов.
Для некоторых пациентов, лечение может включать в себя хирургическое вмешательство для исправления некоторых черепно-лицевых или других физических аномалий, потенциально связанных с этим расстройством. Типы и количество хирургических процедур, будут зависеть от тяжести анатомических нарушений, связанных с ними симптомов и других факторов.
Раннее вмешательство может быть важным для любого из таких пациентов. Для детей также будут полезны физическая терапия, логопедия и / или другие медицинские, социальные и / или профессиональные направления. Генетическое консультирование также будет полезным для людей с кольцевой 22 хромосомой и их семей.
Источник
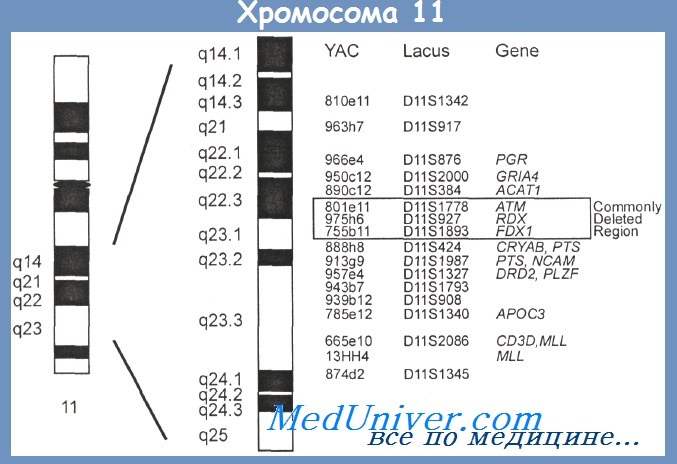
Влияние хромосомных мутаций (кариотипа) на течение и прогноз хронического лимфолейкоза (ХЛЛ)Хромосомные аберрации, числовые и структурные, при использовании метода FISH обнаруживаются у 80 % больных хроническим лимфолейкозом (ХЛЛ). В 15—40 % случаев на протяжении болезни наблюдается эволюция кариотипа с появлением хромосомных аберраций или присоединением новых к уже существующим. Если основными хромосомными изменениями при неходжкинских лимфомах являются транслокации, то при хроничеких лимфолейкозах транслокации практически не встречаются, а самыми частыми нарушениями являются делеции. Наиболее часто (более чем у 55 % больных) обнаруживается делеция длинного плеча хромосомы 13 — 13q14, почти у 20 % больных — делеция длинного плеча хромосомы 11 — 11q22—23, у 7—8 % больных выявляется делеция короткого плеча хромосомы 17-17р13 и у 5—6% больных — делеция длинного плеча хромосомы 6 — 6q21. Много реже, чем потери генетического материала (делеции), обнаруживаются его приобретения. Наиболее частыми являются трисомия хромосомы 12 или увеличение ее длинного плеча (у 15—20 % больных). Как редкие находки описаны делеции 5q, 6p, 9q, 10q, 14q и трисомии хромосом 8 и 3 (всего у 3—5 % больных). У отдельных больных, чаще моложе 50 лет, выявляют сложные хромосомные аберрации, вовлекающие три хромосомы и более. Сопоставление найденных хромосомных аберраций с течением болезни установило отчетливую корреляцию между ними. Анализ кариотипа, клинических проявлений и длительности заболевания у 325 больных показал, что при изолированной делеции 13q наблюдается стабильное состояние или очень медленное прогрессирование с хорошим ответом на терапию (медиана выживаемости 133 мес — такая же, как у больных без хромосомных нарушений). Обнаружение трисомии хромосомы 12, 11q- и 17р- ассоциировано с неблагоприятным течением болезни. Медиана выживаемости больных с трисомией 12 равнялась 114 мес, с делецией 11q — 79 мес, а с делецией 17р —всего 32 мес. Сопоставление выявленных хромосомных аберраций с мутационным статусом у 340 больных показало, что хромосомные аберрации встречаются практически с одинаковой частотой: в группе с мутациями IgVH-генов у 77 %, без мутаций — у 76 % больных. Однако хромосомные аберрации, ассоциированные с благоприятным прогнозом (13q-), достоверно чаще определяются у больных с мутациями IgVH-генов (р=0,003), в то время как 11q- и 17р- — с высокой степенью достоверности при отсутствии мутаций (р=0,002). Эти данные подтверждены работами других исследовательских групп, показавших, что время до прогрессирования болезни достоверно короче у больных с 11q- и 17р-, особенно у больных с этими аберрациями и отсутствием мутаций IgVH-генов, чем у больных с 13q- и трисомией хромосомы 12. В группе больных с аберрацией 6q- было самое короткое время до прогрессирования болезни.
Итальянская кооперативная группа проанализировала методом FISH кариотип 217 больных хроническим лимфолейкозом (ХЛЛ). Делеция 6q21 обнаружена у 13 больных. Исследование мутационного статуса показало примерно равную частоту случаев с мутациями и без мутаций IgVH-генов, но клинически группа с делецией 6q21 была достаточно однородной: у всех больных отмечался высокий лейкоцитоз, у большинства — увеличение селезенки, у многих — атипичная морфология лимфоцитов несмотря на типичный для хронического лимфолейкоза (ХЛЛ) иммунофенотип. Всем больным лечение потребовалось сразу или вскоре после установления диагноза. Продолжительность жизни в этой группе была достоверно короче, чем у больных без данной хромосомной аберрации. Недавно при хроническом лимфолейкозе (ХЛЛ) обнаружена не описанная ранее t(1;6)(p35.3;p25.2). Как подчеркивалось ранее, транслокации не характерны для ХЛЛ. Однако указанная аберрация была обнаружена у 8 больных с типичными для ХЛЛ гематологическими и иммунологическими характеристиками. У 3 больных эта транслокация была единственной хромосомной аберрацией, у остальных сочеталась с характерными для ХЛЛ цитогенетическими изменениями: трисомией хромосомы 12, делециями 11q или 17р. Исследование мутационного статуса показало, что во всех случаях с t(1;6) не было мутаций IgVH-генов. Как известно, делеции часто вовлекают гены, которые являются супрессорами опухолевого роста. Если имеется делеция одного аллеля и мутация, даже точечная, другого, происходит функциональная инактивация соответствующего гена. В области 13ql4 — месте наиболее частой делеции при хроническом лимфолейкозе локализуется ген ретинобластомы RB1, который кодирует фосфопротеин, участвующий в регуляции транскрипции и контроле клеточного цикла. Моноаллельная делеция гена RB1 часто обнаруживается при хроническом лимфолейкозе, но инактивация гена в результате поражения второго аллеля является редкостью. Исследование нескольких других генов, идентифицированных в районе 13q, также не обнаружили при хроническом лимфолейкозе биаллельного выключения. Второй по частоте делецией при хроническом лимфолейкозе является 11q. Наиболее часто делегированным оказывается район 11q22.3—23.1. В этом районе локализованы два гена: АТМ (ataxia telangiectasia mutated) и RDX(radixin), гомолог гена нейрофиброматоза типа 2. Ген ATM кодирует образование белка, имеющего функцию протеинкиназы, участвующей в репарации ДНК и контроле клеточного цикла. Как известно, при атаксии-телеангиэктазии — заболевании, при котором имеется биаллельное изменение гена ATM, наблюдается повышенная частота лимфопролиферативных заболеваний. В больших сериях исследований при хроническом лимфолейкозе не найдено биаллельных изменений указанных генов. Тем не менее, многие наблюдения подтверждают, что аберрации 11q ассоциированы с выраженной лимфаденопатией, часто с увеличением лимфатических узлов в брюшной полости, а иногда и медиастинальных, ранним прогрессированием болезни с быстро наступающей потребностью в терапии и короткой продолжительностью жизни. Обнаруженный низкий уровень экспрессии ряда молекул адгезии, возможно, объясняет более быстрое распространение опухоли при делеции 11q. Н. Dohner и соавт. показали, что наиболее плохой прогноз у больных моложе 55 лет с делецией длинного плеча хромосомы 11: в этой группе медиана выживаемости составила 64 мес, в то время как у больных моложе 55 лет без делеции 11q — 209 мес. В более старшей возрастной группе продолжительность жизни достоверно не различалась — 94 мес и 111 мес для больных с делецией и без делеции 11q соответственно. При высокодозной терапии и последующей аутотрансплантации в случаях с делецией 11q23 достоверно чаще наблюдалось персистирование патологических клеток: при повторных исследованиях в течение 12 мес они постоянно определялись у 38 % больных с делецией 1 lq23 и только у 6 % (р = 0,014) больных без хромосомных аберраций или с другими аберрациями. Изучение экспрессии генов с помощью ДНК-микрочипов обнаружило 78 генов, по экспрессии которых случаи с делецией 1 lq23 достоверно отличались от остальных. До сих пор не удалось точно установить, какой сегмент удваивается при увеличении длинного плеча хромосомы 12; в разных исследованиях получены данные о вовлечении районов 12q13, 12q14, 12q15. Некоторые авторы отмечали нередкую атипичную морфологию лимфоцитов у больных с трисомией хромосомы 12 Разные авторы приводят противоречивые данные о прогностической роли трисомии хромосомы 12, но продолжительность жизни во всех исследованиях оказывается хуже, чем у больных с нормальным кариотипом. При трисомии хромосомы 12 нередко обнаруживается экспрессия Ki 67 — иммунологического маркера повышенной пролиферативной активности. Экспрессия этого маркера при хроническом лимфолейкозе нередко коррелирует с продвинутой стадией болезни. При использовании метода FISH установлено, что трисомия хромосомы 12 нередко сочетается с другими хромосомными аберрациями: делециями длинного плеча хромосом 13 и 14, трисомией хромосом 18 и 19. В отдельных случаях с течением времени трисомия хромосомы 12 появляется как вторая аберрация у больных с другими хромосомными нарушениями. Исследование мутационного статуса обнаружило признаки мутаций IgVH-генов у всех больных с трисомией 12 и отсутствие мутаций почти у всех больных с изменениями хромосомы 14. Анализ продолжительности жизни в зависимости от мутационного статуса и наличия различных изменений кариотипа установил, что продолжительность жизни при изолированной трисомии хромосомы 12 (108 мес) достоверно не отличается от продолжительности жизни больных с комплексными хромосомными аберрациями (89 мес; р = 0,612). В данном исследовании у всех больных с трисомией 12 были признаки мутаций генов IgVH, однако продолжительность жизни в этой группе достоверно не отличалась от продолжительности жизни больных без мутаций (95мес). В другом исследовании из этой же лаборатории на большой группе больных была показана отчетливая корреляция между наличием трисомии хромосомы 12 и отсутствием мутаций IgVH-генов при агрессивном течении хронического лимфолейкоза и наличием мутаций и структурными аномалиями района 13q14 при индолентном течении болезни. – Вернуться в раздел “гематология” Оглавление темы “Хронический лимфолейкоз (ХЛЛ)”:
|
Источник