Синдром гипоплазии левых отделов сердца оксигенотерапия
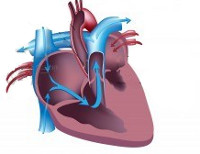
Синдром гипоплазии левых отделов сердца – группа морфологически близких дефектов сердца, включающих недоразвитие его левых отделов, атрезию или стеноз аортального и/или митрального клапанного отверстия, резкую гипоплазию восходящей аорты или комбинацию этих дефектов. Проявления синдрома развиваются по мере закрытия артериального протока, в первые сутки жизни новорожденного и характеризуются признаками кардиогенного шока: тахипноэ, одышкой, слабым пульсом, бледностью и цианозом, гипотермией. Диагноз синдрома гипоплазии левых отделов сердца можно предположить на основании двухмерной эхокардиографии, катетеризации сердца, рентгенографии, ЭКГ. Ведение больных с синдромом гипоплазии левых отделов сердца предполагает инфузию простагландина Е1; проведение ИВЛ, коррекцию метаболического ацидоза; поэтапную хирургическую коррекцию порока (операция Норвуда – операция Гленна или Геми-Фонтена – операция Фонтена).
Общие сведения
Синдром гипоплазии левых отделов сердца (СГЛОС) – термин, используемый для обозначения критического врожденного порока сердца, характеризующегося резким недоразвитием его левых камер и восходящей части аорты, а также митральным или аортальным стенозом. Синдром входит в пятерку наиболее часто встречающихся в кардиологии ВПС, наряду с дефектом межжелудочковой перегородки, транспозицией магистральных сосудов, тетрадой Фалло и коарктацией аорты. СГЛОС составляет 2-4% от всех встречающихся врожденных аномалий сердца, являясь ведущей причиной гибели новорожденных в первые дни и недели жизни. Мальчики страдают данным сочетанным пороком сердца в 2 раза чаще, чем девочки.

Синдром гипоплазии левых отделов сердца
Причины СГЛОС
Причины гипоплазии левых отделов сердца достоверно неясны. Предполагается возможность аутосомно-рецессивного, аутосомно-доминантного и полигенного типов наследования. Наиболее вероятной является теория мультифакториальной этиологии порока.
Различают два морфологических варианта СГЛОС. Первый (наиболее тяжелый) вариант включает гипоплазию левого желудочка и атрезию устья аорты, которые могут сочетаться с атрезией либо стенозом митрального отверстия; при этом полость левого желудочка щелевидна, ее объем составляет не более 1 мл. При втором (наиболее распространенном) варианте порока имеет место гипоплазия левого желудочка, стеноз устья аорты и гипоплазия ее восходящего отдела в сочетании с митральным стенозом; объем полости левого желудочка равен 1-4,5 мл.
Оба варианта гипоплазия левых отделов сердца сопровождаются наличием широкого открытого артериального протока и открытого овального окна, расширением правых отделов сердца и ствола легочной артерии, гипертрофией миокарда правого желудочка; нередко – фиброэластозом эндокарда.
Особенности гемодинамики
Тяжелые расстройства кровообращения при гипоплазии левых отделов сердца развиваются вскоре после рождения и характеризуются в литературе как «гемодинамическая катастрофа». Сущность нарушения гемодинамики определяется тем фактом, что кровь из левого предсердия не может поступить в гипоплазированный левый желудочек, а вместо этого попадает через открытое овальное окно в правые отделы сердца, где происходит ее смешение с венозной кровью. Эта особенность приводит к объемной перегрузке правых отделов сердца и их дилатации, которые наблюдаются с момента рождения.
В дальнейшем основной объем смешанной крови из правого желудочка поступает в легочную артерию, остальная же часть недонасыщенной кислородом крови через открытый артериальный проток устремляется в аорту и большой круг кровообращения. Ретроградным путем небольшое количество крови поступает в гипоплазированную часть восходящей аорты и венечные сосуды.
Фактически правый желудочек берет на себя двойную функцию, перекачивая кровь в легочный и системный круг кровообращения. Попадание крови в большой круг кровообращения возможно только по артериальному протоку, в связи с чем гипоплазия левых отделов сердца рассматривается как порок с дуктус-зависимым кровообращением. Прогноз для жизни ребенка зависит от сохранения артериального протока открытым.
Тяжелейшие расстройства гемодинамики приводят к выраженной легочной гипертензии вследствие высокого давления в системе сосудов малого круга; артериальной гипотонии, обусловленной неадекватным наполнением большого круга; артериальной гипоксемии, связанной со смешением крови в правом желудочке.
Симптомы СГЛОС
Клинические признаки, указывающие на гипоплазию левых отделов сердца, проявляются в первые часы или сутки после рождения. По своим проявлениям они схожи с респираторным дистресс-синдромом или кардиогенным шоком.
Как правило, дети с СГЛОС рождаются доношенными. У новорожденных наблюдается адинамия, сероватый цвет кожных покровов, тахипноэ, тахикардия, гипотермия. При рождении цианоз выражен незначительно, однако вскоре нарастает и становится диффузным либо дифференцированным, только на нижней половине туловища. Конечности наощупь холодные, периферическая пульсация на них ослаблена.
С первых дней жизни нарастает сердечная недостаточность с застойными хрипами в легких, увеличением печени, периферическими отеками. Характерно развитие метаболического ацидоза, олигурии и анурии. Нарушение системной циркуляции сопровождается неадекватной церебральной и коронарной перфузией, что приводит к развитию ишемии головного мозга и миокарда. В случае закрытия артериального протока ребенок быстро погибает.
Диагностика
Во многих случаях диагноз синдрома гипоплазии левых отделов сердца ставится еще до рождения ребенка при проведении ЭхоКГ плода. При объективном обследовании новорожденного ребенка определяется слабый пульс на руках и ногах, одышка в покое, усиленный сердечный толчок и видимая эпигастральная пульсация; выслушивается систолический шум изгнания, ритм галопа и одинарный II тон.
На ЭКГ отмечается отклонение ЭОС вправо, признаки резкой гипертрофии правых отделов сердца и левого предсердия. Фонокардиография фиксирует наличие низко- или среднеамплитудного систолического шума. Рентгенография грудной клетки при синдроме гипоплазии левых отделов сердца выявляет высокую степень кардиомегалии, шарообразные контуры сердечной тени, усиление легочного рисунка.
Эхокардиография обнаруживает следующие характерные признаки гипоплазии сердца: стеноз устья аорты и ее восходящего отдела, уменьшение размеров левого желудочка и увеличение правого желудочка, грубые изменения митрального клапана.
Зондирование полостей сердца обнаруживает пониженное насыщение крови кислородом в периферических артериях, лево-правый сброс крови на уровне предсердий, повышенное давление в правом желудочке и легочной артерии. Ангиокардиография позволяет визуализировать открытый артериальный проток, гипоплазированную восходящую аорту, резко дилатированный правый желудочек, расширенный легочный ствол и легочные артерии.
Дифференциальный диагноз при синдроме гипоплазии левых отделов сердца необходим с гипоплазией правого желудочка, единственным желудочком сердца, аномальным дренажем легочных вен, транспозицией магистральных сосудов, изолированным аортальным стенозом. Из внесердечных аномалий необходимо исключить острую дыхательную недостаточность, травму черепа, кровоизлияние в мозг.
Лечение СГЛОС
Наблюдение за новорожденными осуществляется в отделении реанимации. Для предупреждения закрытия или попытки открытия артериального протока осуществляется инфузия простагландина Е1. Необходимо проведение ИВЛ, коррекция метаболического ацидоза, введение диуретиков и инотропных препаратов.
Хирургическая коррекция гипоплазии левых отделов сердца проводится поэтапно и последовательно. Первый этап лечения – паллиативный; проводится в первые 2 недели жизни и заключается в выполнении операции Норвуда для уменьшения нагрузки на легочную артерию, и в то же время, для обеспечения кровоснабжения аорты. На втором этапе, в возрасте 3-6 месяцев ребенку выполняется операция Геми-Фонтена (или операция Гленна по наложению двухстороннего двунаправленного кава-пульмонального анастомоза). Окончательная гемодинамическая коррекция порока проводится примерно через год путем выполнения операции Фонтена (наложения тотального кавопульмонального анастомоза), позволяющей полностью разобщить круги кровообращения.
Прогноз
Порок является крайне неблагоприятным в отношении прогноза. В первый месяц жизни погибает около 90% детей с гипоплазией левых отделов сердца. Выживаемость после 1-го корригирующего этапа составляет 75 %, после 2-го – 95 %, после 3-го – 90 %. В целом через 5 лет после полной коррекции порока в живых остаются 70% детей.
Если гипоплазия левых отделов сердца выявляется у ребенка внутриутробно, ведение беременности и родоразрешение проводится в условиях специализированного перинатального медицинского центра. С первых дней жизни ребенок должен находиться под наблюдением неонатолога, детского кардиолога и кардиохирурга для проведения как можно более ранней коррекции порока.
Источник
Синдром гипоплазии левых отделов сердца состоит из гипоплазии левого желудочка и восходящей аорты, недоразвития и гипоплазии аорты и митрального клапана (атрезия аорты часто присутствует), дефекта межпредсердной перегородки, а также открытого артериального протока. Если только нормальное закрытие открытого артериального протока не будет остановлено инфузией простагландина, последуют кардиогенный шок и смерть. Распространены громкий одиночный II тон сердца (S2) и неспецифический систолический шум. Диагноз ставят на основании результатов неотложной эхокардиографии. Окончательное лечение – многоэтапная хирургическая коррекция или трансплантация сердца.
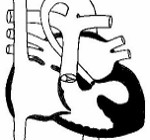
Синдром гипоплазии левых отделов сердца (СГЛОС) составляет от 2% до 4% от врожденных аномалий сердца и является вторым из наиболее распространенных обструктивных поражений левых отделов сердца. Поскольку митральный клапан, левый желудочек и аортальный клапан являются гипопластичными (часто с атрезией аорты), оксигенированная кровь, поступающая в левое предсердие от легких, отводится через предсердный канал в правые отделы сердца, где она смешивается с десатурированным системным венозным возвратом (см. рисунок Гипоплазия левых отделов сердца [Hypoplastic left heart]). Эта относительно десатурированная кровь выходит из правого желудочка через легочную артерию в легкие и через открытый артериальный проток в большой круг кровообращения. Системный кровоток поддерживается только через анастомозы протоков со скидом крови справа налево, поэтому немедленное выживание зависит от проходимости артериального протока.
Гипоплазия левых отделов сердца
Левый желудочек, восходящая аорта и аортальный и митральный клапаны гипопластичные; дефект межпредсердной перегородки и большой открытый артериальный проток также присутствуют. АО = аорта; IVC = нижняя полая вена; LA = левое предсердие, LV = левый желудочек; PA = легочная артерия; PV = легочные вены; RА = правое предсердие ; RV = правый желудочек; SVC = верхняя полая вена. |
Клинические проявления
Симптомы гипоплазии левых отделов сердца появляются, когда артериальный проток начинает закрываться в течение первых 24–48 ч жизни. Впоследствии быстро развивается клиническая картина кардиогенного шока (например, учащенное дыхание, одышка, слабый пульс, бледность, цианоз, гипотермия, метаболический ацидоз, вялость, олигурия или анурия). Когда системный кровоток скомпрометирован, коронарная и церебральная перфузия может быть снижена, что приводит к симптомам сердечной или мозговой ишемии. Перфузия почек, печени и брыжейки также неадекватна, поэтому олигурия или анурия встречаются часто. Если артериальный проток снова не открыть, смерть наступает быстро.
У пациента часто в анамнезе присутствует недостаточное питание, усиление работы мышц при дыхании, бледность или серый оттенок кожных покровов и вялость. Объективное обследование показывает очень активный прекордиум с заметным левым парастернальным сердечным толчком, ассоциируемым с очень плохой периферической перфузией, холодные конечности, синевато-серый цвет кожи и отсутствие или едва ощутимый пульс. II тон сердца (S2) громкий и одиночный. Часто присутствует мягкий, неспецифический систолический шум, как и гепатомегалия. Тяжелый метаболический ацидоз является типичным, часто ухудшается на фоне применения дополнительного кислорода, что характерно для синдрома гипоплазии левых отделов сердца.
Рентгенография грудной клетки и ЭКГ
Эхокардиография
Синдром гипоплазии левых отделов сердца диагностируется на основе клинических данных, особенно у новорожденных с метаболическим ацидозом, который усиливается после получения кислорода, так как кислород снижает легочное сосудистое сопротивление и, следовательно, увеличивает относительную долю выноса правого желудочка, которая течет в легкие, а не через открытый артериальный проток к телу. Диагноз подтверждают на основании результатов экстренной эхокардиографии.
Катетеризация сердца требуется редко.
Рентгенограмма органов грудной клетки выявляет кардиомегалию и легочный венозный застой или отек легких. ЭКГ: выражена гипертрофия правого желудочка и снижение сократительной силы левого желудочка, однако это может быть в пределах нормы для новорожденного.
Инфузии простагландина E1 (PGE1)
Многоэтапное хирургическое восстановление
Иногда трансплантация сердца
К счастью, большинство пациентов с синдромом гипоплазии левых отделов сердца в настоящее время диагностируются с помощью пренатального ультразвукового исследования или фетальной эхокардиографии, что позволяет начать введение простагландина E1 и других необходимых медикаментов сразу после рождения и до возникновения гипоперфузии органов.
Все педиатрические пациенты с синдромом гипоплазии левых отделов сердца подлежат немедленной стабилизации в неонатальном отделении интенсивной терапии или в детском кардиологическом отделении интенсивной терапии. Следует быстро обеспечить сосудистый доступ через пуповинный венозный катетер и/или периферическмй внутривенный в зависимости от того, что будет быстрее. Для предотвращения закрытия артериального протока либо для расширения суженного протока вводят PGE1 (начиная с 0,05 до 0,1 мкг/кг/мин внутривенно). Новорожденные, особенно те, которые находятся в критическом состоянии, как правило, требуют интубации и искусственной вентиляции легких. Метаболический ацидоз устраняют инфузией бикарбоната натрия. Тяжелобольным новорожденным с кардиогенным шоком могут потребоваться инотропные препараты (например, милринон), мочегонные средства для улучшения сердечной функции и контроля объема.
Очень важно поддерживать легочное сосудистое сопротивление относительно высоким, а системное сосудистое сопротивление низким, чтобы предотвратить выраженную избыточную циркуляцию в легких за счет системной перфузии. Эти диапазоны резистентности поддерживаются для того, чтобы избежать гипероксии, алкалоза и гипокарбии, каждая из которых может привести к легочной вазодилатации. Поскольку кислород является одним из самых мощных легочных вазодилататоров, младенцы получают вентиляцию комнатным воздухом или даже гипоксическими газовыми смесями для достижения системной сатурации до уровня 70–80%. Если ребенок нуждается в искусственной вентиляции легких, PСО2 может удерживаться на верхней границе нормы или незначительно повышенном уровне. При управлении системным сосудистым сопротивлением нужно избегать или свести к минимуму использование сосудосуживающих препаратов (например, адреналин или высокие дозы допамина). Милринон (в РФ не зарегистрирован) может быть полезен, потому что может привести к системной вазодилатации.
Выживание, в конечном счете, требует многоэтапных хирургических процедур, позволяющих правому желудочку функционировать в качестве системного желудочка и контролировать легочный кровоток.
Этап 1, который проводят в течение первой недели жизни, является процедурой Норвуда. Основная легочная артерия делится, дистальная культя закрывается с помощью лоскута, а гипопластическая аорта и проксимальная легочная артерия объединяются в неоаорту. Артериальный проток перевязывают. Легочный кровоток восстанавливается путем введения правостороннего модифицированного шунта Блэлока-Тауссига или создания кондуита правый желудочек-легочная артерия (модификация Сано). В конечном счете, соединение в межпредсердной перегородке увеличивается.
Альтернативные гибридные процедуры, часто результат совместных усилий кардиохирургов и интервенционных кардиологов, включают размещение стента в артериальном протоке (для поддержания системного кровотока) и процедуру суживания ветвей легочной артерии (чтобы ограничить легочной кровоток). В некоторых центрах гибридные процедуры предназначены для пациентов более высокого риска (например, недоношенных детей, и детей с мультисистемной органной дисфункцией).
Этап 2, проводимый в возрасте 3–6 месяцев, состоит из двунаправленной процедуры Гленна или геми-Фонтена. При этих процедурах верхняя полая вена соединяется с правой легочной артерией, что позволяет крови обходить правое предсердие и поступать для оксигенации непосредственно в легкие. В отличие от операции двунаправленного анастомоза Гленна, при операции геми-Фонтена верхняя полая вена не полностью отделяется от правого предсердия.
Третий этап, выполняемый в 18–36 мес, представляет собой модифицированную операцию Фонтен, при которой ток крови из нижней полой вены перенаправляется к кавопульмональному анастомозу (соединению верхней полой вены и легочной артерии). Изменение направления может быть выполнено через перегородку в правом предсердии или с помощью трансплантата экстракардиальной трубки.
Риск смертности у детей с синдромом гипоплазии левых отделов сердца наиболее высок в первый год жизни (1). Примерно 90% пациентов, которые переживут младенческий возраст, доживут до 18 лет. Как и другие дети со сложными врожденными пороками сердца, выжившие могут иметь некоторую степень нарушения нервного развития, которые могут быть связаны с существующей аномалией развития ЦНС или явной или скрытой гипоперфузией или тромбоэмболией ЦНС, возникающими в процессе многоступенчатых процедур.
Для некоторых младенцев с СГЛОС, особенно с тяжелой дисфункцией трикуспидального клапана или желудочка, трансплантация сердца считается процедурой выбора; однако инфузия PGE1 должна быть продолжена вместе с тщательным управлением легочным и системным сосудистым сопротивлением до того момента, когда донорское сердце станет доступным. Поскольку наличие донорских сердец очень ограничено, около 20% младенцев умирают в ожидании трансплантации. Показатели 5-летней выживаемости после трансплантации и после многоступенчатого оперативного вмешательства аналогичны. После пересадки сердца обязателен прием иммунодепрессантов. Эти препараты делают пациентов более восприимчивыми к инфекции и вызывают патологические изменения в коронарных артериях пересаженного сердца у значительного процента пациентов в течение 5-летнего периода. Единственное известное лечение аллотрансплантат-ассоциированной ИБС – ретрансплантация.
Профилактика эндокардита рекомендуется по крайней мере, в течение 6 месяцев после каждого хирургического вмешательства или до тех пор, пока у пациента сохраняется цианоз или остаточный дефект, примыкающий к месту хирургического вмешательства или протезному материалу.
При синдроме гипоплазии левых отделов сердца присутствуют гипоплазия левого желудочка и восходящей аорты, недоразвитие и гипоплазия аорты и митрального клапана; дефект межпредсердной перегородки и открытый артериальный проток являются необходимыми для системного кровотока (и для немедленного выживания).
Симптомы кардиогенного шока (например, тахипноэ, одышка, слабый пульс, бледность, цианоз, гипотермия, метаболический ацидоз, вялость, олигоурия или анурия) появляются, когда артериальный проток начинает закрываться в течение первых 24–48 ч жизни, что становится более заметным, если используется дополнительный кислород.
Первоначально, назначают PGE1 для поддержания артериального протока открытым, назначают как можно меньше кислорода (чтобы избежать повышения легочного кровотока за счет системного кровотока) и избегают применения вазоконстрикторов, при необходимости назначают гидрокарбонат натрия.
Для окончательного лечения требуются многоэтапные операции.
Источник
