Синдром ломкой х хромосомы причины
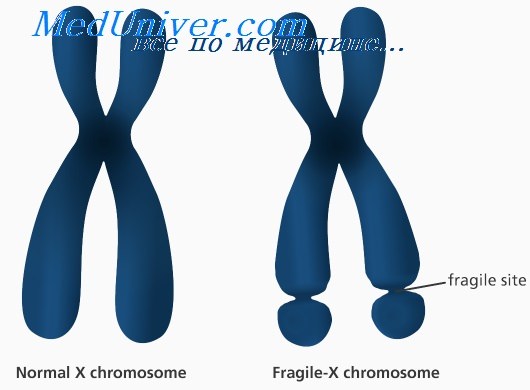
Синдром ломкой Х-хромосомы: причины, диагностика, лечениеЭтиология и встречаемость синдрома ломкой Х-хромосомы. Синдром ломкой Х-хромосомы (MIM №309550) — Х-сцепленное заболевание с задержкой умственного развития, вызванное мутациями в гене FMR1 в Xq27.3. Синдром ломкой Х-хромосомы встречается с частотой 16-25 на 100 000 в общей популяции среди мужчин и в два раза реже среди женщин. Синдром ломкой Х-хромосомы составляет 3-6% всех случаев умственной отсталости среди мальчиков с положительным семейным анамнезом по умственной отсталости при отсутствии врожденных пороков. Патогенез синдрома ломкой Х-хромосомыПродукт гена FMR1, FMRP, экспрессируется во многих типах клеток, но наиболее сильно в нейронах. FMRP может сопровождать определенный подкласс мРНК от ядра к рибосомам. Более 99% мутаций в гене FMR1 — экспансия нуклеотидного повтора (CGG)n в 5′-нетранслируемом участке гена. В нормальных аллелях FMR1 число повторов CGG составляет от 6 до приблизительно 50. В патогенных аллелях (или при полных мутациях) количество повторов более 200. Аллели с более чем 200 повторами CGG обычно имеют гиперметилированную последовательность повторов CGG и смежного промотора FMR1. Гиперметилирование инактивирует промотор FMR1, вызывая снижение экспрессии FMRP. Полные мутации возникают из аллелей премутации (от 59 до 200 повторов CGG) с передачей мутантного аллеля FMR1 от матери (но не от отца); фактически при отцовской передаче премутации часто, наоборот, сокращаются. Полные мутации не могут возникать из нормальных аллелей. Поскольку длина неустойчивых повторов CGG увеличивается в каждом последующем поколении, если они передаются женщиной, обычно наблюдается увеличение числа пораженных потомков в последующих поколениях в семье; этот феномен называется генетической антиципацией. Риск экспансии премутации в полную мутацию возрастает с увеличением числа повторов в премутации. Тем не менее не все премутации одинаково предрасположены к экспансии. Хотя премутации встречаются сравнительно часто, переход в полную мутацию наблюдают только в ограниченном количестве гаплотипов, т.е. когда есть склонность гаплотипа к экспансии. Эта склонность гаплотипа частично может быть связана с присутствием нескольких триплетов AGG, вставленных в последовательность повторов CGG; оказывается, такие триплеты AGG тормозят экспансию повторов CGG, следовательно, их отсутствие в некоторых гаплотипах может предрасполагать к экспансии.
Фенотип и развитие синдрома ломкой Х-хромосомыСиндром ломкой Х-хромосомы вызывает умеренную умственную отсталость у мужчин и легкую умственную задержку у женщин. Наиболее пораженные индивидуумы также имеют поведенческие аномалии, включая гиперактивность, размахивание руками, истерики, плохой зрительный контакт и признаки аутизма. Физические характеристики мужчин изменяются с пубертатом. До полового созревания пораженные мальчики имеют несколько увеличенный размер головы и некоторые другие неотчетливые симптомы; после наступления половой зрелости у них частые более отчетливые признаки (длинное лицо с выдающейся челюстью и лбом, крупные ушные раковины, макроорхидизм). Поскольку эти клинические признаки не уникальны для синдрома ломкой Х-хромосомы, диагноз зависит от молекулярного обнаружения мутаций. Пациенты с синдромом ломкой Х-хромосомы имеют нормальную продолжительность жизни. Почти все мужчины и 40-50% женщин, унаследовавших полную мутацию, будут иметь синдром ломкой Х-хромосомы. Тяжесть фенотипа зависит от мозаицизма метилирования повторов и их числа. Поскольку полные мутации неустойчивы, некоторые пациенты имеют смесь клеток с числом повторов, колеблющимся от премутации до полной мутации (мозаицизм числа повторов). Все мужчины с мозаицизмом числа повторов больны, но часто имеют более высокие показатели умственного развития, чем пациенты с полной мутацией в каждой клетке; у женщин с мозаицизмом числа повторов клинические проявления варьируют от нормы до полного проявления. Аналогично некоторые пациенты имеют смесь клеток с метилированием повторов CGG и без него (мозаицизм метилирования повторов). Все мужчины с мозаицизмом метилирования больны, но часто имеют более высокие показатели умственного развития, чем с гиперметилированием в каждой клетке; женщины с мозаицизмом метилирования также могут быть здоровыми или больными.
Очень редко пациенты имеют полную мутацию, неметилированную во всех клетках; независимо от пола, степень тяжести у них варьирует от нормы до полной клиники. Кроме того, у женщин фенотип зависит от степени смещения инактивации Х-хромосомы. Носительницы премутации (но не полных мутаций) имеют 20% риск ранней дисфункции яичников. Мужчины-носители премутации имеют риск развития синдрома FXTAS. FXTAS проявляет себя как поздняя прогрессирующая мозжечковая атаксия с интенционным тремором. У больных могут также присутствовать снижение краткосрочной памяти и двигательных функций, когнитивные нарушения, а также паркинсонизм, периферическая нейропатия, проксимальная мышечная слабость нижних конечности и дизавтономия. Пенетрантность FXTAS зависит от возраста, обнаруживается в 17% в течение шестого десятилетия жизни, в 38% в течение седьмого десятилетия, в 47% в течение восьмого десятилетия и в трех четвертях старше 80 лет. FXTAS может встречаться и у некоторых женщин — носительниц премутации. Особенности фенотипических проявлений синдрома ломкой Х-хромосомы: Лечение синдрома ломкой Х-хромосомыК настоящему времени никакого патогенетического лечения при синдроме ломкой Х-хромосомы нет. Помощь направлена на обучение и фармакологическое лечение поведенческих проблем. Риски наследования синдрома ломкой Х-хромосомыРиск того, что женщина с премутацией будет иметь больного ребенка, определяется размером премутации, полом плода и семейным анамнезом. Эмпирически риск для носителя перестройки иметь больного ребенка может достигать 50% для каждого мальчика и 25% для каждой девочки, но зависит от размера премутации. На основе анализа сравнительно небольшого количества матерей-носительниц известно, что риск повторения может снижаться, если премутация уменьшается со 100 до 59 повторов. Пренатальная диагностика доступна за счет использования ДНК плода из ворсин хориона или амниоцитов. Пример синдрома ломкой Х-хромосомы. Р.Л., 7-летний мальчик, направлен в клинику педиатрии в связи с умственной задержкой и гиперактивностью. Он не смог посещать детский сад, поскольку был агрессивным, не в состоянии выполнять задания, имел бедные речевые и двигательные навыки. Несмотря на задержанное развитие, он не потерял основных этапов: сидел к 10-11 мес, ходить начал в 20 мес, говорил два или три ясных слова в 24 мес. В остальном ребенок здоров. Его мать и тетя по матери имели небольшие проблемы обучения в детстве, дядя по матери умственно задержан. Данные медицинского осмотра в норме, за исключением гиперактивности. Врач рекомендовал несколько тестов, включая кариотипирование, функциональные исследования щитовидной железы и ДНК-анализ на синдром ломкой Х-хромосомы. Анализ гена FMR1 методом блот-гибридизации по Саузерну соответствовал синдрому ломкой Х-хромосомы. – Также рекомендуем “Недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД): причины, диагностика, лечение” Оглавление темы “Генетические болезни”:
|
Источник
Синдром Мартина-Белл – это наследственная болезнь, которая характеризуется стойким интеллектуальным снижением, расстройствами аутистического спектра и специфическими фенотипическими особенностями. Ключевой симптом – недостаточность познавательных функций. Отмечается гиперактивность, дефицит коммуникативных способностей, замкнутость. Лицо удлиненное, ушные раковины большие, лоб выступающий, кончик носа загнутый. Диагностика основывается на клинико-анамнестических данных и результатах биогенетического анализа. Лечение симптоматическое, включает использование медикаментов и психолого-педагогическую коррекцию.
Общие сведения
Синдром Мартина-Белл получил свое название по фамилиям исследователей, впервые описавших патологию. В 1943 году физиологи из Великобритании Д. Мартин и Д. Белл изучали 11 случаев олигофрении у мужчин из одной семьи, в которой женщины имели нормальное интеллектуальное развитие. Генетическая основа заболевания была выявлена в 1969 году американским генетиком Г. Лабсом. Синонимичное название – синдром ломкой X-хромосомы. Распространенность среди мальчиков составляет 1:4 000, среди девочек – 1:6 000. Согласно данным зарубежных врачей-генетиков, частота синдрома Мартина-Белл у пациентов мужского пола с умственной отсталостью достигает 1,9-5,9%. Отечественные исследования указывают на более высокие значения, в соответствии с ними этот синдром имеют 8-10% больных олигофренией.
Синдром Мартина-Белл
Причины
Синдром Мартина-Белл является результатом дефекта гена FMR1, расположенного в X-хромосоме. Наследование происходит по доминантному сцепленному с полом типу с неполной пенетрантностью. У мужчин присутствует одна X-хромосома, поэтому мутантный аллель всегда провоцирует болезнь. У женщин есть две половые хромосомы типа X: одна активная, другая – резервная, инактивированная. Таким образом, при наличии мутации в одном из двух генов FMR1 заболевание проявляется или нет в зависимости от активности измененной хромосомы. Мужчины с ломкой хромосомой X не могут передать ее сыновьям, но передают всем дочерям, которые либо болеют, либо остаются здоровыми носителями мутации. Женщины с дефектной хромосомой передают ее детям обоих полов с вероятностью 50%. Наследование синдрома учащается от поколения к поколению, этот феномен называется парадоксом Шермана.
Патогенез
При секвенировании FMR1-гена было выявлено, что основой симптоматики и цитогенетически определяемой ломкости хромосомы X является многократное увеличение количества единичных тринуклеотидов ЦГГ. Это приводит к подавлению транскрипции и последующему недостаточному производству белка FMR1, ответственного за развитие центральной нервной системы, а именно – за формирование аксонов и синапсов, появление и усложнение нейронных связей, успешность процессов обучения и запоминания.
Участок хромосом, подверженный структурным изменениям при наследственном синдроме Мартина-Белл, может находиться в четырех состояниях, характеризующихся различным удлинением повторяющихся последовательностей тринуклеотидов. При отсутствии болезни и носительства определяется нормальное количество повторов – от 6 до 39. В промежуточном состоянии диагностируется 40-60 повторов, в состоянии премутации – 55-200. В обоих случаях заболевание отсутствует. Поскольку экспансия тринуклеотидов возможна лишь в период гаметогенеза, премутация способна превратиться в полную мутацию. Это происходит при передаче измененного материнского гена, аллель «утяжеляется» во время овогенеза. При полной мутации выявляется больше 200 повторов ЦГГ, чаще всего – от 230 до 4 000.
Симптомы
Дети рождаются с увеличенной массой тела, в среднем – 3,5-4 кг. Первыми обращают на себя внимание фенотипические особенности младенцев. Характерен макроорхизм – увеличение яичек без эндокринного заболевания. Окружность головы больше нормы или соответствует ее верхним границам. Лоб высокий и широкий, лицо вытянутое с уплощенной средней частью. Нос имеет слегка клювовидный загиб, ушные раковины крупные, располагаются низко. Суставы отличаются хорошей подвижностью, кости кистей и стоп широкие. Кожа зачастую гиперэластичная, волосы и радужные оболочки глаз светлого оттенка. Фенотипические признаки могут быть выражены по-разному, от одного-двух едва определяемых до полного комплекса.
Ключевое клиническое проявление заболевания – умственная отсталость. Стойкое интеллектуальное снижение проявляется слабым развитием сложных форм мышления и памяти. Пациентам недоступно понимание абстрактно-логических высказываний и явлений, использование категорий, установление аналогий. Сравнение, анализ и обобщение могут осуществляться на простом уровне, например, в конкретных бытовых ситуациях. Словарный запас обеднен. У многих мальчиков IQ равен 40-50 баллам, реже достигает 70-79. Относительно сохранна номинативная речь и зрительное восприятие. У девочек когнитивное снижение менее выраженное, соответствует легкой степени олигофрении или пограничному уровню интеллектуального развития.
Другой типичный симптом заболевания – своеобразие речи. Она ускоренная, сбивчивая, изобилует повторами, эхолалиями и персеверациями. Аутистические расстройства представлены трудностями коммуникации и поведенческими нарушениями. Дети часто проявляют агрессивность и замкнутость при попытке установления контакта. В тяжелых случаях развивается мутизм – полное отсутствие речи как средства общения. В поведении преобладает двигательная расторможенность, гиперактивность, стереотипии, самопровреждения. Пациенты избегают смотреть в глаза, не допускают прикосновений, но по сравнению с больными аутизмом интерес к общению присутствует. Стереотипные движения включают хлопки руками, прыжки, вращения вокруг своей оси, встряхивания руками, бег по кругу, гримасничанье и однообразное хныканье. Имеются трудности планирования и контроля поведения, переключения внимания и пространственной координации.
Неврологические симптомы неспецифичны. Определяется легкое снижение мышечного тонуса, двигательная дискоординация. Недостаточное развитие мелкой моторики затрудняет освоение письма, некоторых игровых и бытовых навыков (сборки конструктора, рисования, шитья и др.). У части больных имеются глазодвигательные нарушения, усиление сухожильных рефлексов, экстрапирамидные паракинезы, например, зажмуривание глаз, нахмуривание бровей, гримасничанье. При тяжелых формах синдрома возникают эпилептические припадки. У 25% пациенток с премутационным состоянием развивается первичная недостаточность яичников.
Диагностика
При выраженных фенотипических изменениях заболевание может быть обнаружено с первых месяцев жизни ребенка – неонатологи и врачи-педиатры обращают внимание на увеличенные размеры яичек и характерные особенности лица. В иных случаях подозрение на умственную отсталость возникает в возрасте от полугода до 2-3 лет. В этот период прослеживается отставание умственного развития, поведенческие и речевые нарушения. Дифференциальная диагностика нацелена на исключение РАС, в частности раннего детского аутизма, а также умственной отсталости другого происхождения (не связанной с ломкостью хромосомы Х). Обследование проводится психиатрами, неврологами и врачами-генетиками, включает:
- Клинический опрос, осмотр. В беседе с ребенком на первый план выходит снижение интеллекта, гиперактивность и расторможенность поведения, нарушение коммуникативных навыков. Уровень психического развития не соответствует возрасту, методики исследования интеллекта выявляют олигофрению (IQ – 40-79 баллов). Внешне наблюдаются характерные фенотипические признаки, при неврологическом осмотре выявляется мышечный гипотонус, усиленные сухожильные рефлексы, паракинезы.
- Генеалогический анализ. В отличие от других форм олигофрении при синдроме Мартина-Белл прослеживается наследственная передача болезни. Как правило, у пациента имеются родственники с данным заболеванием, чаще – мужчины (дед, дядя, брат). Иногда признаки легкого интеллектуального снижения обнаруживаются у матери, но диагноз у нее часто не установлен (не подтвержден).
- Генетическое исследование. В лабораторных условиях исследуется строение ДНК: определяется количество ЦГГ-повторов и статус метилирования. Применяется ПЦР и цитогенетический метод. Диагноз подтверждается, если количество триплетных повторов составляет более 200. При результате 60-199 возможны легкие фенотипические проявления болезни, риск развития патологии в следующем поколении (если показатель диагностирован у женщины).
Лечение синдрома Мартина-Белл
Методы специфической терапии синдрома в настоящее время отсутствуют. Проводится симптоматическое медикаментозное лечение и психолого-педагогическая коррекция. Усилия врачей и специальных психологов направлены на минимизацию эмоционально-поведенческих отклонений, овладение навыками ходьбы, речи и общения, чтения и письма. Медикаментозная терапия включает прием психостимуляторов, антидепрессантов, ноотропов, противоэпилептических средств и гормональных препаратов (при первичной недостаточности яичников). Обучение пациентов проводится по специальным коррекционно-развивающим программам. Для улучшения социальных навыков используются методы когнитивно-поведенческой терапии, групповые тренинги.
Прогноз и профилактика
Синдром Мартина-Белла не имеет осложнений и не сокращает продолжительность жизни больных, поэтому при своевременной и адекватной медико-психолого-педагогической помощи прогноз достаточно благоприятный: пациенты осваивают навыки общения и самообслуживания, обучаются в специальных школах, иногда овладевают рабочими профессиями. Профилактика основана на медико-генетическом консультировании пар из групп риска и пренатальной диагностике синдрома. Эти меры необходимы женщинам с синдромом преждевременного истощения яичников, семьям, в которых диагностированы премутационные состояния FMR1 или выявлены случаи интеллектуальной недостаточности у мальчиков и мужчин.
Источник
Здравствуйте. Сегодня я расскажу вам о синдроме ломкой Х-хромосомы и его влиянии на женскую репродуктивную функцию и здоровье потомства, о связи генов и бесплодия, о методах диагностики при раннем истощении резерва яичников. Всеми этими проблемами мы занимаемся в Центре иммунологии и репродукции.
Синдром ломкой X-хромосомы – наследственное заболевание, при котором нарушена работа гена FMR1. Суть генетического нарушения в увеличении количества повторов сочетания из трех «букв» генетического кода CGG. У здоровых людей таких повторов в X-хромосоме не более 50–60. При синдроме ломкой X-хромосомы – более 200.
Состояние, когда повторов от 60 до 200, называется премутацией. У ее носителя практически нет симптомов, но повышен риск возникновения полноценной мутации у потомства. Другие названия патологии – синдром фрагильной хромосомы X и синдром Мартина-Белл.
Мутация в гене FMR1 – одна из самых распространенных вместе с синдромом Дауна причин наследственного интеллектуального нарушения. Но этот генетический дефект привлекает и пристальное внимание врачей-репродуктологов, потому что он приводит к преждевременному истощению овариального резерва и может передаваться ребенку.
Распространенность синдрома ломкой X-хромосомы встречается у одного из 4000 мужчин и одной из 8000 женщин. Такое различие связано с тем, что у женщин две X-хромосомы. Если в одной возникает дефект, вторая может его компенсировать. У мужчин только одна X-хромосома. Поэтому, если им достается мутация FMR1, она проявляется в полную силу.
Премутация встречается очень часто: у каждой из 250 женщин в одной из X-хромосом имеется более 50 повторов CGG.
Почему возникают симптомы?
При экстремальном увеличении количества копий последовательности CGG происходит метилирование промотора – участка ДНК, который активирует экспрессию т.е.преобразование генетического кода в структуру белка гена FMR1. В итоге ген не работает. В организме он отвечает за формирование связей в нервной системе и некоторые другие важные процессы. В итоге возникают нарушения, которые и проявляются характерными симптомами.
Симптомы синдрома Мартина-Белл
Несмотря на то, что премутация у женщин зачастую не проявляется какими-либо симптомами, она нарушает репродуктивную функцию и может привести к проблемам со здоровьем у потомства.
- Во- первых, первичная недостаточность яичников.
У женщин с дефектным геном FMR1 рано происходит истощение овариального резерва, и менопауза наступает до 40 лет. Поэтому при преждевременной менопаузе врач может порекомендовать пройти генетический анализ. По статистике, в 5% случаев раннее истощение овариального резерва становится следствием синдрома ломкой X-хромосомы.
Недостаточность яичников возникает примерно у 25% носительниц премутации.
- Во-вторых, передача дефектного гена потомству.
Если у женщины премутация, ее детям может достаться полноценная мутация, когда число повторов CGG увеличено более 200. При этом у девочки симптомы возникнут с вероятностью 30–50%, а у мальчика почти гарантированно. Мужчина со 100% вероятностью передаст ломкую X-хромосому всем дочерям, но ни одному из сыновей , потому что дочь в любом случае получит одну X-хромосому от отца, а сын – всего одну только от матери.
- Существуют и другие симптомы. В первую очередь синдром ломкой X-хромосомы грозит потомству нарушением интеллекта.
Развивается умственная отсталость легкой или средней степени тяжести. У некоторых детей возникают симптомы аутизма: они много раз повторяют одни и те же слова, фразы, действия, не входят в зрительный контакт во время общения, избегают социума.
- Синдром фрагильной хромосомы X может привести к тремору/атаксии, ассоциированному с ломкой X-хромосомой .
Чаще всего патология поражает мужчин и встречается примерно у трети носителей премутации. Симптомы этого состояния: тремор , мозжечковая атаксия, то есть нарушение чувства равновесия, паркинсонизм, деменция .
Обычно первые признаки появляются после 50 лет, до этого возраста человек чувствует себя абсолютно здоровым.
- Другие возможные проявления синдрома Мартина-Белл.
Характерные черты лица: выступающий лоб и подбородок, большие уши. Высокое сводчатое нёбо. Чрезмерная подвижность суставов. Пролапс митрального клапана и другие проблемы с сердцем.
Сразу после рождения установить диагноз невозможно. Симптомы ломкой X-хромосомы могут появиться только после того, как ребенку исполнится год.
- Диагностика синдрома ломкой Х-хромосомы
Раньше это состояние выявляли с помощью цитогенетических исследований. У человека получали образец клеток, вводили в них фолиевую кислоту, и после этого становилось видно, что в X-хромосоме есть как бы разрыв. Один участок «отшнуровывается». На самом деле хромосома цела, просто такой эффект создается из-за мутации. В настоящее время от цитогенетического анализа отказались, так как он недостаточно точен.
Кстати, раньше синдром Мартина-Белл считался хромосомным заболеванием, как и синдром Дауна. Эта группа патологий связана с нарушением структуры и количества хромосом. В настоящее время известно, что это генная болезнь, то есть нарушение происходит на уровне одного определенного гена.
Современный метод диагностики ломкой хромосомы X – полимеразная цепная реакция , когда с помощью фермента получают много копий ДНК, и конечные продукты выявляют методом капиллярного электрофореза. Это позволяет точно определить мутантный ген и его размер до 200 повторов CGG.
Кому показан анализ на ломкую х-хромосому?
Женщине стоит пройти этот анализ в следующих случаях:
- При ранней до 40 лет менопаузе.
- При нарушении репродуктивной функции, в сочетании с повышенным уровнем фолликулостимулирующего гормона ,пониженном антимюллеровом гормоне , урежении ,то есть более 35 дней в цикле и укорочении – менее 3 дней менструации.
- Если у родственников диагностирован синдром ломкой X-хромосомы.
Во многих странах сейчас исследование на мутацию гена FMR1 у плода включено в обязательную программу скрининга во время беременности. Нарушение намного проще выявить у будущей мамы, чем у ребенка, особенно если у женщины имеется премутация, а ребенку досталась полноценная мутация.
ПЦР хуже выявляет дефекты в гене FMR1, если число копий CGG более 200, можно получить ложноотрицательный результат.
Что делать, если анализ обнаружил это нарушение?
Положительный результат анализа на ломкую Х-хромосому
Если у будущей мамы еще до беременности диагностирована премутация или мутация, это дает шанс не допустить передачи заболевания потомству. В ходе ЭКО врачи могут отобрать эмбрионы с нормальной X-хромосомой.
Если из-за синдрома ломкой X-хромосомы у женщины происходит преждевременное истощение овариального резерва, также может помочь ЭКО. Это состояние обязательно учитывается в ходе процедуры, потому что такие женщины хуже реагируют на гормональную стимуляцию яичников.
Такой анализ можно сделать в Лаборатории ЦИР. Мы проводим все доступные лабораторные исследования, которые помогают разобраться в нарушении репродуктивной функции, оценить риски для потомства, вероятность развития тех или иных осложнений во время беременности.
Если у Вас есть вопросы по теме видео, пишите их в комментариях или приходите на консультацию. Часто доступна онлайн-поддержка, о которой Вы можете узнать по ссылке на нашем сайте.
Источник

