Синдром марфана и умственная отсталость
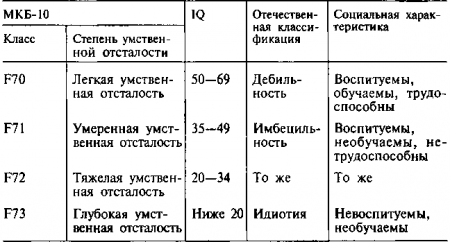
Дифференцированные формы олигофрении
Хромосомные аберрации
Хромосомные аберрации являются одной из частых причин олигофрений, они составляют 10—12 % всех генетически обусловленных задержек психического развития. При этом дефекты наиболее крупных хромосом (с 1-й по 12-ю пары) обусловливают нежизнеспособность эмбриона и выкидыш. Трисомии 13-й — 18-й пар хромосом обычно приводят к смерти ребенка на первом году жизни. Другие известные дефекты хромосом — это делеция короткого плеча хромосомы 5-й пары (синдром «кошачьего крика») и делеция длинного плеча хромосомы 18-й пары (синдром Лежена). Эти синдромы проявляются грубым недоразвитием интеллекта (идиотией или тяжелой имбецильностью). У взрослых наиболее часто встречаются трисомия 21-й хромосомы (болезнь Дауна) и дефекты половых хромосом.
Болезнь Дауна является самым частым из хромосомных дефектов. Вероятность рождения больного ребенка составляет 1 случай на 700 новорожденных. Чаще всего данный дефект обусловлен нерасхождением хромосом при образовании яйцеклетки. В этом случае заболевание не связано с патологической наследственностью, зато его вероятность существенно повышается с увеличением возраста матери при рождении ребенка (у матерей 40 лет вероятность в 14 раз больше, чем у 30-летних). Изредка встречаются случаи заболевания, связанные с дислокацией участка 21-й хромосомы на нормальную хромосому. В этом случае можно говорить о скрытом носительстве заболевания у родителей. Возраст матери существенной роли не играет. Возможны случаи семейного наследования. Еще реже встречается мозаицизм, обусловленный нарушением расхождения хромосом на ранних этапах деления зиготы. Выраженность интеллектуального дефекта в этом случае, как правило, существенно меньше.
Типичные внешние признаки болезни Дауна — небольшой рост, короткие конечности при относительно длинном туловище, широкое круглое лицо, косой разрез глаз с характерной монголоидной складкой во внутреннем углу глаза (эпикант), деформированные маленькие уши, депигментация радужных оболочек глаз, утолщенный, складчатый, не помещающийся во рту язык, недоразвитые половые органы, общая гипотония мышц и разболтанность суставов. Характерное строение имеет кисть ребенка: пухлая, с укороченными пальцами, искривленным мизинцем и единой поперечной («обезьяньей») складкой. Наблюдаются снижение защитных сил организма, распространенный кариес, высокая подверженность инфекциям, пониженная жизнеспособность (часто смерть до достижения полового созревания). Интеллектуальный дефект в большинстве случаев достаточно тяжелый: в 75 % случаев — имбецильность, в 20 % — идиотия, в 5 % — дебильность. Такие дети довольно возбудимы, капризны, речь развита слабо, однако иногда у них можно наблюдать достаточно яркие эмоции. Нередко они привязаны к родителям, стараются им подражать. Характерна ранняя инволюция больных (до 40 лет). В большинстве случаев это сопровождается нарастанием интеллектуальной беспомощности, в мозге отмечаются изменения, характерные для болезни Альцгеймера.
Нарушения в распределении половых хромосом приводят обычно к менее грубому интеллектуальному дефекту, чем при болезни Дауна. Трисомия по Х-хромосоме (синдром «трипло-Х», генотип XXX) и отсутствие одной Х-хромосомы (синдром Шерешевского—Тернера, генотип ХО) фенотипически проявляются женским полом. И в том и в другом случае отмечаются заметные признаки нарушения полового развития (чаще при синдроме Шерешевского—Тернера). Интеллектуальный дефект негрубый (дебильность) и наблюдается не у всех пациентов. Фенотипически синдром Шерешевского—Тернера характеризуется низким ростом, короткой шеей с низкой границей роста волос, наличием крыловидной складки шеи, идущей от сосцевидного отростка височной кости к лопатке, недоразвитием вторичных половых признаков и первичной аменореей. Эти пациенты довольно добродушны, трудолюбивы, послушны. При трисомии по Х-хромосоме снижение интеллекта отмечается в 75 % случаев, однако оно негрубое, поведение характеризуется психопатизацией. Нередко отмечаются психозы, напоминающие шизофрению.
Генотипы XXY и XYY наблюдаются у мужчин. Синдром Кпайнфелтера выражается присутствием лишней Х-хромосомы при наличии Y-хромосом (встречаются варианты XXY, XXXY, XXYY). Пациенты с такой патологией характеризуются инфантилизмом, гипогонадизмом, евнухоидным телосложением, гинекомастией, бесплодием. Интеллектуальный дефект наблюдается часто, но не всегда. Характерны мягкость, ранимость, психический инфантилизм, иногда стеснительность и переживания по поводу своего дефекта. Наличие лишней Y-хромосомы (синдром XYY) обычно не проявляется грубыми соматическими расстройствами. У таких мужчин не нарушена половая функция, они могут иметь нормальных детей без генетических дефектов. Хотя психическое недоразвитие отмечается у 80 % пациентов, оно обычно бывает негрубым (легкая дебильность). Таких мальчиков с детства отличают высокий рост, эмоциональная неустойчивость, высокая частота взрывных реакций, склонность к правонарушениям.
Наследственные формы олигофрении
Наследуемые генные дефекты обычно проявляются недостаточностью того или иного фермента. Обычно в утробе матери данный дефект компенсируется за счет организма матери, поэтому в большинстве случаев при рождении не отмечается заметного отличия от нормы. Однако при длительно существующей ферментной недостаточности энзимопатия может приводить к довольно тяжелой олигофрении.
| Название синдрома | Тип наследования | Степень умственной отсталости | Типичные симптомы |
| Фенилкетонурия | АР | Идиотия—имбецильность | Депигментация, вялость, рвота, кожные высыпания, пот с неприятным запахом |
| Гаргоилизм | АР, X | Идиотия | Дефекты соединительной ткани, пороки костей, суставов, помутнение роговицы, снижение слуха |
| Синдром Марфана | АД | Дебильность | Высокий рост, астеническое телосложение, длинные конечности с утолщенными суставами, эктопия хрусталика |
| Гомоцистинурия | АР | Дебильность | Внешний вид больных сходен с таковым при синдроме Марфана. Часто наблюдаются пороки сердца, спастические параличи, тромбозы вен и артерий |
| Галактоземия | АР | Имбецильность — идиотия | Гепатомегалия, катаракта, нарушение функции яичников |
| Синдром Лоуренса-Муна—Барде— Билля | АР | Дебильность — идиотия | Пигментная ретинопатия, ожирение по адипозогенитальному типу, гипогенитализм, эпикант, полидактилия и синдактилия, эпилептические припадки |
| Прогерия | АР | Дебильность — идиотия | Преждевременное старение, раннее выпадение волос, бровей, катаракта, атеросклероз и коронарная недостаточность |
| Синдром Крузона (черепно-лицевой дизостоз) | АД, АР | Дебильность — идиотия | Краниосиностоз, экзофтальм, расходящееся косоглазие, гипоплазия верхней челюсти, повышение внутричерепного давления, эпилептические припадки |
| Синдром Апера (акроцефалосиндактилия) | АД | Дебильность — идиотия | Башенный череп с нависающим лбом, экзофтальм, синдактилия, часто с вовлечением костных структур |
| Синдром Маринеску—Шегрена | АР | Имбецильность — идиотия | Мозжечковая атаксия, двусторонняя катаракта |
| Истинная (наследственная) микроцефалия | АР, АД, X | Идиотия — имбецильность | Малые размеры мозговой части черепа при нормальном телосложении и обычном росте |
| Синдром Рада | АР | Дебильность — идиотия | Ихтиоз, шелушение волосистой части головы и кистей, эпилептические припадки |
Примечание. Типы наследования: АД — аутосомно-доминантный, АР — аутосомно-рецессивный, X — сцепленный с полом.
Энзимопатии составляют от 5 до 10 % всех случаев тяжелой умственной отсталости. В большинстве случаев данные заболевания обусловлены рецессивным геном (табл. 23.2). Проявления олигофрений, вызванных рецессивным геном, часто более тяжелые, чем передающихся по доминантному типу, поскольку доминантный ген чаще встречается в гетерозиготном состоянии и имеющийся здоровый ген может частично компенсировать дефект.
Фенилкетонурия была описана А. Феллингом в 1934 г. Она наблюдается в 1 случае на 10 000 новорожденных, с одинаковой частотой у мальчиков и девочек. Поскольку болезнь передается по аутосомно-рецессивному типу, оба родителя ребенка являются здоровыми носителями и вероятность рождения второго ребенка с той же патологией составляет 25 %. Распространенность здоровых носителей данного гена в популяции составляет 1:50. Проявления заболевания обусловлены отсутствием фермента фенилаланингидроксилазы. Это вызывает нарушения превращения фенилаланина в тирозин, который в свою очередь является важнейшим предшественником нейромедиаторов (норадреналина, дофамина), гормонов (адреналина, тироксина) и меланина. Хотя при рождении дети ничем не отличаются от здоровых, однако уже в первые месяцы отмечаются нарастание вялости, заторможенности, слабая реакция на окружающее, замедление психического развития. Недостаток меланина проявляется светлыми волосами и голубым цветом глаз. Довольно часто отмечается рвота; особенно плохо дети переносят введение прикорма. Часто отмечаются кожные высыпания, потливость со специфическим неприятным запахом пота. При отсутствии диетического лечения, начатого на первом году жизни (лучше не позже 2—3 мес), развивается тяжелая олигофрения (в 65 % случаев идиотия). Для своевременной диагностики двукратно исследуют мочу ребенка в возрасте до 2—3 мес. Применяются реакции с полуторахлористым железом (проба Феллинга), с динитрофенилгидразином и микробиологический тест Гатри. Однако эти тесты неспецифичны, поэтому окончательная диагностика основана на определении содержания фенилаланина в сыворотке крови. Единственным методом лечения является строгая диета с ограничением белков и растительного и животного происхождения (мяса, яиц, мучных изделий, рыбы, сыра, бобовых). Недостаток незаменимых аминокислот компенсируется специально приготовленными смесями. Из продуктов допустимо употребление блюд из овощей, фруктов, сахара, меда, картофельного крахмала, жиров.
Гаргоилизм — это группа синдромов, проявляющихся накоплением в организме кислых мукополисахаридов. Эти вещества имеют важное значение для развития соединительной ткани, поэтому наблюдаются множественные дефекты различных костей, суставов, позвоночника, черепа, пороки сердца, грыжи, изменения в органах зрения. Находят также изменения мозга, гидроцефалию, утолщение твердой мозговой оболочки. Заболевание обусловлено рецессивным геном, в части случаев наблюдается сцепленное с полом наследование (соотношение мальчиков и девочек составляет 2:1). Признаки заболевания проявляются в первые месяцы жизни и быстро нарастают, в типичных случаях достигая степени идиотии. Ранняя диагностика возможна путем исследования мочи на кислые мукопо-лисахариды (реакции Барри и Дорфмана). Специфической терапии не найдено. Применяют АКТГ и гормоны щитовидной железы. Некоторый эффект может быть достигнут при применении высоких доз витамина А и рентгеновском облучении гипофиза.
Другие заболевания, передающиеся по аутосомно-рецессивному типу, — гомоцистинурия, лейциноз (болезнь кленового сиропа, синдром Менкеса), галактоземия, фруктозурия и сукрозурия. Гомоцистинурия (нарушение метаболизма метионина) проявляется негрубым интеллектуальным дефектом и значительными изменениями в опорно-двигательном аппарате, в строении глаз. Нередко отмечаются спастические параличи и тромбозы. Нарушения в усвоении углеводов (галактозы, фруктозы и сукрозы) проявляются поносами, гипотрофией, задержкой психического развития и могут служить причиной смерти в детском возрасте. Лейциноз (болезнь кленового сиропа) — злокачественно протекающее заболевание, приводящее к смерти на 1—2-м году жизни, обусловленное нарушением обмена сразу 3 аминокислот (лейцина, изолейцина и валина).
Синдром Марфана (арахнодактилия) передается по аутосомно-доминантному типу и часто наблюдается у нескольких членов одной семьи. Интеллектуальный дефект обычно негрубый, иногда отсутствует. У пациентов отмечаются высокий рост, тонкие длинные руки и пальцы с утолщенными суставами, астеническое телосложение. В психическом отношении характерны замедленность движений, тугоподвижность психических процессов, отсутствие инициативы. Отмечается плохая устойчивость к инфекциям, что иногда служит причиной ранней смерти.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Страницы: 1 2 3 4
Источник
Введение.
До сих пор синдром Марфана воспринимается большинством специалистов как редкое состояние и ассоциируется с арахнодактилией, подвывихом хрусталика и аневризмой аорты. Однако синдром (болезнь) Марфана встречается в популяции с частотой 1:10000 — 1:20000. Синдром обусловлен изменением гена на 15 хромосоме (15q15-21), ответственного за синтез фибриллина, важнейшей составной части микрофибрилл эластических волокон. В одном гене описано уже более 500 мутаций, что делает понятным вариабельность симптомов [1]. Тип передачи а/д, риск рождения больного ребёнка возрастает у пожилого отца, возраст матери значения не имеет. Семейные случаи составляют до 75% всех наблюдений, в 25% можно говорить о новой мутации. Наиболее тяжёлые формы наблюдаются у детей, рождённых от двух родителей-марфанов (гомозиготность). Пенетрантность гена высока, внутрисемейная вариабельность признаков широка: от неонатальных тяжёлых форм до едва диагностируемых аномалий. Возможен синдром Марфана (СМ) без астенического сложения (маскулинный тип взрослых), который встречается значительно чаще и оставляет много случаев не диагностированными (рис. 1).
Рис. 1. Внешний вид девочки-подростка с маскулинным типом синдрома Марфана. Длина нижнего сегмента тела (100 см) больше, чем половина роста (рост — 185 см). Ягодицы уплощены, что является признаком неразвитости мышц.
Есть и другие патофизиологические механизмы:
1. Низкий порог протеолиза фибриллина, нарушение гомеостаза эластических волокон.
2. Сниженная репаративная способность ДНК [2].
3. Выраженная дисрегуляция активации и сигнализации трансформирующего фактора роста β (ТФР-β), приводящая к апоптозу. Выявлена мутация гена рецептора типа II, трансформирующего фактора роста β, обуславливающая указанную дисрегуляцию. Идентификация нарушения гена рецептора ТФР-β с локусом 3р24.2-р25 послужила основанием для выделения СМ типа II в отличие от СМ типа I, обусловленного мутацией гена фибриллина. Заключение о нарушении сигнализации ТФР-β радикально изменило представления о патогенезе СМ.
4. Мутации в рецепторах типов I и II трансформирующего фактора роста β оказались причиной Лоейес-Дитц синдрома аневризмы аорты и врождённых аномалий (Online Mendelian Inheritance in Man [OMIM] 609192).
В итоге, нарушения рецепторов типов I и II трансформирующего фактора роста β привели к выделению новой группы синдромов Марфана внутри более общего состояния генерализованной дисплазии соединительной ткани. Эта недавно выделенная группа синдромов получила название ТФР-β сигналопатии [3].
Однако сложность идентификации различных вариантов СМ, особенно в практической работе, однотипность терапии на современном этапе приводит к тому, что все они объединяются лечащим врачом в одно состояние. Поэтому наши заключения о различной пенетрантности генов, вариабельности признаков объясняются, видимо, тем, что, наряду с множественностью мутаций в одном гене, мы в действительности сталкиваемся с мутациями в разных генах или, ещё сложнее, с сочетанными мутациями в генах фибриллина и рецепторов ТФР-β.
Клиническая картина.
Диагностические признаки СМ, определяющие клиническую картину, следующие [4, 5]:
1. Общая характеристика.
А. Лицо треугольной формы с маленьким подбородком, переносица высокая (птичье лицо), глаза посажены близко друг к другу, глубоко, выражение грустное. Пациент напоминает картины Эль-Греко. Уши большие, оттопыренные, мочки свободные (уши Будды). (Рис. 2)
Рис. 2. Характерный вид лица ребёнка с синдромом Марфана («птичье лицо»). Глаза посажены близко, подбородок острый, уши большие (уши Будды).
Б. Нёбо высокое (готическое). Неправильный рост зубов, мальоклюзия, прогнатия. Голос высокий.
В. Долихостеномелия* (длинные тонкие конечности) — у 80% обследованных, астеничность сложения. Большой палец укладывается поперёк ладони и выступает за её ульнарный край (признак Штейнберга). Мизинцем и большим пальцем пациент свободно охватывает своё запястье (признак Мардоха). (Рис. 3).
Рис. 3. Тест запястья.
Нижний сегмент тела больше верхнего, размах рук превышает рост.
Г. Рост высокий, т.е. превышает средний рост здоровых родственников 1-ой степени родства (не ориентироваться на популяцию!).
Д. «Куриная грудь»* или «грудь сапожника»*, часто асимметрично.
Е. Плоская спина, кифосколиоз* (45%).
Ж. Гиперподвижность суставов (60%).
З. Гипотрофия мышц.
И. Грыжи, часто рецидивирующие.
К. Бархатистая мягкая кожа со скудной подкожной жировой клетчаткой, стрии растяжения (20%).
Л. Кисты верхушек лёгких, рецидивирующий пневмоторакс (1-5%).
М. Эктазии твёрдой мозговой оболочки в люмбосакральном отделе, артериовенозные аневризмы в головном и спинном мозге. Раширение Cysterna magna.
Н. Protrusio acetabuli.
2. Изменения глаз.
А. Вывих/подвывих хрусталиков*, чаще двухсторонний по направлению вверх и кнаружи, в 60% развивается в возрасте до 4 лет (Рис. 4). Для своевременной диагностики важно исследование с помощью щелевой лампы на фоне мидриаза. Клинический признак дислокации хрусталиков — дрожание внутреннего края радужки.
Рис. 4. Подвывих хрусталика со смещением его вверх.
Б. Миопия (у 55%), часто обусловленная шаровидным хрусталиком, мегалокорнеа, плоской роговицей.
В. Колобома радужки, глаукома, отслойка сетчатки.
Г. Узкие зрачки (недоразвитие М. dilatator pupillae), Arcus senilis.
3. Сердечно-сосудистые изменения (99%).
А. Прогрессирующее расширение аорты* и/или синуса Вальсальвы*.
Б. Расслаивающая аневризма аорты и/или её разрыв.
В. Недостаточность аортальных клапанов.
Г. Пролапс митрального клапана (95%), его недостаточность, миксоматозная дегенерация створок, Обызвествление митрального кольца.
Д. Нарушения ритма сердца.
4. Семейный анамнез*. Частота встречи у родственников 1-ой степени родства — 75%, спорадические случаи — 25%.
Диагноз СМ основывается на клинической картине. Необходимо наличие минимум 2 основных признаков, отмеченных звёздочкой, (хотя бы по одному из любых четырёх вышеперечисленных групп) и несколько дополнительных.
Клиническая картина СМ не остаётся стабильной на протяжении жизни. Она подвержена динамике, определяемой как генетическими особенностями, так и внешними условиями (физическая нагрузка, профилактические и лечебные мероприятия). Динамичность клинической картины внутренняя и неоднородность самого синдром Марфана привели к дискуссии о целесообразности введения термина болезнь Марфана.
Самый неблагоприятный вариант СМ — неонатальный синдром. Он характеризуется проявлением «классического» СМ (неревматическая недостаточность клапанов, расширение аорты, эктопия хрусталика, нарушения скелета) уже при рождении. Одновременно отмечается т.н. cutis laxa, контактуры, «мятые уши», гипоплазия скелетных мышц, аномалии глаз, эмфизема лёгких и миокардиальная недостаточность. Такие пациенты умирают рано. Синдром Марфана, манифестирующий уже у новорождённых, обусловлен мутацией в гене фибриллина (FBN1 ген). Изменённым оказывается экзон 23-32 домена фактора, подобного эпидермальному фактору роста
Дифференциальная диагностика.
Наиболее важным для ДД является исключение гомоцистинурии, поскольку имеется возможность её частичной терапевтической коррекции. Тип поражения опорно-двигательного аппарата, дислокация хрусталика сближают оба заболевания, однако для гомоцистинурии характерен а/р тип наследования, подвывих хрусталика чаще происходит не вверх, как при СМ, а вниз. В 30% случаев снижен интеллект, тромбозы и тромбэмболии, остеопороз с переломами костей. В моче обнаруживается большое количество гомоцистина. Различают пиридоксин-чувствительную и пиридоксин-резистентную формы. Ограничение метионина и назначение витамина В6 при пиридоксин-зависимой форме нормализуют уровень серосодержащих аминокислот.
Синдром Элерса-Данлоса (СЭД) имеет много общего с СМ [6]. Одним из кардинальных признаков СЭД является гиперэластичность кожи. Она бархатистая, нежная, мягкая, с поверхностно расположенными сосудами, тёплая, очень легко вытягивается и сразу возвращается в прежнее положение. Отмечается гипермобильность суставов вплоть до симптома «телескопа», геморрагический синдром и повышенная ранимость кожи. Иногда образуются характерные рубцы типа «папиросной бумаги». Различают 11 типов СЭД в зависимости от клинической картины и типа наследования. По нашим данным у больных с СЭД реже, чем при синдроме Марфана встречается аневризма аорты. Общим для синдромов Стиклера и Марфана являются долихоморфное телосложение, гипопластическая мускулатура, поражение глаз (см. Табл. 1), доминантный тип наследования. Но в отличие от СМ суставы при синдроме Стиклера увеличены в объёме, иногда болезненны при движениях, бывает покраснение кожи и местное повышение температуры над ними. Рентгенологически отмечается нарушение структуры диафизов и эпифизов, а при СМ — остеопороз и истончение кортикального слоя. Очень характерны для синдрома Стиклера миопия высокой степени, глаукома. Лицо таких больных существенно отличается от лица больных с синдромом Марфана: оно уплощённое, возможна аномалада Робина, в ряде случаев — глухота и «волчья пасть». Много общего с синдромом Марфана имеет врождённая доброкачественная контрактурная арахнодактилия (синдром Билса), для которой характерны доминантный тип наследования, арахнодактилия, проксимальные и дистальные контрактуры (отличительный признак от СМ), генерализованная остеопатия и «мятые уши». Кардиоваскулярные нарушения подобны таковым при синдроме Марфана, однако встречаются реже, могут быть разнообразные поражения глаз.
«Марфаноидный» вид свойственнен больным с синдромом Клейнфельтера, однако последний отличают гинекомастия, гипогонадизм, азоо- и олигоспермия, повышенная экскреция гонадотропных гормонов, снижение выделения андрогенов и задержка созревания костей. Основной признак — трисомия или даже полисомия половых хромосом. Ещё раз подчёркиваем, что кариологические исследования нужны не для диагностики СМ, а для исключения фенокопий. Близок с синдрому Клейнфельтера синдром евнухоидизма (гипогонадизм), сочетающий «марфаноидное» телосложение и недоразвитие вторичных половых признаков. У женщин отмечается аменорея. При гипергонадотропном гипогонадизме наблюдается снижение экскреции половых гормонов при нормальном или повышенном уровне гонадотропинов.
При гипогонадотропном гипогонадизме снижена экскреция гонадотропинов, андрогенов, эстрогенов.
Высокий рост, сочетающийся со снижением функции половых желёз, отмечается и при гигантизме, который может возникнуть при эозинофильной аденоме гипофиза или гиперпразии эозинофильных клеток, а также после травм и инфекций. Эозинофильная аденома гипофиза в детском возрасте ведёт к гигантизму, а в зрелом, в связи с закрытием зон роста, к диспропорциональному росту: акромегалии. Последнее сопровождается увеличением мягких частей тела (языка, внутренних органов), носа, ушей, кистей.
Диспропорциональный рост типичен для артериовенозных соустий, ангиодисплазий (синдром Клиппель-Треноне).
Следует отличать от СМ синдром Коудена, наследуемый по доминантному типу. Общим является тип телосложения, однако рост при этом синдроме никогда не достигает показателей, характерных для СМ. При синдроме Коудена имеются неопластические образования различной локализации: фиброаденоматоз молочных желёз, карциномы груди, кисты яичника, кишечные полипы, папилломы кожи, липомы, менингеомы, ангиоматоз. Характерных для синдрома Марфана поражений глаз и сердечно-сосудистой системы при синдроме Коудена не описано.
«Марфаноидный» вид описан и при синдроме множественной невоидной базально-клеточной карциномы, наследуемой а/д. Наблюдаются множественные пигментированные папулы на коже, опухоли центральной нервной системы, разнообразные поражения глаз, опухоли и кисты яичников, гипогонадизм, лейомиомы и т.д.
Аналогичное СМ поражение опорно-двигательного аппарата наблюдается при синдроме Сохара. Примерно к 10 годам развиваются тугоухость, близорукость со сферофакией, гипостенурия. Летальный исход связан с почечной недостаточностью.
Высокий рост, характерный для СМ, наблюдается также при синдроме Беквита-Видемана. Он ассоциируется с макроглоссией, пупочной грыжей, родимыми пятнами на лбу, верхнем веке, увеличением внутренних органов, умственной отсталостью, ускорением сроков костного созревания, нередко возникают опухоли различной локализации. Тип наследования не установлен. «Марфаноидный» вид и наличие сколиоза — общие проявления синдромов Тифри-Колера и Марфана. Наличие остеолиза и полой стопы отличают синдром Тифри-Колера от синдрома Марфана.
Синдром Маршалла-Смита (акселератные скелетные изменения) отличается кифосколиозом, аномальным лицом с выступающими глазами, расщелиной нёба, деформацией моляров и умственной отсталостью. Все описанные случаи спорадические.
Врачебная тактика.
С учётом полиморфизма клинической картины СМ и наиболее вероятных системных изменений при установлении диагноза необходимы консультации клинического генетика, кардиолога, офтальмолога, специалиста по сердечно-сосудистой хирургии, ортопеда, ортодонта и психолога. Дальнейшие консультации этих или иных специалистов строятся с учётом общей динамики синдрома.
Специальной диеты не требуется. Есть сообщения о необходимости употребления в пищу заливных блюд, назначения витамина Е, аскорбиновой кислоты, но ни одна из этих рекомендаций не проверена по принципам доказательной медицины.
Физическая активность регулируется только состоянием пациента и наличием отягчающих симптомов (регургитация через атриовентрикулярные отверстия, аневризма аорты, подвывих хрусталика, миопия высокой степени и т.д.). Противопоказаны соревновательные и контактные виды спорта как потенциально травматичные и, вследствие резких неконтролируемых нагрузок, чреватые травмами. Максимальную опасность таит изометрическая нагрузка, вызывающие существенный подъём артериального давления и создающая угрозу внезапной смерти. Необходимо избегать травм головы, как предрасполагающих к травматической дислокации хрусталика. С целью профилактики пневмоторакса нельзя использовать скоростные лифты, ныряние с дыхательными аппаратами, негерметичные самолёты.
Показаны физические нагрузки и спорт, не требующие резких и активных усилий (ходьба, рыбалка, спокойная езда на велосипеде). Исключать такую нагрузку нельзя. Адекватная физическая нагрузка является непременным условием сохранения физического и психологического комфорта.
Лекарственная коррекция. При стёртой форме СМ (без выраженных арахнодактилии, сердечно-сосудистых и офтальмологических изменений) медикаментозная терапия не показана. Так как таким пациентам свойственны эмоциональные и вегетативные нарушения [7], мы назначаем препараты магния, адаптогены (пустырник, пион, валериану), фенибут [8].
Медикаментозная терапия используется в основном как симптоматическое вмешательство или попытка предотвращения осложнений (расширения аорты, нарушения ритма сердца и т.д.). С осторожностью обсуждается возможность генной терапии [9].
Для индукции пубертата, закрытия зон роста, предупреждения сколиоза используются прогестерон и эстроген. Однако широкого распространения эта тактика не получила.
Антагонисты β-адренергических рецепторов являются препаратом первого ряда при лечении СМ. Они уменьшают вероятность расширения аорты, формирования аневризмы, её разрыва. Положительный эффект объясняется, видимо, не только снижением артериального давления и своеобразного щажения стенки аорты, но и способностью препаратов вмешиваться в обмен соединительной ткани и стабилизировать её [10]. Антагонисты кальция действуют аналогично. Оптимальный возраст для начала терапии не определён. Предлагают начать с детства, другие — при достижении диаметра аорты 95 перцентили или при быстром её расширении. Оптимальный срок начала терапии, видимо, при диаметре аорты не более 3 см. Если диаметр аорты достигает 6 см, вероятность её разрыва в ближайшие 3 месяца чрезвычайно высока. Основные препараты, используемые для лечения больных с СМ, представлены в табл. 2.
Все прочие вмешательства (коррекция миопии, плоскостопия, вероятных грыж, сколиоза, профилактики инфекционного эндокардита, тромбозов после замещения клапанов сердца, психологической помощи) проводится по стандартным схемам и показаниям.
Удаление хрусталика показано при его смещении в переднюю камеру, особенно если он касается эпителия роговицы, провоцирует увеит, глаукому, существенно помутнён, некоррегируемом снижении зрения и угрозе его полного вывиха [1].
Особую проблему представляет тактика врача по отношению к беременным с манифестным синдромом Марфана [11]. Проблема состоит не только в угрозе разрыва аорты в период родов, но в 50-75% вероятности рождения ребёнка с СМ. Женщина должна быть тщательно обследована. Если диаметр аорты составляет 40 мм и меньше, то прогноз беременности хороший. Ультразвуковые исследования аорты необходимо повторять каждые 5-10 недель, т.к. риск разрыва аорты в период беременности достаточно высок даже без предшествующей клинической симптоматики. В большинстве случаев родоразрешение возможно через естественные пути. Кесарево сечение при благополучном состоянии сердечно-сосудистой системы рекомендуется, прежде всего, по акушерским показаниям (например, несоответствие размеров головки плода и родовых путей, преэклампсия)
Прогноз СМ полностью определяется степенью изменения сердечно-сосудистой системы. Однако в современных условиях при ранней диагностике и адекватной терапии, при необходимости — хирургической коррекции, продолжительность жизни больных достигает 70 лет.
В.М. Делягин1, 2, Ж.С. Жакупова1, И.А. Нарычева1, М.Б. Мельникова3
1ФГУ Федеральный научно-клинический центр детской гематологии, онкологии, иммунологии Росздрава,
2кафедра поликлинической педиатрии РГМУ,
3Российская детская клиническая больница, Москва
Литература:
1. Chen H. Marfan Syndrome. eMedicine. Last Update January 04 2006. https://www.emedicine.com/ped/topic1372.htm
2. Засухина Т.Д., Львова Т.Н., Васильева И.Т. Пониженная способность к репарации повреждений ДНК, индуцированных мутагенами в клетках больных синдромом Марфана. // Доклады АН СССР, 1982. — 265. — 5. — сс. 1261 — 1263.
3. Boileau C, Jondeau G, Mizuguchi T, Matsumoto N. Molecular genetics of Marfan syndrome.// Current Opinion Cardiology, 2005. — v. 20. — 3. — pp. 194 — 200.
4. Лисиченко О.Ф. Синдром Марфана. / Новосибирск, Наука, 1986. — 163 с.
5. Pyeritz R. The Marfan Syndrome. In: Royce P., Steinman B. (Eds.) Connective Tissue and its Heritable Disorders. Molecular, Genetic and Metabolic Aspects. Willey-Liss, New-Jork, 1993. — pp. 437 — 468.
6. Leiber B., Olbrich G. Die klinischen Syndrome. 7., völlig neu bearbeitete Auflage, Urban & Schwarzenberg, München, Bdd. 1, 2.
7. Вейн А.М., Соловьёва А.Д., Недоступ А.В. и др. Вегетативные нарушения при пролапсе митрального клапана // Кардиология, 1995 — 2. — с. 55 — 58
8. Нарычева И.А., Ронкин М.А., Делягин В.М. Способ лечения наследственных соединительно-тканных дисплазий. Авторское свидетельство 1711369 от 08.10.91.
9. Tchen-Igondjo S., Pages P., Bac P., e.a. Marfan syndrome, magnesium treatment and medical prevention of cardiovascular complications by hemodynamic treatment and antisense gene therapy. // Magnesium Research, 2003. — v. 16. — 1. — pp. 59 — 64.
10. Прозоровская Н.Н., Глинянная С.В., Геращенко Л.П. и др. Влияние терапии бета-адреноблокатором и комплексом витаминов на показатели экскреции оксипролина при некоторых наследственных болезнях соединительной ткани // Вопросы медицинской химии, 1988. — т. 35. — № 5. — с. 99 — 104
11. Бубнова Н.И. Болезнь Марфана у беременной женщины и плода // Архив патологии, 1986. — № 9. — с. 59 — 61.
Источник
