Синдром множественной эндокринной неоплазии 1 типа
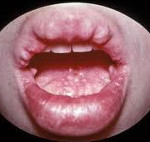

Синдром множественных эндокринных неоплазий – группа наследственных заболеваний, характеризующихся множественными опухолевыми или гиперпластическими поражениями эндокринных желез. Клинические проявления множественных эндокринных неоплазий обусловлены типом синдрома: при МЭН 1 типа в патологический процесс вовлекаются паращитовидные железы, аденогипофиз, поджелудочная железа; при МЭН 2А типа – щитовидная железа и надпочечники; при МЭН 2В типа – щитовидная железа, паращитовидные железы, надпочечники и слизистые оболочки. Диагностика множественных эндокринных неоплазий включает проведение генетических исследований, лабораторных анализов, визуализирующих инструментальных исследований. Лечебная тактика при множественных эндокринных неоплазиях включает хирургическое удаление опухолей желез.
Общие сведения
Термином «множественные эндокринные неоплазии» (МЭН) в эндокринологии объединяют наследственные аутосомно-доминантные синдромы, протекающие с гиперплазией или опухолями нескольких желез внутренней секреции. Чаще всего в синдром множественных эндокринных неоплазий оказываются вовлечены щитовидная и паращитовидные железы, гипофиз, надпочечники, поджелудочная железа, желудочно-кишечный тракт, нервная система. Неоплазия может проявляться аденоматозом, гиперплазией или карциноматозом эндокринных желез.
С учетом характерной локализации неоплазии и основных клинических симптомокомплексов выделяют МЭН 1 типа (синдром Вермера), МЭН 2А типа (синдром Сиппла), МЭН 2В типа (синдром Горлина).
Синдром множественных эндокринных неоплазий
Множественные эндокринные неоплазии 1 типа
Характеристика МЭН 1 типа
Компонентами множественных эндокринных неоплазий 1 типа являются поражение паращитовидных желез, гипофиза, поджелудочной железы, реже — щитовидной железы, надпочечников и половых желез.
Множественные эндокринные неоплазии 1 типа впервые были описаны в 1954 г. и по автору получили название синдрома Вермера. При МЭН 1 типа в 90% случаев развивается первичный гиперпаратиреоз; у 80% больных – опухоли поджелудочной железы; в 65% наблюдений – аденомы гипофиза. Поражение надпочечников может быть представлено гиперплазией или аденомами; щитовидной железы – аденомами, тиреоидным раком, коллоидным зобом, тиреотоксикозом или хроническим лимфоцитарным тиреоидитом. Среди более редких сопутствующих нарушений встречаются липомы, полипы желудка, рак легкого, шванномы, опухоли яичек и др.
Причины МЭН 1 типа
Различают спорадические и наследственные формы множественных эндокринных неоплазий 1 типа.
В большинстве случаев МЭН 1 типа является генетически детерминированной патологией с аутосомно-доминантным типом наследования. Считается, что множественные эндокринные неоплазии 1 типа связаны с наследованием локуса llql3 на XI хромосоме. При наследственных формах имеют место мутации как в герминативных, так и в соматических клетках; при спорадических – только в соматических клетках. Учитывая возможность развития неоплазии нейроэктодермальных клеток, предполагается патогенетическая связь МЭН-синдромов с родственными эктопическими гормональными синдромами.
При множественных эндокринных неоплазиях 1 типа не все признаки заболевания могут проявляться в равной степени. Все три компонента МЭН 1 типа выявляются только в трети случаев.
Симптомы МЭН 1 типа
Ранним проявлением множественных эндокринных неоплазий 1 типа в большинстве случаев служит гиперпаратиреоз, который обычно развивается в возрасте 25—30 лет. В начальном периоде больных беспокоит пониженный аппетит, тошнота, похудание, запоры, иногда – почечные колики, обусловленные отхождением солей и мелких конкрементов. Стадия развернутой симптоматики протекает с мышечной слабостью в проксимальных отделах конечностей, болями в костях, снижением памяти, депрессивными состояниями, полидипсией и полиурией. В редких случаях гиперпаратиреоз при множественных эндокринных неоплазиях 1 типа сопровождается развитием судорог и коматозного состояния.
В целом гиперпаратиреоз при МЭН 1 типа имеет более мягкое течение в сравнении с первичным гиперпаратиреозом: крайне редки случаи хондрокальциноза, ободкового кератита, кальцификации ушных раковин и др. Вместе с тем, для множественных эндокринных неоплазий 1 типа типичны диффузный остеопороз и компрессионные переломы позвонков.
Аденомы гипофиза при множественных эндокринных неоплазиях 1 типа могут быть представлены пролактиномами, соматотропиномами, кортикотропиномами. Наличие пролактиномы приводит к развитию гиперпролактинемического гипогонадизма: дисменореи, галактореи, бесплодия (у женщин); половых расстройств, гинекомастии – у мужчин. Соматотропиномы сопровождаются акромегалией, стойкими головными болями, миастенией, снижением памяти и т. д.; кортикотропиномы вызывают развитие болезни Иценко—Кушинга, реже — гипопитуитаризма. При множественных эндокринных неоплазиях 1 типа, как правило, выявляются опухоли поджелудочной железы: инсулиномы, гастриномы, випомы, крайне редко – глюкагономы, соматостатиномы и др.
Инсулиномы нередко бывают множественными; в 3—6% случаев – злокачественными. Клинические проявления инсулиномы обусловлены развитием гипогликемического синдрома. Второй по частоте опухолью поджелудочной железы при множественных эндокринных неоплазиях 1 типа является гастринома, сопровождающаяся развитием синдрома Золлингера—Эллисона. Випома – гормонально-активная опухоль АПУД-системы, секретирующая избыточные количества вазоактивного интестинального полипептида; вызывает постоянную или интермиттирующую диарею, стеаторею, гипотонию, кожные высыпания, обезвоживание.
Диагностика МЭН 1 типа
Достоверная диагностика множественной эндокринной неоплазии 1 типа основана на выявлении не менее 2-х компонентов данного синдрома. Лабораторные изменения могут включать увеличение уровня ионизированного кальция, гипофосфатемию, повышение уровня паратиреоидного гормона, инсулина, пролактина, СТГ, гастрина и др. С целью топической диагностики опухолей эндокринных желез выполняются УЗИ и ЯМР-томография паращитовидных желез, сцинтиграфия, селективная артериография; рентгенография турецкого седла, КТ или МРТ головного мозга; УЗИ и ультрасонография поджелудочной железы.
Для оценки степени вторичных поражений внутренних органов при множественных эндокринных неоплазиях 1 типа исследуется расширенная биохимия крови (глюкоза, щелочная фосфатаза, электролиты, креатинин, мочевина, остаточный азот и др.); проводятся пробы мочи по Зимницкому и Сулковичу; выполняется УЗИ почек, экскреторная урография; ЭКГ, фиброгастродуоденоскопия; денситометрия, рентгенография пальцев рук, длинных трубчатых костей и др.
Лечение МЭН 1 типа
При множественных эндокринных неоплазиях 1 типа лечение обычно начинают с удаления околощитовидных желез (паратиреоидэктомии); затем производят удаление опухолей поджелудочной железы (энуклеацию, резекцию головки поджелудочной железы, дистальную резекцию, панкреатодуоденальную резекцию и т. д.). При злокачественном характере опухолей показана послеоперационная химиотерапия.
В отношении аденом гипофиза, входящих в синдром множественных эндокринных неоплазий 1 типа, может предприниматься аденомэктомия, проводиться лекарственная или дистанционная лучевая терапия.
Множественные эндокринные неоплазии 2А и 2В типов
Характеристика МЭН 2А и 2В типов
Синдром множественных эндокринных неоплазий 2А типа включает медуллярную карциному щитовидной железы, феохромоцитому и гиперпаратиреоз. Заболевание описано в 1959 г. Дж. Сипплом, в связи с чем в литературе также обозначается как синдром Сиппла.
При множественных эндокринных неоплазиях 2В типа (синдром Горлина), кроме указанных выше компонентов, имеют место невриномы слизистых оболочек, нейропатии и патология опорно-двигательного аппарата.
Причины МЭН 2А и 2В типов
Этиология синдромов МЭН 2 типа связана с аутосомно-доминантным наследованием мутации RET-протоонкогена в X хромосоме, в области 10р11.2. У больных с МЭН 2А типа мутации затрагивают кодоны 609, 618, 620 и 634 в экзоне 10 и кодоны 768 и 804 в экзоне 11; при МЭН 2В типа – 918 кодон экзона 11. Мутации RET-протоонкогена вызывают его активацию, что обусловливает неконтролируемый клеточный рост и неопластическую трансформацию.
Множественные эндокринные неоплазии 2 типа встречаются с частотой 1-10 случаев на 100 тыс. населения.
Симптомы МЭН 2А и 2В типов
К ранним проявлениям множественной эндокринной неоплазии 2А типа относится медуллярный рак щитовидной железы, исходящий из парафолликулярных клеток и секретирующий кальцитонин. Симптоматика скудна; в трети случаев может отмечаться диарея и карциноидный синдром, связанный с продукцией опухолью вазоактивных пептидов (гистамина, серотонина, простагландинов). Еще реже карцинома щитовидной железы секретирует АКТГ, вызывая развитие синдрома Иценко-Кушинга. В большинстве случаев медуллярный рак щитовидной железы выявляется при обследовании пациентов по поводу узлового зоба.
Феохромоцитома при множественной эндокринной неоплазии 2А типа обнаруживается у половины больных, обычно уже после опухолевого поражения щитовидной железы. Феохромоцитома, как правило, сопровождается умеренной транзиторной или постоянной артериальной гипертензией, общей слабостью, гипергидрозом, гиперсаливацией, полиурией. При кризовом течении феохромоцитомы высока вероятность фибрилляция желудочков, острой сердечной недостаточности, отека легких, геморрагического инсульта.
Признаками гиперпаратиреоза при синдроме множественных эндокринных неоплазий 2А типа могут являться снижение аппетита, тошнота, боли в эпигастрии, почечные колики. МЭН 2А типа может протекать в сочетании с первичным амилоидозом кожи или болезнью Гиршпрунга.
При синдроме множественных эндокринных неоплазий 2В типа к медуллярной карциноме щитовидной железы, феохромоцитоме и гиперпаратиреозу добавляется развитие патологии опорно-двигательного аппарата и множественных неврином слизистых оболочек.
Пациенты с множественными эндокринными неоплазиями 2В типа имеют марфаноподобную внешность; у них часто встречается искривление позвоночника, воронкообразная деформация грудной клетки, конская стопа, арахнодактилия, вывихи бедренных костей. Невриномы чаще локализуются на языке, слизистых губ, щек, ЖКТ. Они представляют безболезненные бело-розовые узелки размером 1—3 мм. Со стороны пищеварительной системы могут отмечаться диарея, запоры, мегаколон.
Диагностика МЭН 2А и 2В типов
Выявление отдельных компонентов множественных эндокринных неоплазий 2 типа строится на принципах диагностики соответствующих заболеваний.
В процессе обследования проводится УЗИ и сцинтиграфия надпочечников и щитовидной железы, определение уровня кальция крови и гормонов (тиреоглобулина, кальцитонина, АКТГ, катехоламинов, паратгормона). Генетический скрининг позволяет выявить мутацию RET-протоонкогена.
Лечение МЭН 2А и 2В типов
При синдроме множественных эндокринных неоплазий 2 типа лечение предусматривает первоочередное удаление феохромоцитомы – одностороннюю или двустороннюю адреналэктомию. При двустороннем удалении надпочечников для профилактики хронической надпочечниковой недостаточности требуется постоянная заместительная глюко- и минералокортикоидная терапия.
Следующим этапом выполняется тиреоидэктомия с лимфодиссекцией. В послеоперационном периоде для коррекции послеоперационного гипотиреоза назначаются препараты тироксина. В случае неоперабельной карциномы щитовидной железы проводится химиотерапия.
Хирургическая тактика в отношении гиперпаратиреоза при множественных эндокринных неоплазиях 2 типа может предусматривать субтотальную паратиреоидэктомию, в некоторых случаях – тотальное удаление околощитовидных желез с аутотрансплантацией паратироидной ткани в мышцу предплечья.
Прогноз при синдроме множественных эндокринных неоплазий
Генетический скрининг и динамическое наблюдение пациентов с множественными эндокринными неоплазиями 1 типа позволяют выявлять и контролировать течение синдрома, что значительно улучшает прогноз при данной патологии. При множественных злокачественных опухолях поджелудочной железы прогноз гораздо хуже.
При синдроме множественных эндокринных неоплазий 2-го типа прогноз также неблагоприятный, во многом определяется операбельностью и метастазированием рака щитовидной железы и феохромоцитомы.
Источник
В статье представлен клинический случай синдрома множественной эндокринной неоплазии 1-го типа
Синдром множественной эндокринной неоплазии (МЭН) – генетически детерминированная патология с аутосомно-доминантным типом наследования, проявляющаяся доброкачественными или злокачественными опухолями (гиперплазией) двух и более эндокринных желез [1–3]. Синдром МЭН характеризуется высокой степенью пенетрантности, которая к 20-летнему возрасту составляет 50%, к 40 годам – 95% [4, 5]. Риск развития синдрома МЭН в семьях с данной патологией составляет около 75%. В 50% случаев синдром развивается спорадически, т. е. обусловлен вновь возникшей (de novo) мутацией в половых или соматических клетках. Риск развития синдрома МЭН у ребенка со спорадической формой составляет 50%.
Выделяют несколько типов синдрома МЭН, которые отличаются генетической основой, локализацией и сочетанием поражения внутренних органов. Синдром МЭН 1–го типа (МЭН1) – синдром Вермера – наиболее часто характеризуется наличием патологии околощитовидных желез (гиперплазии или аденомы), нейроэндокринной опухолью (НЭО) поджелудочной железы и опухолью аденогипофиза. Для синдрома МЭН 2-го типа характерно наличие медуллярного рака щитовидной железы как постоянного признака, сочетание которого с феохромоцитомой и паратиромой относят к синдрому МЭН 2А типа (синдром Сиппла), а при сочетании феохромоцитомы с множественными ганглионейромами слизистой оболочки желудочно-кишечного тракта – МЭН 2Б типа (синдром Горлина). Различают также синдром МЭН 4-го типа, который характеризуется наличием паратиромы, опухолей аденогипофиза, репродуктивных органов, почек и надпочечников [6, 7].
Синдром МЭН1 наследуется аутосомно-доминантно, но может возникать и спорадически. Распространенность синдрома составляет до 15–30 случаев на 100 000 населения [8]. Причиной развития синдрома является мутация в гене – супрессоре опухолей, расположенном на 11-й хромосоме (11q13). Ген кодирует белок менин, регулирующий пролиферацию клеток. Синдром МЭН1 чаще манифестирует в молодом возрасте (20–25 лет) первичным гиперпаратиреозом, который характеризуется более мягким течением, при этом высокой частотой рецидивов после паратиреоидэктомии (50% от 8 до 12 лет после операции) и морфологически проявляется гиперплазией трех или четырех паращитовидных желез [1]. Первичный гиперпаратиреоз выявляется в 90% случаев синдрома МЭН1 к 40 годам.
В 30–80% случаев синдрома МЭН1 встречаются энтеропанкреатические опухоли, вырабатывающие различные гормоны: соматостатин, грелин, вазоактивный интестинальный пептид, серотонин, кальцитонин, нейротензин, гастрин, хромогранин А или Б, инсулин, проинсулин, глюкагон. Они характеризуются мультицентрическим ростом, чаще манифестируют после 40 лет.
Опухоли гипофиза при синдроме МЭН1 в 2 раза чаще встречаются у мужчин, чем у женщин. Среди опухолей гипофиза при синдроме МЭН1 наиболее часто встречаются пролактиномы (60%), а также опухоли, секретирующие гормон роста (25%). Реже встречаются макроаденомы, которые характеризуются агрессивным ростом и низкой чувствительностью к терапии. Менее чем в 5% случаев встречаются нефункциональные опухоли, кортикотропиномы [2].
При синдроме МЭН1 также могут диагностироваться опухоли, расположенные в бронхах и тимусе. Опухоли тимуса чаще являются нефункциональными, характеризуются агрессивным ростом и преимущественно встречаются у курильщиков [3]. У женщин чаще наблюдаются карциноиды бронхов, которые могут секретировать соматостатин, серотонин, кортикотропин и гормон роста. Липомы при синдроме МЭН1 могут располагаться подкожно, ретроперитонеально, висцерально и плеврально [4]. У 20–40% больных встречаются опухоли надпочечников, чаще всего доброкачественные (аденомы, диффузная или узловая гиперплазия) и гормонально неактивные [4].
Ожидаемая продолжительность жизни больных с синдромом МЭН1 снижена. Благоприятный прогноз имеется при раннем выявлении синдрома и своевременном лечении, что предотвращает инвалидизацию. У больных с множественными злокачественными опухолями (глюкагономой, инсулиномой, випомой, гастриномой) прогноз хуже. Смертность составляет 50% у больных старше 50 лет, примерно в половине случаев – вследствие злокачественных НЭО и карциноидных опухолей тимуса [5, 9]. В связи с этим очень важно наблюдение пациентов специалистами различного профиля (гастроэнтерологов, онкологов, хирургов-эндокринологов, радиологов, генетиков), имеющих опыт лечения данного заболевания.
Клинический случай
Больная М., 35 лет, в 2016 г. обратилась к кардиологу консультативно-диагностического отделения МОНИКИ им. М.Ф. Владимирского в связи повышением артериального давления максимально до 200/100 мм рт. ст., которое стало отмечаться с 20-летнего возраста. При лабораторном обследовании впервые была выявлена гиперкальциемия, больную направили на консультацию к эндокринологу. При проведении лабораторных исследований для уточнения наиболее вероятных причин гиперкальциемии отмечалось повышение паратгормона (ПТГ) до 69,6 пг/мл (референсные значения 15,0–65,0) и 10,1 пмоль/л (реф. зн. 1,26–7,58). При двухкратном повторном исследовании общего кальция крови было подтверждено его повышение до 2,63 и 2,69 ммоль/л (реф. зн. 2,10–2,55), а также выявлено снижение неорганического фосфора до 0,64 ммоль/л (реф. зн. 0,87–1,45). В биохимическом анализе крови исследовались общий белок, альбумин, щелочная фосфатаза, уровень которых был в пределах референсных значений, а также креатинин – 72 мкмоль/л (реф. зн. 44–80) с расчетом скорости клубочковой фильтрации по формуле Коккрофта – Голта, которая составила 93 мл/мин. Также при определении кальция в суточной моче была отмечена гиперкальциурия – 8,8 ммоль/сут (реф. зн. 0–6,2). У больной диагностирован первичный гиперпаратиреоз.
У пациентки исследован витамин D сыворотки крови 25(ОН)D, уровень которого составил 18,9 нг/мл, что говорит о его дефиците. Несмотря на наличие легкой гиперкальциемии, под контролем общего кальция крови и ПТГ был назначен препарат колекальциферола в стандартной насыщающей дозе 7000 МЕ/сут курсом 8 нед. После восполнения дефицита витамина D (до 31,3 нг/мл) показатели кальция крови и ПТГ оставались в исходных пределах.
Дальнейшее обследование с применением инструментальных методов диагностики было направлено на поиск возможных костных и висцеральных проявлений первичного гиперпаратиреоза и визуализацию паращитовидных желез.
Была проведена двухэнергетическая рентгеновская абсорбциометрия, при которой выявлено незначительное снижение минеральной плотности кости (по Z-критерию) по сравнению с возрастной нормой только в проксимальном отделе бедра – 1,4SD (neck), при отсутствии в анамнезе переломов и деформаций скелета. При эзофагогастродуоденоскопии диагностированы дистальный катаральный эзофагит и гастродуоденит. В проекции хвоста поджелудочной железы выявлено гипоэхогенное округлое образование неоднородной структуры размером 10×8 мм по данным ультразвукового исследования брюшной полости и почек. Компьютерная томография органов брюшной полости и забрюшинного пространства с контрастированием также выявила объемное образование в хвосте поджелудочной железы, размеры которого составили 14,5×14,5×15 мм, кроме этого были отмечены признаки гиперплазии левого надпочечника.
Ультразвуковое исследовании щитовидной и паращитовидных желез показало наличие гипоэхогенного округлого образования с четкими контурами размером 6×4×4 мм позади нижнего полюса левой доли щитовидной железы, что трактовалось как вероятное образование левой нижней паращитовидной железы, требующее дифференцирования с лимфатическим узлом. На мультиспиральной компьютерной томографии шеи и средостения с контрастированием вдоль задне-нижнего контура левой доли щитовидной железы также выявлено образование неправильной округлой формы размером 6,0×6,1 мм, что было расценено как вероятная аденома паращитовидной железы. В переднем средостении, кпереди от восходящей части аорты и легочного ствола, определялось мягкотканное образование неправильной округлой формы с четкими контурами, не реагирующее на контрастное усиление, размером 17×40×21 мм, прилежащее к восходящему отделу аорты и легочному стволу. При сцинтиграфии с однофотонной эмиссионной томографией шеи и средостения определялся очаг гиперфиксации радиофармпрепарата по заднему контуру левой доли щитовидной железы на уровне ее нижней трети, что расценено как аденома левой нижней околощитовидной железы.
Учитывая молодой возраст больной, подтвержденный первичный гиперпаратиреоз, а также выявленное образование поджелудочной железы, было высказано предположение о наличии синдрома МЭН1 и рекомендовано скрининговое обследование родственников первой линии родства. Проведены диагностические тесты для исключения первичного гиперпаратиреоза как наиболее частого проявления предполагаемой наследственной патологии. У матери выявлено повышение общего кальция до 3,09 ммоль/л (реф. зн. 2,1–2,55) и ПТГ 78,4 пг/мл (реф. зн. 12–65); у родного брата – кальций ионизированный составил 1,22 ммоль/л (реф. зн. 1,03–1,23), ПТГ – 6,91 пмоль/л (реф. зн. 1,6–6,9). В настоящее время проводится дальнейшее обследование родственников.
Продолжено обследование больной для исключения гормональной активности выявленного образования поджелудочной железы, гиперфункции коры надпочечников, а также других возможных проявлений синдрома МЭН1 при отсутствии каких-либо специфических жалоб и симптомов. При магнитно-резонансной томографии гипофиза с контрастированием патологии не выявлено. Несмотря на это, гормональное обследование включило определение гормонов аденогипофиза: адренокортикотропного гормона, тиреотропного гормона, пролактина, а также инсулиноподобного фактора 1 (ИРФ-1), кортизола крови – отклонений от референсных значений не выявлено. Указание на подъем артериального давления и вероятная гиперплазия надпочечника послужили показанием к исследованию уровня альдостерона крови и активности ренина плазмы с расчетом альдостерон-ренинового соотношения, а также метилированных катехоламинов в суточной моче (метанефрина и норметанефрина). Повышения данных параметров не выявлено. Уровень исследованного хромогранина А также был в пределах нормальных значений, другие маркеры НЭО по техническим причинам не определялись. Отсутствие отклонений исследуемых лабораторных параметров позволило в настоящее время исключить гормональную активность образования поджелудочной железы и гиперфункцию коры надпочечников.
В дальнейшем больной было проведено генетическое исследование методом полимеразной цепной реакции (ПЦР) в Эндокринологическом научном центре. По результатам ДНК-диагностики (ПЦР, прямое секвенирование экзонов 2–10 гена MEN1) выявлена гетерозиготная замена с.1261Т>С:р.С421R. Мутация в том же кодоне описана при синдроме МЭН1, однако конкретная мутация ранее не была описана.
Таким образом больной был поставлен диагноз: «Множественная эндокринная неоплазия 1-го типа. Первичный гиперпаратиреоз, мягкая форма. Аденома левой нижней околощитовидной железы. Гормонально неактивное образование поджелудочной железы. Образование переднего средостения».
Следует отметить наличие у больной осложненного акушерско-гинекологического анамнеза. Первая неразвивающаяся беременность была прервана на сроке 5 нед. гестации в возрасте 29 лет. Вторая беременность в 32 года завершилась экстренным оперативным вмешательством путем кесарева сечения на сроке 24–25 нед. в связи с тяжелой преэклампсией. Было рекомендовано проведение генотипирования, по результатам которого выявлен полиморфизм, ассоциированный со снижением фибринолитической активности и риском тромбозов в гетерозиготной форме SERPINE1: 4G/5G (PAI1:4G/5G4; Ins/Del G) и полиморфизм, предрасполагающий к тромбозам в гетерозиготной форме MTHFR: C677T (Ala222Val).
Обсуждение
Молодой возраст является одним из абсолютных показаний к оперативному лечению первичного гиперпаратиреоза. Однако неоднозначность современных подходов относительно объема хирургического вмешательства на паращитовидных железах у больных с синдромом МЭН1 и мягкое течение гиперпаратиреоза у данной больной позволили придерживаться в настоящее время консервативной тактики ведения. Возможное планирование беременности должно послужить поводом для повторного решения вопроса о необходимости оперативного лечения в связи с риском утяжеления гиперкальциемии, а сочетание с выявленной генетической предрасположенностью к тромбообразованию требует всестороннего дальнейшего наблюдения с участием специалистов различного профиля.
Заключение
Данное клиническое наблюдение свидетельствует о важности скринингового исследования общего кальция крови при наличии неспецифических проявлений первичного гиперпаратиреоза. Молодой возраст больных с подтвержденным диагнозом первичного гиперпаратиреоза, в особенности сочетающегося с плохо контролируемым течением артериальной гипертензии, является безусловным поводом для проведения диагностического поиска синдрома множественной эндокринной неоплазии. Выявленная мутация гена MEN1 у представленной больной, возможно, способствует менее агрессивному течению заболевания. Выбранная консервативная тактика ведения должна сопровождаться активным динамическим контролем за развитием клинической картины для своевременной оценки показаний к оперативному лечению.
Источник
