Синдром поражения клубочков у детей

Поражение клубочков почек детей. Патогенез гломерулонефрита
Патология клубочков может быть следствием генетических и иммунологических причин, а также нарушений свертываемости крови. К генетическим причинам относятся:
1) мутация генов, кодирующих белки клубочков, интерстиция или канальцевого эпителия;
2) мутация регуляторных генов, контролирующих транскрипцию ДНК;
3) нарушение посттранскрипционных модификаций РНК;
4) нарушение посттрансляционных модификаций белков.
Наиболее часто имеют место иммунные повреждения клубочков, приводящие к гломерулонефриту, который одновременно является и генетической формой ряда заболеваний, и гистопатологическим термином, означающим воспаление клубочковых капилляров. Признаки гломерулонефрита, вызванного иммунологическими нарушениями, включают:
1) морфологические и иммунопатологические проявления, сходные с таковыми при экспериментальном иммунном гломерулонефрите;
2) отложение в клубочках иммуноглобулинов и компонентов комплемента;
3) изменения комплемента в сыворотке крови или присутствие в ней аутоантител (например, к базальной мембране клубочков).
Существует, по-видимому, два основных механизма иммунных повреждений почечных клубочков:
1) отложение в них иммунных комплексов (антиген-антитело) и
2) взаимодействие антител с местными антигенами in situ.
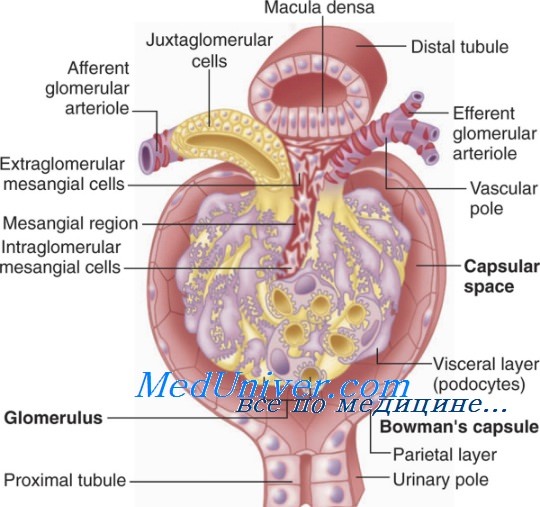
В последнем случае антиген может быть как собственным нормальным компонентом клубочков (например, неколлагеновый домен (NC-1) коллагена IV типа — предполагаемый антиген при нефрите У человека, обусловленном антителами к базальной мембране клубочков), так и откладывающимся в них веществом.
При заболеваниях, обусловленных отложением иммунных комплексов, антитела образуются и связываются с антигенами, которые обычно находятся вне почек. Иммунные комплексы накапливаются в почках и активируют систему комплемента, приводя к повреждению почечной ткани. Экспериментальные исследования показывают, что такие комплексы образуются в крови и лишь откладываются в почках. Однократное внутривенное введение кроликам бычьего сывороточного альбумина приводит к развитию у животных острой сывороточной болезни.
Через 1 нед. после введения у кроликов вырабатываются антитела к бычьему сывороточному альбумину, причем антиген остается в крови в высокой концентрации. Попадающие в кровь антитела формируют иммунные комплексы с антигеном. Пока количество антигена в крови превышает количество антител (избыток антигена), эти комплексы имеют небольшие размеры и остаются растворенными в крови. Тем не менее они откладываются в почечных клубочках. Процесс отложения иммунных комплексов в почках зависит от особенностей комплексов (их концентрации, заряда и размера) и самих клубочков (способности мезангиальной ткани к захвату комплексов, отрицательного заряда капиллярной стенки), гидродинамических сил и влияния различных медиаторов (ангиотензин II, простагландины).
Отложение иммунных комплексов в клубочках приводит к развитию у кроликов острого пролиферативного гломерулонефрита. Методом прямой иммунофлюоресценции на стенках клубочковых капилляров обнаруживают гранулярные (комковатые) отложения, содержащие иммуноглобулины и компоненты комплемента. Под электронным микроскопом видно, что эти отложения располагаются на эпителиальной стороне базальной мембраны клубочков и в мезангии. Через несколько дней в кровь попадает дополнительное количество антител, несвязанный антиген в конце концов исчезает из крови, гломерулонефрит стихает. У кроликов комплемент не принимает участия в поражении капилляров; оно обусловлено в основном притоком макрофагов. Однако на других экспериментальных моделях установлено участие комплемента в повреждении капилляров.
Примером взаимодействия антител с антигеном in situ служит антительный гломерулонефрит, при котором антитела реагируют с антигенами самой базальной мембраны клубочков. Иммуногистоло-гические исследования обнаруживают при этом отложения иммуноглобулинов и комплемента в виде непрерывной полосы на базальной мембране, как при синдроме Гудпасчера и некоторых типах быстро прогрессирующего гломерулонефрита.
Воспалительная реакция, развивающаяся после иммунного повреждения, может быть обусловлена активацией нескольких механизмов. Важнейшим среди них является система комплемента, которая может активироваться иммунными комплексами по классическому пути или полисахаридами и эндотоксином по альтернативному (пропердиновому). Оба эти пути сходятся в точке образования компонента С3, после чего одна и та же последовательность реакций приводит к лизису клеточных мембран. Главные повреждающие продукты образуются после активации компонента С3. К ним относятся анафилатоксин (стимулирующий сократительные белки сосудистой стенки и увеличивающий ее проницаемость) и хемотаксические факторы (С5а), которые привлекают нейтрофилы и, вероятно, макрофаги к месту активации комплемента. Эти клетки выделяют вещества, прямо действующие на сосудистую стенку и базальную мембрану.
Система свертывания крови может активироваться непосредственно после повреждения эндотелиальных клеток (при котором обнажается тромбогенный субэндотелиальный слой и запускается каскад соответствующих реакций) или опосредованно через активацию комплемента. Отложения фибрина обнаруживаются как в самих клубочковых капиллярах, так и в боуменовом пространстве в форме полулуний. Активация процессов свертывания крови может стимулировать образование кининов, которые, в свою очередь, обладают хемотаксическими и анафилатоксиноподобными свойствами.
– Вернуться в оглавление раздела “физиология человека”
Оглавление темы “Заболевания детей”:
- Врожденные невропатии у детей. Диагностика
- Семейная вегетативная дисфункция – синдром Райли-Дея у детей. Причины
- Диагностика семейной вегетативной дисфункции – синдрома Райли-Дея. Лечение
- Врожденная нечувствительность к боли и ангидроз. Рефлекторная симпатическая дистрофия
- Синдром Гийена-Барре у детей: восходящий паралич Ландри и синдром Миллера-Фишера
- Диагностика и лечение синдрома Гийена-Барре у детей. Прогноз
- Паралич Белла у детей. Диагностика и лечение
- Анатомия почечных клубочков. Строение
- Клубочковая фильтрация в почках. Механизмы
- Поражение клубочков почек детей. Патогенез гломерулонефрита
Источник
Нефротический синдром у детей — это симптомокомплекс, который клинически проявляется отеками и снижением диуреза. Лабораторные признаки патологии — протеинурия, гиперлипидемия, гипоальбуминемия и диспротеинемия. Синдром развивается при первичных гломерулопатиях, аутоиммунных, онкогематологических и сердечно-сосудистых заболеваниях. Для диагностики проводят анализы крови и мочи, биопсию почки, ЭхоКГ и ЭКГ. Лечение включает длительные курсы иммуносупрессорной терапии (глюкокортикоиды, алкилирующие агенты, ингибиторы кальциневрина) в комбинации с нефропротекторными, гипотензивными и мочегонными препаратами.
Общие сведения
Распространенность нефротического синдрома составляет 12-16 случаев на 100 тыс. детского населения. Ежегодно нефрологи выявляют от 2 до 7 новых случаев заболевания на 100 тысяч пациентов младше 18 лет. Патология не относится к самостоятельным нозологическим единицам, а представляет собой один из синдромов почечных или внепочечных болезней. Актуальность этой проблемы в педиатрической практике обусловлена сложностью терапии и частыми случаями резистентности к лекарствам.

Нефротический синдром у детей
Причины
У детей чаще выявляются первичные формы нефротического синдрома, вызванные поражением клубочкового аппарата почек. В 85% морфологическим субстратом является болезнь минимальных изменений, до 5-7% составляет фокально-сегментарный гломерулосклероз, 4-6% отводится мезангиопролиферативному гломерулонефриту. Вторичный вариант заболевания имеет несколько этиологических факторов:
- Аутоиммунные процессы. Они сопровождаются образованием иммунных комплексов и провоспалительных цитокинов, которые откладываются в почечных капиллярах, нарушая работу фильтрационной системы органа. У детей причиной могут послужить системные васкулиты, системная красная волчанка, синдром Шегрена.
- Злокачественные опухоли. Почечные поражения возникают при лимфоме Ходжкина и неходжкинских новообразованиях, которые зачастую встречаются в детском возрасте. Среди менее распространенных онкологических факторов выделяют множественную миелому, солидные опухоли.
- Токсические повреждения почек. Нефротический синдром возможен при длительном и бесконтрольном приеме ребенком нестероидных противовоспалительных средств и некоторых антибиотиков. Поражение почек также наблюдается при отравлении солями тяжелых металлов, ядами змей и перепончатокрылых насекомых.
- Нарушения почечного кровотока. Повышенная секреция белка в мочу происходит при структурных повреждениях почечных клубочков на фоне тотальной ишемии. Она может быть вызвана тромбозом почечной вены, серповидно-клеточной анемией, злокачественной гипертензией.
- Врожденные гломерулопатии. У детей встречается синдром Альпорта, для которого характерны мутации коллагеновых волокон в базальных мембранах клубочков. Реже диагностируется болезнь Фабри, когда нефропатия связана с нарушениями метаболизма сфинголипидов.
Патогенез
На начальных этапах нефротического синдрома развивается протеинурия, вызванная повышением проницаемости почечного фильтра для белков. Это обусловлено структурно-функциональными повреждениями компонентов почечного клубочка. Большую роль в этом процессе имеют аутоиммунные механизмы: активированные Т-лимфоциты вырабатывают специфические цитокины, которые повреждают клеточные мембраны и «щелевые» контакты подоцитов.
Повышенная потеря белков с мочой снижает онкотический показатель крови. Как следствие, жидкость по градиенту давления начинает перемещаться из сосудистого русла в ткани. Таким образом формируются массивные нефротические отеки. Их интенсивность зависит от степени белковых потерь и активности компенсаторных механизмов. В 10% случаев отечный синдром развивается вследствие первичной задержки натрия в организме.
Симптомы
Для патологии типично острое начало, связь с перенесенной инфекцией, переохлаждением, вакцинацией или обострением хронической соматической болезни. Сначала ребенок жалуется на общую слабость, недомогание, сонливость и заторможенность. Реже беспокоят головные и абдоминальные боли, тошнота, снижение аппетита. У девочек-подростков бывают нарушения менструального цикла.
Основное проявление нефротического синдрома — отеки. Вначале они возникают на лице (утром) и на голенях (вечером, после длительной ходьбы), а затем постепенно распространяются по всему телу. Первоначально они мягкие, расположены симметрично, кожа над ними теплая и сухая. Параллельно с этим снижается количество суточной мочи. Периферические отеки дополняются полостными — асцитом, гидроперикардом, гидротораксом, что ухудшает состояние ребенка.
Осложнения
Негативные последствия нефротического синдрома вызваны потерей альбуминов, которые в норме выполняют ряд физиологических функций. Потеря иммуноглобулинов ухудшает иммунную защиту организма, что проявляется частыми респираторными инфекциями, рецидивирующими тонзиллитами и синуситами. Снижение количества трансферрина (переносчика железа) приводит к рефрактерной железодефицитной анемии.
Значимым осложнением для детей младшего возраста является потеря витамин-Д-связывающего белка. В результате формируется рахитоподобный синдром, нарушается минерализация и рост костей скелета. В редких случаях развивается повышенная кровоточивость из-за дефицита прокоагулянтов. При стероидорезистентном варианте болезнь в течение 5-10 лет прогрессирует до терминальной ХПН.
Диагностика
При физикальном осмотре детский нефролог обращает внимание на симметричность и расположение отеков, проводит аускультацию сердца и легких, определяет признаки асцита и увеличения печени. Симптомы не дают возможности установить клинический диагноз, поэтому врач назначает полное обследование. Составляющие диагностического комплекса:
- Анализ мочи. Патогномоничными признаками нефротического синдрома являются протеинурия более 50 мг/кг/сутки, соотношение протеин/креатинин более 2 и экскреция альбумина свыше 40мг/м2/час. Для исключения эритроцитурии и лейкоцитурии показан анализ по Нечипоренко. Функцию почек оценивают с помощью пробы Реберга.
- Анализ крови. При биохимическом исследовании выявляют уровень альбумина сыворотки менее 30 г/л, повышение уровня холестерина и триглицеридов, увеличение показателя креатинина. Уровни натрия и кальция крови снижаются, а калий может быть повышен. В коагулограмме наблюдается повышение фибриногена.
- ЭхоКГ. Ультразвуковая визуализация необходима для обнаружения гидроперикарда, морфометрических изменений крупных сосудов вследствие отеков. Также рекомендована ЭКГ, которая позволяет вовремя заметить нарушения ритма и проводимости, связанные с электролитными нарушениями.
- Биопсия почки. Пункционный забор материала выполняется при нефротическом синдроме у младенцев до 1 года и подростков старше 12 лет, а также при неэффективности стандартной медикаментозной терапии. Биоптаты подвергают световой, электронной и иммунофлюоресцентной микроскопии.
Лечение нефротического синдрома у детей
Дети с острым нефротическим синдромом подлежат обязательной госпитализации на 2-3 недели. Двигательная активность при этом не ограничивается и соответствует самочувствию больного. В диете необходимо поддерживать высокий уровень белков, а подросткам с массивными отеками рекомендовано снизить потребление поваренной соли. При выраженных потерях протеинов назначается коррекция гомеостаза коллоидными и кристаллоидными растворами.
Основу патогенетического лечения детей с нефротическим синдромом составляет иммуносупрессивная терапия с применением глюкокортикоидов. Препараты уменьшают образование и поступление в патологический очаг воспалительных клеток, угнетают секрецию медиаторов воспаления, приостанавливают формирование токсических иммунных комплексов. Терапия глюкокортикоидами проводится в 3-х режимах:
- Постоянный. Показан в начале лечения, чтобы быстро достичь фазы ремиссии. Гормоны принимаются перорально в первой половине дня в суточной дозировке 1-2 мг/кг.
- Альтернирующий. Назначается после достижения ремиссии. Стандартные дозы глюкокортикоидов используются через день, чтобы сохранить клинический эффект, но снизить риски побочных реакций.
- Пульс-терапия. Применяется при тяжелом течении нефротического синдрома. Гормоны вводятся внутривенно капельно, чтобы в короткие сроки достичь высоких концентраций лекарства в крови.
При развитии тяжелых побочных эффектов на гормональные препараты или стероидорезистентном варианте заболевания переходят на другие виды иммуносупрессоров. В детской нефрологии наилучший результат показывают ингибиторы кальциневрина, алкилирующие агенты, некоторые моноклональные антитела к лимфоцитам. Они могут вызывать нефротоксичность, поэтому во время лечения врачи контролируют уровень СКФ.
Для устранения массивных отеков проводится терапия петлевыми диуретиками в возрастных дозировках. С целью ликвидации рефрактерных полостных отеков назначаются комбинации петлевых и тиазидных мочегонных. В качестве гипотензивных и нефропротекторных средств у детей лучше всего работают ингибиторы АПФ и блокаторы рецепторов ангиотензина. Коррекцию остеопении производят препаратами витамина Д.
Прогноз и профилактика
У детей с хорошим ответом на стероидную терапию в 95% наблюдается полное выздоровление без снижения функции почек. Менее благоприятный прогноз при стероидорезистентности, поскольку у таких пациентов высокий риск формирования хронической почечной недостаточности. Однако, своевременное применение иммуносупрессоров и нефропротекторов позволяет замедлить патологический процесс.
Первичная профилактика включает рациональное назначение лекарств, раннюю диагностику и терапию аутоиммунных процессов, избегание контактов с нефротоксическими веществами. Вторичная профилактика предполагает курсы гормональной терапии при обострении основной патологии либо в случае интеркуррентного заболевания. Это необходимо для предупреждения рецидивов нефротического синдрома.
Источник
Почечная недостаточность у детей — это острое или хроническое нарушение функций почек, которое сопровождается электролитными и метаболическими расстройствами. Провоцируется ренальными, преренальными и постренальными причинами. Симптомы почечной недостаточности включают неспецифические проявления (слабость, ухудшение аппетита, похудение), изменение диуреза и состава мочи, уремические осложнения со стороны внутренних органов. Для диагностики проводят исследование крови и мочи, УЗИ органов мочевыделения, биопсию почек. Лечение состоит из коррекции гомеостаза, этиопатогенетической терапии, перитонеального или гемодиализа.
Общие сведения
Истинную распространенность патологии у детей определить затруднительно, что обусловлено расхождением в классификациях и общепринятых диагностических критериях. Для хронической почечной недостаточности называют цифру от 3 до 50 случаев на 1 млн. детского населения, при этом заместительная терапия требуется 3-6 пациентам на то же количество населения. Симптомы острой почечной недостаточности выявляются с частотой 0,8-4 случая на 100 тыс. детей и у 8-30% больных, находящихся в отделениях детской реанимации. Особенно высока распространенность ОПН у новорожденных.
Почечная недостаточность у детей
Причины
Этиологическая структура зависит от варианта почечной недостаточности и возраста ребенка. Среди младенческого и раннего детского возраста преобладают врожденные факторы, тогда как у школьников возрастает удельный вес приобретенных болезней почек и токсических влияний на клубочковый аппарат. Причины почечной недостаточности у детей подразделяются на несколько категорий:
- Врожденные заболевания почек. Чаще всего причиной патологии становятся наследственные обструктивные уропатии и тубулопатии, которые осложняются бактериальным воспалительным процессом и дисплазией почечной паренхимы. Среди пороков развития преобладают агенезия или гипоплазия, поликистоз, мегауретер.
- Приобретенные почечные болезни. Симптомы ренальной недостаточности наблюдаются при поражении клубочков (гломерулонефрите, волчаночном нефрите), канальцевом некрозе вследствие ишемии органа, воздействии нефротоксических ядов и лекарств. Реже патология вызвана поражением интерстиция и почечных сосудов.
- Расстройства гемодинамики. Острые формы заболевания возникают при уменьшении ОЦК, что сопровождается гипоперфузией клубочков. Это бывает при кровотечении, полиурии, многократной диарее и рвоте. Ишемия органа провоцируется снижением сердечного выброса и дилатацией периферических сосудов.
- Нарушения оттока мочи. Обструкция может происходить в любом отделе мочевыделительного тракта: мочеточниках, шейке мочевого пузыря, уретре. Патологические изменения обусловлены механическим сдавлением почечных лоханок большим количеством жидкости. Обструкция возможна при МКБ, опухоли, травме.
Патогенез
В зависимости от причин развития патологические процессы при ОПН вызваны разными механизмами: ишемией ренальной паренхимы, активацией шунтов в юкстамедуллярной зоне, токсическим поражением клубочков и эпителия канальцев, острой обструкцией мочевыводящего тракта. Возникающие изменения вначале носят обратимый характер и при устранении провоцирующих факторов функции нефронов полностью восстанавливаются.
При ХПН механизм повреждения не зависит от первопричины синдрома. При утрате большого количества функционирующих нефронов в оставшихся клубочках начинаются компенсаторные процессы: изменение диаметра афферентных и эфферентных артериол, нарушение целостности базальной мембраны, повышение гидростатического давления. В результате усугубляется внутриклубочковая гипертензия, а клетки начинают синтезировать провоспалительные цитокины.
Классификация
Почечная недостаточность делится на 2 большие группы: острая, для которой характерны условно обратимые процессы без первичной гибели нефронов, и хроническая, характеризующаяся постепенным снижением процента функционирующих клубочков. С учетом причины ОПН бывает преренальной, ренальной и постренальной. В детской нефрологии для оценки степени поражения используют педиатрическую классификацию RIFLE, которая включает 5 стадий:
- Риск. Скорость клубочковой фильтрации (СКФ) снижается на 25-50%, а объем мочи составляет менее 0,5 мл/кг/час в течение минимум 8 часов.
- Повреждение. СКФ уменьшается на 50-75% от возрастной нормы, а сниженный уровень мочевыделения сохраняется не менее 16 часов.
- Недостаточность. Характеризуется падением СКФ более, чем на 75%, или абсолютным значением менее 35 мл/мин/1,73 м2. Диурез снижается до 0,3 мл/кг за час на протяжении суток и дольше.
- Потеря. Диагностируется, если у ребенка сохраняются симптомы ОПН более 3 недель.
- Терминальная стадия. Соответствует хронической болезни почек (ХБП), когда клинические проявления патологии длятся дольше 3 месяцев.
Симптомы
ОПН у детей
В клинической картине острой формы почечной недостаточности выделяют 4 фазы. На начальном этапе специфические симптомы отсутствуют, но есть признаки основного заболевания или кратковременного провоцирующего фактора (кровотечение, обезвоживание). Беспокоят тошнота, повышенная утомляемость, снижение аппетита, но дети, особенно младшего возраста, редко предъявляют жалобы.
Затем наступает олигоанурическая стадия, когда количество выделяемой за сутки мочи намного меньше возрастной нормы. Вследствие метаболических изменений у детей возникает диарея и рвота, наблюдается патологическая сонливость и угнетение сознания. Отмечаются повышенная сухость кожи, беловатый налет на слизистых, изо рта ребенка пахнет аммиаком. Состояние длится в среднем 10-14 суток.
На диуретической стадии количество мочи компенсаторно увеличивается и может достигать 2-3 л в сутки. Постепенно нормализуется водно-электролитный баланс, исчезают симптомы ОПН, к ребенку возвращаются аппетит, интерес к подвижным играм. Полиурия сохраняется около 2 недель. Далее болезнь переходит в восстановительную фазу, продолжающуюся 6 месяцев и более.
ХПН у детей
Симптомы ХПН возникают постепенно, прогрессируют несколько месяцев или даже лет. Вначале появляется слабость, сухость кожи и слизистых, снижение успеваемости в школе. Ребенок постоянно хочет пить, но аппетит снижен. На поздних стадиях кожа становится бледной с желтоватым оттенком, заметны дрожание пальцев рук и мелкие судороги, нарастает апатия. Зачастую формируется анемия, вызванная нехваткой эритропоэтина.
Осложнения
ОПН значительно ухудшает состояние ребенка, а летальность колеблется от 3-5% при гемолитико-уремическом синдроме до 30-70% при сепсисе и полиорганной недостаточности. Даже при успешном лечении и восстановлении мочевыделительной функции возможны отдаленные последствия — у 10-25% детей формируется хроническая болезнь почек. ОПН опасна электролитными расстройствами (гиперкалиемия, гипокальциемия, гиперфосфатемия).
В терминальной стадии ХПН возникают желудочно-кишечные кровотечения, отек легких, перикардит и плеврит. Длительное течение заболевания сопровождается артериальной гипертензией, которая при отсутствии лечения развивается у детей любого возраста. Неврологические осложнения проявляются спутанностью сознания, периферической полинейропатией. Возможна остеодистрофия, из-за чего у ребенка наблюдается задержка роста и физического развития.
Диагностика
Обследованием занимается квалифицированный детский нефролог. При внешнем осмотре врач обращает внимание на состояние и цвет кожи, наличие «уремического» запаха, степень физического развития. Специалист собирает детальный анамнез и жалобы ребенка и/или его родителей. Для постановки диагноза и определения вида почечной недостаточности проводится ряд исследований:
- УЗИ почек. При ультразвуковом обследовании у детей выявляют симптомы основной патологии, вызвавшей нарушения, а при ХПН — еще и уменьшение толщины паренхимы («сморщенная почка»). Для исключения постренальной обструкции выполняется сонография мочеточников и мочевого пузыря. УЗДГ позволяет оценить состояние сосудов.
- Биопсия почки. Инвазивный диагностический метод рекомендован при неинформативности других исследований, при подозрении на системное заболевание, протекающее с поражением почек. Гистологический анализ биоптата показывает патогномоничные включения, особенности строения клубочкового аппарата.
- Исследование мочи. В общем анализе обычно находят протеинурию и микрогематурию. Для изучения концентрационной функции производится исследование по Зимницкому, для которого собирают суточный диурез. Чтобы исключить воспалительные процессы, показан анализ по Нечипоренко.
- Анализы крови. В гемограмме у детей с ХПН снижено число эритроцитов и концентрация гемоглобина, на поздних этапах падает количество тромбоцитов. В биохимическом анализе повышено содержание мочевины, креатинина, присутствуют биохимические симптомы метаболического ацидоза и расстройств электролитного обмена.
Лечение почечной недостаточности у детей
Для успешного купирования ОПН необходимо устранить ее причину. При преренальной форме мероприятия направлены на нормализацию ОЦК, при ренальной проводится этиопатогенетическая терапия почечной патологии, при постренальной нужно как можно быстрее ликвидировать обструкцию мочевыводящих путей. Для коррекции нарушений водно-электролитного обмена назначаются солевые растворы, диуретики. При ХПН лечение включает несколько групп препаратов:
- Гипотензивные средства. Наиболее часто применяют ингибиторы АПФ, которые не только предупреждают симптомы вторичной гипертонии, но и замедляют развитие почечной недостаточности. Как альтернативу используют блокаторы кальциевых каналов, бета-блокаторы.
- Препараты эритропоэтина. Эффективны при анемии, которая возникает у ребенка уже на ранних стадиях болезни. В основном принимаются медикаменты ЭПО второго поколения с пролонгированным эффектом.
- Железосодержащие лекарства. Для устранения абсолютного или функционального дефицита этого микроэлемента назначают детские пероральные формы (в виде сиропов), а старшим детям дают таблетированные варианты. По показаниям комбинируют препараты с фолиевой кислотой.
- Витамин D. Холекальциферол предупреждает почечную остеодистрофию и применяется для ее лечения. Во время курса врачи регулярно контролируют уровни кальция и фосфора в крови.
У детей почечная недостаточность зачастую сопровождается белково-энергетическим голоданием, поэтому важно обеспечить адекватное по калорийности и сбалансированности питание. При ХПН четко регламентируют содержание белка и соли в диете. Если пациент находится в тяжелом состоянии, потребности в основных питательных веществах и энергии восполняются растворами глюкозы, специальными препаратами для парентерального питания.
В тяжелых случаях ОПН и терминальном периоде ХПН рекомендована заместительная почечная терапия. У новорожденных и младенцев чаще выполняется перитонеальный диализ, детям постарше преимущественно назначают классический гемодиализ. Показаниями к неотложному началу диализной терапии служат длительная олигоанурия, резкое повышение мочевины и креатинина, уремическая энцефалопатия.
Прогноз и профилактика
При ОПН вероятность полного выздоровления высока при раннем начале терапии. При ХПН прогноз менее благоприятный, поскольку гибель нефронов у детей необратима, но методы современной нефрологии замедляют прогрессирование болезни и улучшают качество жизни ребенка. Для профилактики почечной недостаточности необходимо выявлять и лечить заболевания мочевыделительной системы, проводить медико-генетическое консультирование и антенатальную охрану плода.
Источник
