Синдром тернера и заместительная терапия

ДАД — диастолическое артериальное давление
ЖАС — жесткость артериальной стенки
ИМТ — индекс массы тела
КМР — кардиометаболический риск
КПОК — комбинированные пероральные контрацептивы
ЛПВП — липопротеиды высокой плотности
ЛПНП — липопротеиды низкой плотности
МГТ — менопаузальная гормональная терапия
МПКТ — минеральная плотность костной ткани
ОТ — окружность талии
ПАС — прирост амплитуды сигнала
ПВ — пульсовая волна
САД — систолическое артериальное давление
ССО — сердечно-сосудистые осложнения
ССС — сердечно-сосудистая система
СФ — сдвиг фаз
СШТ — синдром Шерешевского—Тернера
ТГ — триглицериды
ФР — фактор риска
ФЭ — функция эндотелия
ХС — холестерин
AIp — индекс аугментации
AIp75 — нормализованный для пульса 75 уд/мин индекс аугментации
RI — индекс отражения
SI — индекс жесткости
Синдром Шерешевского—Тернера (СШТ) — одна из наиболее частых аномалий половых хромосом, которая встречается у 1 из 2000 новорожденных девочек [1—3]. СШТ является результатом частичной или полной моносомии по X-хромосоме. При СШТ встречаются самые разные пороки развития органов и систем, в первую очередь сердечно-сосудистой, нарушаются физиологические процессы, что приводит к уменьшению ожидаемой продолжительности жизни больных [4].
Отклонения в анатомии грудной аорты и ее ветвей, клапанные пороки выявляются у 65—70% больных с СШТ [5]. Помимо пороков развития сердечно-сосудистой системы (ССС), отмечается повышение риска развития приобретенных сердечно-сосудистой заболеваний (ССЗ), таких как артериальная гипертония (АГ), тромбоэмболические осложнения, острый инфаркт миокарда и мозговой инсульт, одной из частых причин смерти больных с СШТ является разрыв аорты [6].
Развитию тяжелых сердечно-сосудистой осложнений (ССО) способствуют типичные для СШТ нарушения метаболизма, такие как предрасположенность к сахарному диабету, ожирению, дислипидемии [7]. В связи с высокой распространенностью гипогонадизма более 90% женщин с СШТ показана так называемая менопаузальная гормональная терапия (МГТ). Стратификация риска развития ССО у больных с СШТ на современном этапе затруднена, так как очевидно, что простой перенос тактики, применяемой в общей популяции, на пациенток с СШТ некорректен. Нет также однозначного мнения относительно назначения МГТ больным гипогонадизмом. Отсутствие единой научно обоснованной позиции не позволяет унифицировать стратегию ведения больных с СШТ [8, 9]. Таким образом, оценка распространенности факторов риска (ФР) развития ССО и возможного влияния МГТ на риск развития ССО при СШТ представляется актуальной проблемой здравоохранения.
Работа проведена В ФГБУ «Эндокринологический научный центр» Минздрава России на базе отделения эндокринной гинекологии. За 2010—2012 гг. в рамках проспективного исследования обследована 41 пациентка с СШТ в возрасте от 14 до 35 лет, средний возраст составил 25,1±6,5 года. У всех больных диагноз подтвержден результатами кариотипирования.
Проведено открытое проспективное обсервационное сравнительное исследование с оценкой влияния МГТ или комбинированных пероральных контрацептивов (КПОК) на частоту возникновения ФР развития ССО у больных с СШТ. Критериями включения в исследования служили возраст от 14 до 35 лет, установленный диагноз СШТ. Наличие другой патологии эндокринной системы не являлось фактором исключения, а рассматривалось как дополнительный параметр исследования. Критерием исключения служило хирургическое лечение по поводу коарктации аорты или другого порока сердца. Протокол клинического исследования одобрен локальным этическим комитетом ФГБУ ЭНЦ Минздрава России. Исследование проводили в соответствии с положениями, изложенными в Хельсинкской декларации Всемирной медицинской ассоциации и принципами надлежащей клинической практики (GCP).
В зависимости от статуса по проведению МГТ/ КПОК больные разделены на 4 группы: 1-я — 7 пациенток, не получающих МГТ (средний возраст 25,4±3,2 года); 2-я группа — 12 пациенток, получающих в рамках МГТ 1 мг эстрадиола (средний возраст 23,7±4,4 года); 3-я группа — 14 женщин, получающих в рамках МГТ 2 мг эстрадиола (средний возраст 26,2±5,3 года); 4-я группа — 8 пациенток, получающих КПОК (средний возраст 28,4±3,6 года).
Пациентки 2-й группы получали дидрогестерон + эстрадиол (фемостон 1/10), пациентки 3-й группы — один из двух препаратов: фемостон 2/10, либо левоноргестрел + эстрадиол, пациентки 4-й группы — этинилэстрадиол + дезогестрел.
Все пациентки проходили динамическое обследование, в ходе которого регистрировались все нежелательные явления. На рисунке представлено распределение обследованных больных по кариотипу.
 Распределения 41 больной по кариотипу.
Распределения 41 больной по кариотипу.
Кроме того, в рамках ретроспективной части исследования проведен анализ амбулаторных карт 100 больных с СШТ, которым проведены обследование и лечение в отделении эндокринной гинекологии ЭНЦ МЗ РФ с 2000 по 2010 г. Отбирали карты больных, у которых была доступна информация, соответствующая следующим минимальным требованиям: кариотип, результаты эхокардиографии (ЭхоКГ), проведение и вид КПОК/МГТ. Возраст больных с СШТ ретроспективной когорты составил от 15 до 46 лет (32±8,7 года).
В лаборатории ФГБУ ЭНЦ проводили гормональный и биохимический анализы крови, а также оценку свертывающей системы крови. Ультразвуковое исследование органов малого таза, молочных желез и щитовидной железы выполняли на ультразвуковых аппаратах Hewlett Packard Image Point (США), Agilent Son’s 4500 (CША) с использованием линейного трансабдоминального и вагинального датчиков с частотой 3,5 МГц по общепринятой методике. Минеральную плотность костной ткани (МПКТ) определяли на денситометре фирмы «Lunar» (США) методом двухэнергетической рентгеновской абсорбциометрии. Оценивали МПКТ поясничных позвонков (совокупная МПКТ в регионе LII—LIV) и проксимальном отделе бедренной кости (в области Wards). Результаты исследования выражали в абсолютном содержании (в граммах) костной ткани и сравнивали с референсной базой данных, представленной фирмой-производителем. Полученные значения МПКТ выражали в граммах на 1 см². В целях оценки полученных показателей использовали Z-критерий и Т-критерий для данного хронологического возраста и пола. Значение Z— и Т-критерия менее 2,5 расценивали как остеопороз, а при в диапазоне от –1,0 до –2,5 — как остеопения.
Электрокардиограмму регистрировали с помощью 12-канального электрокардиографа Philips Page Writer Xli (Голандия).
Исследование структур и функции сердца, которое основано на регистрации отраженных импульсных сигналов ультразвука, генерируемых эхокардиографическим датчиком частотой 3,5 МГц, проводили на ультразвуковом аппарате Philips iE-33, дуплексное исследование сосудов шеи — на приборе LOGIQ-9. Данный метод объединяет возможности В-режима (визуальная интерпретация физического состояния сосудов и прилежащих к ним тканей) и допплероскопии (исследование качественных и количественных характеристик кровотока)*.
Статистическую обработку полученных данных проводили с использованием пакета прикладных программ Statistica 6. Качественные признаки сравнивали между собой с помощью критерия χ2 и точного критерия Фишера. Для каждого количественного признака выполняли оценку нормальности распределения с помощью критерия Шапиро—Уилка. Для изучения межгрупповых различий нормально распределенных признаков оценивали дисперсии распределений признаков в двух сравниваемых группах по критерию Левена. Непараметрические признаки описаны в виде медианы и интерквартильного размаха — Mе (25-й процентиль; 75-й процентиль). Для оценки межгрупповых различий использовали критерий U Манна—Уитни. Для анализа зависимостей между выборками найдены коэффициенты ранговой корреляции Спирмена.
Оценка параметров риска развития ССЗ и /или СД (кардиометаболического риска — КМР). При анализе распространенности ФР развития ССО у больных проспективной и ретроспективной когорт получены следующие результаты (табл. 1). Согласно приведенным данным у больных обеих когорт выявлена умеренная атерогенная дислипидемия, что проявлялось в повышении уровня общего ХС до 5,2 и 5,4 ммоль/л соответственно в проспективной и ретроспективной когортах больных.
 Таблица 1. Параметры КМР в проспективной и в ретроспективной когортах больных (n=104)* Примечание. * — при сравнении значения всех параметров между когортами p>0,05. ИМТ — индекс массы тела; ОТ — окружность талии; САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление; ХС — холестерин; ЛПНП — липопротеиды низкой плотности; ЛПВП — липопротеиды высокой плотности; ТГ — триглицериды.
Таблица 1. Параметры КМР в проспективной и в ретроспективной когортах больных (n=104)* Примечание. * — при сравнении значения всех параметров между когортами p>0,05. ИМТ — индекс массы тела; ОТ — окружность талии; САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление; ХС — холестерин; ЛПНП — липопротеиды низкой плотности; ЛПВП — липопротеиды высокой плотности; ТГ — триглицериды.
Для оценки влияния МГТ на параметры КМР мы сравнили их значения в группах больных в зависимости от типа получаемой МГТ. Результаты представлены в табл. 2.
 Таблица 2. Параметры КМР в группах больных проспективной когорты в зависимости от статуса МГТ (n=41) Примечание. Различия статистически значимы при сравнении с уровнем в 1-й группе (* — p<0,05; ** — p<0,01).
Таблица 2. Параметры КМР в группах больных проспективной когорты в зависимости от статуса МГТ (n=41) Примечание. Различия статистически значимы при сравнении с уровнем в 1-й группе (* — p<0,05; ** — p<0,01).
На фоне МГТ или КПОК отмечалось статистически значимое снижение ДАД. В группе больных, не получавших МГТ или КПОК, констатирована диастолическая АГ (ДАД 92±6,3 мм рт.ст.), в группе больных, получавших МГТ с дозой эстрадиола 1 мг/сут, ДАД составляло 83,6±5,1 мм рт.ст., в группе МГТ с дозой эстрадиола 2 мг/сут — 80,8±4,8 мм рт.ст., и наконец, в группе КПОК — 88,2±7,4 мм рт.ст. (p<0,05 при сравнении значений во 2-й и 3-й группах со значениями в 1-й группе), во всех этих группах ДАД оставалось в пределах нормы.
Кроме того, выявлено статистически значимое повышение уровня ЛПВП — 0,6±0,09 ммоль/л в 1-й группе против 1,5±0,2, 1,7±0,35 и 1,3±0,27 во 2, 3 и 4-й группах соответственно. Выявлена сильная положительная корреляция между дозой эстрогена в МГТ и уровнем ЛПВП (r=0,74).
Таким образом, МГТ в зависимости от дозы (по содержанию эстрадиола) повышает уровень протективных в отношении риска развития атеросклероза ЛПВП, не влияя на уровень общего ХС. МГТ и КПОК способствуют снижению уровня ДАД на 13% (p<0,01) у больных с СШТ.
Оценка состояния сосудистой стенки у больных с СШТ. Эту оценку проводили с помощью аппарата Ангиоскан. Оценивали следующие параметры контурного анализа ПВ: индекс жесткости (SI), который отражает жесткость аорты; индекс отражения (RI) — параметр, характеризующий тонус мелких резистивных артерий; индекс аугментации, служащий индикатором состояния ССС (AIp), нормализованный для пульса 75 уд/мин индекс аугментации (AIp75), в окклюзионной пробе определяли прирост амплитуды сигнала (ПАС) и сдвиг фаз (СФ). Параметры оценки состояния сосудистой стенки с помощью аппарата Ангиоскан приведены в табл. 3. Значение практически всех параметров контурного анализа в группах больных, получавших МГТ или КПОК, оказалось ниже, чем в группе больных, не получавших гормональной терапии.
 Таблица 1. Параметры КМР в проспективной и в ретроспективной когортах больных (n=104)* Примечание. * — при сравнении значения всех параметров между когортами p>0,05. ИМТ — индекс массы тела; ОТ — окружность талии; САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление; ХС — холестерин; ЛПНП — липопротеиды низкой плотности; ЛПВП — липопротеиды высокой плотности; ТГ — триглицериды.
Таблица 1. Параметры КМР в проспективной и в ретроспективной когортах больных (n=104)* Примечание. * — при сравнении значения всех параметров между когортами p>0,05. ИМТ — индекс массы тела; ОТ — окружность талии; САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление; ХС — холестерин; ЛПНП — липопротеиды низкой плотности; ЛПВП — липопротеиды высокой плотности; ТГ — триглицериды.
Кроме того, выполняли окклюзионную пробу, во время которой пережимали артерии на руке испытуемого на несколько минут. В ответ на окклюзию после освобождения конечности регистрировали выраженность дилатации сосудов. Полученные данные характеризовали Ф.Э. Результаты окклюзионной пробы представлены в табл. 4. В группах МГТ с дозой эстрадиола 1 или 2 мг отмечалось приблизительно одинаковое статистически значимое повышение амплитуды сигнала по сравнению с 1-й и 4-й группами. СФ оказался сниженным в группах больных, не получавших МГТ и получавших КПОК, однако у больных 4-й группы этот параметр оказался статистически значимо выше, чем в 1-й.
 Таблица 1. Параметры КМР в проспективной и в ретроспективной когортах больных (n=104)* Примечание. * — при сравнении значения всех параметров между когортами p>0,05. ИМТ — индекс массы тела; ОТ — окружность талии; САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление; ХС — холестерин; ЛПНП — липопротеиды низкой плотности; ЛПВП — липопротеиды высокой плотности; ТГ — триглицериды.
Таблица 1. Параметры КМР в проспективной и в ретроспективной когортах больных (n=104)* Примечание. * — при сравнении значения всех параметров между когортами p>0,05. ИМТ — индекс массы тела; ОТ — окружность талии; САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление; ХС — холестерин; ЛПНП — липопротеиды низкой плотности; ЛПВП — липопротеиды высокой плотности; ТГ — триглицериды.
При анализе параметров контурного анализа ПВ у больных, не получавших МГТ, наблюдались отчетливые признаки нарушения структуры функционирования артериальной системы, выявляемые в 100% случаев. Повышение SI свидетельствовало о снижении эластичности аорты. МГТ в зависимости от дозы у 77% больных приводила к снижению SI. Он оказался повышенным в 1-й и 4-й группах.
В окклюзионной пробе оценивали Ф.Э. Выявлено ее нарушение у больных в 1-й и 4-й группах, что проявилось в уменьшенном расширении артериол в ответ на прирост кровотока, а также в уменьшении СФ. МГТ способствовала зависимой от дозы нормализации перечисленных показателей, и это свидетельствует, что применение МГТ способствует улучшению ФЭ.
Целью нашей работы явились изучение распространенности врожденных аномалий сердца и распространенности ФР развития ССО у больных с СШТ, а также оценка влияния на эти параметры разных режимов МГТ.
Мы провели оценку распространенности общепринятых ФР развития атеросклеротических заболеваний у больных с СШТ. В обеих когортах больных значения таких параметров, как ИМТ, ОТ, САД, не выходили за пределы нормы, при этом статистически значимо не различались между группами больных; в то же время у больных обеих когорт выявлялось умеренное повышение уровня общего ХС в основном за счет ЛПНП, хотя уровень ЛПВП оказался в пределах нормы, выявлялось повышение уровня Т.Г. Гиперхолестеринемия — один из основных независимых ФР прогрессирования атеросклероза. Таким образом, в нашем исследовании подтверждено наличие атерогенной дислипидемии у молодых больных с СШТ из российской популяции. Наши данный согласуются с результатами, полученным у больных, проживающих в других регионах.
Международные и отечественные рекомендации постулируют необходимость МГТ, начиная с 12 лет, с постепенным увеличением содержания эстрогенного компонента [1, 11]. Мы провели оценку влияния режима МГТ на наличие и выраженность различных ФР развития ССО у больных с СШТ. На фоне МГТ или КПОК отмечалось статистически значимое снижение ДАД по сравнению с больными 1-й группы. АГ страдают приблизительно 50% больных с СШТ [12, 13]. В нашем исследовании больным не выполнялось суточного мониторирования АД и, возможно, поэтому у большинства больных превышение пороговых нормальных уровней АД не зарегистрировано. Тем не менее даже при измерении АД методом Короткова у больных 1-й группы (не получавших МГТ) оказалось возможным констатировать диастолическую А.Г. Вне зависимости от дозы эстрогенного компонента МГТ приводила к статистически значимому снижению ДАД, чего не наблюдалось на фоне КПОК.
Кроме того, МГТ в зависимости от дозы приводила к статистически значимому повышению уровня ЛПВП. Если средний уровень ЛПВП у больных проспективной когорты не отличался от нормы, то при анализе по группам выраженность атерогенной дислипидемии оказалась максимальной в группе больных, не получавших МГТ. Таким образом, МГТ с учетом антиатерогенных свойств ЛПВП способна предотвратить развитие атеросклероза и улучшить прогноз у больных с СШТ.
В работе С. Gravholt и соавт. [14] МГТ сопровождалась уменьшением толерантности к углеводам, однако, как и в нашем исследовании, приводила к снижению ДАД. J. Ostberg и соавт. [15] показали зависимое от дозы влияние МГТ на параметры метаболизма у больных с СШТ: с увеличением дозы эстрадиола (максимально 4 мг) уровень ЛПВП увеличивался, а концентрация глюкозы умеренно снижалась. Эти результаты согласуются с полученными нами данными.
При оценке параметров контурного анализа ПВ у больных, не получавших МГТ, наблюдались отчетливые признаки нарушения структуры функционирования артериальной системы. Повышение SI свидетельствует о снижении эластичности аорты. У больных 1-й группы (без МГТ) и 4-й группы (КПОК) отмечались статистически значимо (p<0,05) большие значения этого показателя, чем у больных 2-й и 3-й групп (получавших МГТ). Это наряду со снижением SI свидетельствует о повышении эластичности артерий на фоне МГТ.
RI оказался повышенным в 1-й и 4-й группах, при этом в указанных группах статистически значимо (p<0,05) отличался от более низких и нормальных уровней в группах больных, получавших МГТ в дозе 1 мг (2-я группа) или 2 мг (3-я группа) эстрогена. Таким образом, для больных с СШТ характерно повышение тонуса периферических артерий и артериол, МГТ способствует снижению их тонуса.
При окклюзионной пробе выявлено нарушение ФЭ у больных в 1-й и 4-й группах, что проявилось в уменьшенном расширении артериол в ответ на увеличение кровотока, а также в уменьшении С.Ф. При этом МГТ способствовала нормализации данных показателей (статистически значимое отличие от параметров в 1-й и 2-й группах, причем изменения зависели от дозы), что согласуется с данными зарубежных исследователей. В исследовании М. Elsheikh и соавт. [16] проведение МГТ у больных с СШТ сопровождалось снижением AIp, характеризующего жесткость аорты. С учетом того, что в этом исследовании изменений параметров липидного состава крови или АД под действием МГТ не наблюдалось, можно сделать вывод о снижении жесткости артериальной стенки (ЖАС) под действием МГТ через другие механизмы, в частности улучшение Ф.Э. Данное предположение подтверждается полученными нами данными.
Уменьшение ЖАС, склонности артериол к спазму и улучшение ФЭ у больных с СШТ, получавших МГТ, соответствует полученным нами результатам и данным литературы о снижении ряда ФР, поражающих стенку артерий, под действием МГТ. По нашим данным, МГТ приводит к снижению уровня ДАД и повышению уровня протективных ЛПВП.
Таким образом, МГТ, благоприятно влияя на ФЭ сосудов и снижая выраженность атерогенной дислипидемии, потенциально способствует уменьшению риска развития ССО у больных с СШТ.
Работа выполнена при поддержке гранта РНФ № 17−75−30035.
Авторы заявляют об отсутствии конфликта интересов.
Источник
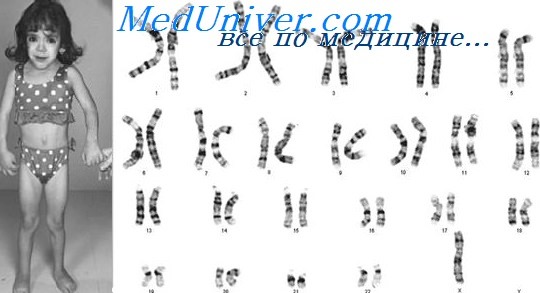
Синдром Тернера: причины, диагностика, лечениеЭтиология и встречаемость синдрома Тернера. Синдром Тернера — панэтническое заболевание, вызываемое полным или частичным отсутствием второй Х-хромосомы у женщин. Его встречаемость составляет от 1 на 2000 до 1 на 5000 среди живорожденных девочек. Около 50% случаев синдрома Тернера вызваны кариотипом 45,Х, 25% — структурной аномалией второй Х-хромосомы, и 25% — мозаицизмом 45,Х. Моногамия по Х-хромосоме может возникать при нарушении перехода половой хромосомы в одну из гамет или при потере половой хромосомы в зиготе или раннем эмбрионе. Наиболее частая причина кариотипа 45,Х — нарушение передачи отцовской половой хромосомы в гамету; 70-80% пациенток с кариотипом 45,Х оплодотворены сперматозоидом с недостающей половой хромосомой. Вероятная причина мозаицизма 45,Х — утрата половой хромосомы в клетке раннего эмбриона. Патогенез синдрома ТернераМеханизм формирования клинической картины синдрома Тернера у девочек с моносомей по Х-хромосоме мало понятен. Х-хромосома содержит множество локусов, не подвергающихся инактивации, некоторые из них необходимы для функционирования яичников и женской фертильности. Хотя для развития овоцита достаточно одной Х-хромосомы, для их функционирования необходимы две Х-хромосомы. Следовательно, при отсутствии второй Х-хромосомы, овоциты у плодов и новорожденных с синдромом Тернера деградируют, а их яичники атрофируются в полоски соединительной ткани. Генетическая основа других признаков синдрома Тернера, например, кистозной гигромы, лимфоотека, широкой грудной клетки, пороков сердца, аномалий почек и нейросенсорной тугоухости, не определена, но, возможно, отражает гаплонедостаточность одного или более Х-сцепленных генов, в норме не подвергающихся инактивации у женщин. Фенотип и развитие синдрома ТернераХотя плоды с кариотипом 45,Х встречаются при 1-2% всех беременностей, заканчиваются живорожденным младенцем с кариотипом 45,Х менее 1% родов. Учитывая мягкий фенотип, наблюдаемый у пациенток с синдромом Тернера, обращает на себя внимание столь высокий показатель выкидышей, указывая на важность второй половой хромосомы для внутриутробного выживания. Все пациенты с синдромом Тернера имеют низкий рост, и более 90% —дисгенезию яичников. Дисгенезия яичников достаточно выраженная, поэтому только у 10-20% пациентов пубертат развивается самостоятельно (молочные железы и лобковое оволосение) и только 2-5% имеют самостоятельные менструации. Большинство больных также имеет физические аномалии, например, складчатую шею, низкий рост волос на затылке, широкую грудную клетку, пороки сердца и почек, нейросенсорную тугоухость, отеки кистей и стоп и диспластичные ногти. Почти у 50% пациенток отмечают двустворчатый аортальный клапан, и, следовательно, повышенный риск расширения и расслаивающей аневризмы корня аорты; почти у 60% имеются аномалии почек и повышенный риск дисфункции почек.
У большинства пациенток интеллектуальное развитие нормальное. Если есть интеллектуальная задержка, обычно обнаруживается структурная аномалия Х-хромосомы. Больные с синдромом Тернера обычно стеснительны и замкнуты (см. главу 6). Помимо осложнений, вызванных врожденными аномалиями, у женщин с синдромом Тернера чаще встречаются остеопоротические переломы костей, тиреоидит, сахарный диабет I и II типа, колиты и заболевания сердечно-сосудистой системы. Причины сахарного диабета, нарушений щитовидной железы и колитов неясны. Вероятно, в основном за остеопороз и повышенную встречаемость атеросклероза, ишемических заболеваний сердца и инсульты ответственна эстрогенная недостаточность, хотя возможно, что сахарный диабет усиливает влияние недостатка эстрогенов на сердечно-сосудистую систему. Особенности фенотипических проявлений синдрома Тернера: Лечение синдрома ТернераЕсли рост пациентки с синдромом Тернера отстает ниже 5-го процентиля, обычно назначают соматотропный гормон, применяемый до достижения костного возраста, соответствующего 15 годам. В среднем это лечение дает прибавку роста в 10 см; прибавка роста тем меньше, чем позже начато лечение гормоном роста. Параллельная терапия эстрогенами уменьшает эффективность гормона роста. Терапию эстрогенами обычно начинают в возрасте 14-15 лет, для обеспечения развития вторичных половых признаков и снижения риска остеопороза. Прогестерон для вызывания менструаций добавляют к лечению либо во время первого вагинального кровотечения, либо на втором году терапии эстрогенами. Кроме того, медицинская помощь обычно включает следующие виды диагностики: эхокардиографию с целью оценки расширения корня аорты и клапанных заболеваний сердца, УЗИ почек для исключения врожденных аномалий и нагрузочный тест с глюкозой для выявления сахарного диабета. У пациенток с полной дисгенезией яичников не бывает спонтанных овуляций и беременности. Однако если позволяет состояние сердечно-сосудистой системы и почек, женщины с синдромом Тернера могут иметь детей в случае подсадки оплодотворенной яйцеклетки. Риски наследования синдрома ТернераСиндром Тернера не связан с возрастом матери или отца. Хотя описано несколько случаев повторения в семье, обычно синдром Тернера спорадический, и эмпирический риск повторения при будущих беременностях не превышает общепопуляционного. Если синдром Тернера заподозрен на основе УЗИ плода, например, выявлена кистозная гигрома, диагноз следует подтвердить кариотипированием ворсин хориона или амниоцитов. Среди спонтанно менструирующих женщин с синдром Тернера описано несколько случаев наступления беременности. У одного из трех родившихся детей отмечены врожденные аномалии, такие как врожденные пороки сердца, синдром Дауна и spina bifida. Очевидно, повышенный риск врожденных аномалий может быть следствием выборочного смещения в публикациях, так как беременность редко встречается при синдроме Тернера. Если повышенный риск аномалий — реальный факт, то его причина неизвестна. Пример синдрома Тернера. Л.В., девушка 14 лет, направлена в клинику эндокринологии для обследования по поводу отсутствия вторичных половых признаков (менструаций и развития молочных желез). Хотя Л.В. родилась с небольшой массой тела, она была полностью здорова и имела нормальный интеллект. Другие члены семьи аналогичных проблем не имели. Данные обследования оказались нормальными, за исключением низкого роста, I стадии полового развития по Таннеру и широкой грудной клетки с широко расположенными сосками. После краткого обсуждения возможных причин задержки роста и полового развития врач назначил определение уровня фолликулостимулирующего гормона, гормона роста (соматотропина), анализ костного возраста и анализ хромосом. Эти тесты показали нормальный уровень гормона роста, повышение уровня фолликулостимулирующего гормона и аномальный кариотип (45,Х). Врач дал заключение, что у девочки синдром Тернера. Ей был назначен гормон роста; годом позже она начала терапию эстрогенами и прогестероном для стимуляции развития вторичных половых признаков. – Также рекомендуем “Пигментная ксеродерма: причины, диагностика, лечение” Оглавление темы “Генетика”:
|
Источник