Синдром вискотта олдрича клинический случай
11 мая 2018г.
Аннотация. Целью данной работы является привлечение внимания педиатров к синдрому Вискотта-Олдрича, а также представление ярких проявлений данной патологии на примере клинического случая. Ранее выявление таких пациентов и оперативное направление их на трансплантацию красного костного мозга значительно увеличивает продолжительность жизни. Особенностью представленного клинического наблюдения, кроме чрезвычайной редкости заболевания, является отсутствие тяжелых системных инфекций, спленомегалии, а также относительная эффективность паллиативной терапии, что может быть связано с вариантом генетического дефекта. Несмотря на позднее проведение иммунореконструктивной терапии, отмечается благоприятный исход при этом потенциально смертельном заболевании. На протяжении двухлетнего периода наблюдения состояние ребенка остается стабильным
Ключевые слова: первичные иммунодефициты, синдром Вискотта-Олдрича, иммунореконструктивное лечение
Синдром Вискотта-Олдрича (WAS) – редкий, Х-сцепленный врожденный иммунодефицит, характеризующийся микротромбоцитопенией, экземой, высоким риском развития опухолей и аутоиммунных заболеваний [1, 2, 3, 4, 5]. Частота встречаемости синдрома Вискотта-Олдрича в мире достигает 1:1000000 родившихся живыми мальчиков [3]. Молекулярный дефект заключается в отсутствии протеина WASP, кодируемого геном, локализованным на коротком плече Х-хромосомы (Xp.11.4-p11.21.) [3]. WASP экспрессируется во всех гемопоэтических клеточных линиях и имеет пять функциональных доменов, связанных с полимеризацией актина и внутриклеточной трансдукцией сигнала [2, 3]. Отсутствие или уменьшение белка WASP способствует дефектному образованию тромбоцитов, а также компрометирует функции клеток, участвующих в реакциях врожденного и адаптивного иммунитета, что приводит к прогрессирующему иммунодефициту [2, 3, 4]. Известно не менее 300 уникальных мутаций в гене WASP, установлены отдельные корреляции между типом мутации и клиническими проявлениями болезни [2].
Заболевание обычно манифестирует в первые месяцы жизни с геморрагического синдрома. Тромбоцитопения и уменьшение размеров тромбоцитов обусловлены их чрезмерным разрушением, аномальным метаболизмом и неэффективным тромбоцитопоэзом [3, 4, 5]. Экзема развивается у 60-80% больных и может напоминать себорейный или пеленочный дерматит [1, 3, 5].
Тяжесть иммунных нарушений у детей с синдромом Вискотта-Олдрича вариабельна. В большинстве случаев формируется комбинированный иммунодефицит с недостаточностью Т-лимфоцитов. Уровень IgG, как правило не изменен, IgM – умеренно снижен, показатели IgA и IgE – повышены [3, 5]. Следствием иммунодефицита являются упорные, часто повторяющиеся инфекции. Характерны отиты, синуситы, пневмонии, диарея, менингиты, а также инфекции, обусловленные H. simplex, CMV, EBV [1, 3, 5]. У 40-70% больных развиваются аутоиммунные заболевания (гломерулонефрит, васкулит, ауоиммунная гемолитическая анемия, тромбоцитопения), у 13-22% – злокачественные новообразования (лейкоз, лимфома, EBV-ассоциированная опухоль головного мозга) [1, 3]. Средняя продолжительность жизни детей с синдромом Вискотта-Олдрича составляет 6,5 лет. Ведущей причиной смерти становятся инфекции (59%), кровотечения (21%), опухоли (12%) [3, 5].
Единственным методом лечения, восстанавливающим иммунологический и гематологический дефекты, является трансплантация гемопоэтических стволовых клеток (ТГСК) с общей выживаемостью 84% детей. В недавних исследованиях показана высокая эффективность генной терапии с использованием лентивирусов при отсутствии HLA-совместимого донора [3]. Паллиативная терапия включает заместительное введение внутривенных иммуноглобулинов, а также профилактическое применение антимикробных и противовирусных средств [3, 5].
Приводим клинический случай мальчика с синдромом Вискотта-Олдрича. Больной Р., 01.09.2010 года рождения, от 8 беременности, 2-х преждевременных родов, в 33-34 недели. Масса при рождении – 2530 г., длина тела – 49 см, ОША 7-8 баллов.
В возрасте 1 мес. 20 дней манифестировал геморрагический синдром, госпитализирован в детскую краевую клиническую больницу (ДККБ) г. Ставрополя, где находился с диагнозом: внутриутробная инфекция неуточненной этиологии: пневмония, кардит, анемия 2 степени, тромбоцитопения, токсический гепатоз с холестазом.
С 2-х месяцев – экзема, повторные эпизоды гемоколита, геморрагическая сыпь, гнойный средний отит. В ОАК – снижение уровня тромбоцитов до 50*109/л. В 6-ти месячном возрасте у пациента заподозрен синдром Вискотта-Олдрича. С целью уточнения диагноза рекомендовано генетическое обследование в отделении клинической иммунологии и ревматологии РДКБ (г. Москва), что не было выполнено.
В течение последующих лет ребенок неоднократно госпитализировался в отделение гематологии и онкологии ДККБ в связи с обострением геморрагического синдрома. Наблюдалась стойкая тромбоцитопения до 9*109/л, снижение уровня Hb до 80 г/л, показателей IgM до 0,57 г/л., уровня CD3+CD4+ до 0,45*109/л, увеличение общего IgE до 219 МЕ/мл. В миелограмме – без существенных изменений (недифференцированные бласты – 2,5%, пунктат богат клеточными элементами, полиморфный, красный росток несколько расширен, мегакариоцитарный росток расширен, свободно лежащие единичные тромбоциты). У ребенка регистрировались повторные гнойные отиты, синуситы, низкие показатели тромбоцитов, однако отмечался удовлетворительный результат от паллиативной терапии (внутривенные иммуноглобулины, глюкокортикостероиды, интрон А).
Генетическое исследование выполнено лишь в апреле 2014 г. в НМИЦ ДГОИ им. Дмитрия Рогачева (г. Москва). Обнаружена мутация в 1 экзоне гена WAS c.100 CGA>TGA, приводящая к замене аргинина на стоп-кодон Arg34X в гомизиготном состоянии (X-хромосома). Таким образом, диагноз синдрома Вискотта- Олдрича был подтвержден. Единственным продуктивным методом лечения могла стать ТГСК. По результатам HLA-типирования обнаружен полностью совместимый сиблинг, явившийся братом больного. В апреле 2015, в возрасте 4 г. 7 мес., мальчику успешно проведена трансплантация гемопоэтических стволовых клеток.
Через 2 года после проведения ТГСК состояние стабильное, признаков хронической реакции трансплантат против хозяина (РТПХ) нет. Общее состояние удовлетворительное, физическое и психомоторное развитие соответствуют возрастной норме. Болеет ОРВИ не более 3 раз в год, вакцинируется по индивидуальному календарю. В ОАК, биохимии крови отклонений от нормы не выявлено. Основные показатели иммунного статуса в пределах нормы.
Особенностью данного клинического наблюдения, кроме чрезвычайной редкости заболевания, является отсутствие тяжелых системных инфекций, спленомегалии, а также относительная эффективность паллиативной терапии, что может быть связано с вариантом генетического дефекта. Несмотря на позднее проведение иммунореконструктивной терапии, отмечается благоприятный исход при этом потенциально смертельном заболевании. На протяжении двухлетнего периода наблюдения состояние ребенка остается стабильным.
Список литературы
1. Diffuse Large B Cell Lymphoma in Wiskott-Aldrich Syndrome: A Case Report and Review of Literature / J. Senapati [et al] // Indian J. Hematol. Blood Transfus. – 2014. – Vol. 30. – №1. – P. 309–313. doi: 10.1007/s12288-014-0377-1
2. Novel WASP mutation in a patient with Wiskott–Aldrich syndrome: Case report and review of the literature / M. Eghbali [et al] // Allergol Immunopathol (Madr). – 2016. – Vol. 44. – P. 450-454. . doi: 10.1016/j.aller.2015.11.002.
3. Recent advances in understanding the pathophysiology of Wiskott–Aldrich syndrome / M. Bosticardo M. [et al] // Blood. – 2009. – Vol. 113. – P. 6288–6295. doi: 10.1182/blood-2008-12-115253.
4. Sokolic R. Assessment of immature platelet fraction in the diagnosis of Wiskott–Aldrich syndrome / R. Sokolic, N. Oden, F. Candotti // Immunological Reviews. – 2015. – № 3. – Р. 49. doi: 10.3389/fped.2015.00049.©
5. Thrasher A.J. WASP. A key immunological multitasker / A.J. Thrasher, S.O. Burns // Nat. Rev. Immunol. – 2010. – №10. – P. 182–192. doi: 10.1038/nri2724.
6. Водовозова Э.В., Голубева М.В., Доронин В.Ф. и др. Руководство по практическим умениям педиатра: учебное пособие для системы последипломного профессионального образования врачей- педиатров. – Ростов-на-Дону, 2010. Сер. Высшее медицинское образование (3-е издание, стереотипное). – 574 с.
Источник
Больной А.Б. (муж.п.) родился 10.4.1973 г.
ДИАГНОЗ: СИНДРОМ ВИСКОТТА-ОЛДРИЧА.
Анамнез жизни и болезни. Родился в установленный срок, масса тела 3200 г, рост 51 см. Был обвит пуповиной. В первые дни жизни наблюдались петехиальные кровоизлияния в кожу лба, появление которых связывали с родами. С третьей недели жизни у ребенка периодически развивались ринит, отиты, двусторонний конъюктивит, диарея с примесью крови. На третьем месяце жизни появилась экзема. Периодически у мальчика возникали крупные синие пятна, кровоизлияния в кожу при небольших травмах, которые распределялись по всему телу.
В возрасте 6 месяцев был госпитализирован по поводу мокнущей чешуйчатой экземы. До 6 месяца жизни возникающие инфекции лечили антибиотиками. Экзему лечили кортикостероидными мазями. Лечебный эффект был слабый. Был назначен декортин per os, который уменьшил зуд, но не дал ожидаемого эффекта . При осмотре ребенка были отмечены: пастозный внешний вид, наличие асимметричных мелких и крупных высыпаний коричнево-красного цвета на лице и конечностях, склонность к генерализации малых пятен; сильный дерматит в паховой области, выраженный дерматит с чешуйчатыми желтыми корочками на голове; местами петехиальные кровоизлияния в кожу головы и тела; крупная гематома в области коленного сустава.
Печень и селезенка не увеличены, миндалины немного гипертрофированы. Прививка БЦЖ была сделана в первые дни жизни. На месте прививки рубца нет.
Учитывая общее состояние и частые инфекции, был рекомендован трансфер-фактор. После дачи препарата общее состояние ребенка существенно улучшилось. Реакции непереносимости не наблюдались. На третий день лечения экзематозный зуд прошел, во многих местах экзематозные поражения кожи исчезли. После полного курса лечения трансфер-фактором экзема была полностью вылечена.
Семейный анамнез. Пациент- второй ребенок в семье. Родители здоровы. Брат 7 лет здоров, отклонений в иммунном статусе не имел. Семейный анамнез без особенностей. Указания на частые заболевания отсутствуют.
Данные лабораторных исследований пациента. Микробиологические исследования мазков кожи, зева, уха, заднепроходного отверстия выявили стафилококки, стрептококки группы А, Е.coli, бактерии родов Klebsiella, Proteus, а также грибы рода Candida.
Анализ крови свидетельствовал об анемии (эритроцитов 3,2 × 1012 /л, гемоглобин 90 г/л, ретикулоцитов 12 %), тромбоцитопении (12 /л). В отдельных анализах крови выявлялась эозинофилия и гранулоцитопения. Общий белок в крови составлял 5,1 – 6,7 %, IgG – 680 мг%, IgМ – 69 мг%, IgА – 84 мг%. У пациента группа крови 0(I), Rh+. Титр изогемагглютининов составлял: анти-А1- 1:1, анти – А2- 1:4, анти – В – 1:4; титр антител к Е.coli (смешанному антигену) был равен 1:80; Klebsiella – 1:320; антитела к Proteus, Pseudomonas aeruginosa, Staphylococcus aureus – отсутствовали. Отсутствовали кожные реакции на туберкулин, Candida albicans, стрептокиназу – стрептодорназу. Все члены семьи с этими веществами показали выраженные реакции. После лечения трансфер-фактором наблюдалась кожная реакция на Candida albicans, и Staphylococcus aureus. В РБТЛ наблюдался слабый (17-23% нормы) ответ на ФГА и специфические антигены. У членов семьи реакция была нормальная.
Период ремиссии, который длился около года, сменился новой вспышкой заболевания. У ребенка развились стойкие инфекции, которые и привели к гибели. Ниже приведено фото больного с синдромом Вискотта-Олдрича.
Источник
Синдром Вискотта-Олдрича – это иммунодефицитное наследственное заболевание, которое характеризуется экземой, геморрагическим синдромом, высокой вероятностью развития опухолей, инфекционных и аутоиммунных болезней. Ключевыми симптомами являются длительные кровотечения при травмах, частые носовые кровотечения и гематомы, рецидивирующие бактериальные, грибковые и вирусные инфекции, кожная сыпь, провоцирующая зуд и чувство жжения. Диагноз устанавливается на основе клинико-анамнестического обследования, результатов общего анализа крови, исследования иммунитета и биогенетического теста. Лечение включает трансплантацию гемопоэтических клеток и паллиативную терапию.
Общие сведения
Как синоним синдрома Вискотта-Олдрича (СВО) используется термин синдром экземы-тромбоцитопении-иммунодефицита, а также аббревиатура WAS, происходящая от английского «Wiskott-Aldrich syndrome». Заболевание названо по фамилиям американских исследователей. Э. Вискотт в 1937 году описал клинические случаи тромбоцитопении в сочетании с экземой и рецидивирующими инфекциями у мальчиков из одной семьи, в которой все девочки были здоровы. Р. Олдрич в конце 80-х и начале 90-х годов установил, что патология является наследственной и сцепленной с полом, определил расположение гена с дефектом. Распространенность синдрома крайне низкая – 1 случай на 1 млн. новорожденных мальчиков. Отмечены единичные случаи данной болезни у девочек, что связано с недостаточной инактивацией дефектной хромосомы X.

Синдром Вискотта-Олдрича
Причины
СВО – наследственная болезнь. Причиной ее развития является мутация в гене WAS, ответственном за синтез белка иммунных клеток. Ген локализован в X-хромосоме в регионе Хр11.23. В настоящее время выявлено более 300 вариантов мутаций гена WAS, которые приводят к развитию X-сцепленной тромбоцитопении, чаще всего – к микротромбоцитопении и нейтропении. От характера мутации зависит степень проявления симптомов – от снижения уровня тромбоцитов, выявляемого только лабораторным методом, до тяжелой формы синдрома Вискотта-Олдрича с присоединением онкозаболевания крови, аутоиммунной патологии.
Тип наследования синдрома – X-сцепленный рецессивный. У мужчин имеется лишь одна X-хромосома, если она оказывается дефектной, заболевание проявляется. Отец передает мутацию всем дочерям, сыновья получают нормальную хромосому Y. Женщины имеют две X-хромосомы. Дефектный ген, расположенный в одной из них, инактивируется, так как является рецессивным. Синдром не проявляется, но женщины остаются носительницами мутации и с вероятностью 50% могут передать ее детям обоих полов (сыновья болеют, дочери – носительницы).
Патогенез
Генетический дефект проявляется нарушением синтеза белка WASP, который присутствует в клетках системы иммунитета. Он производится гемопоэтическими стволовыми клетками – самыми ранними предшественниками элементов крови, расположенными в красном костном мозге. WASP участвует в перестройке и восстановлении цитоскелета, формировании иммунологических синаптических передач, внутриклеточном транспорте белков. При его отсутствии или недостаточном производстве образуются дефектные тромбоциты, патологически изменяются функции клеток, отвечающих за реакции врожденного и адаптивного иммунитета.
Ухудшается процесс свертывания крови, развивается прогрессирующий иммунодефицит. Степень выраженности клинических проявлений синдрома частично зависит от клеточной концентрации WASP, а его количество определяется локализацией и типом мутации. Симптомы вариативны, у большинства пациентов диагностируется болезнь слабой и умеренной тяжести. Тяжелое течение встречается редко.
Классификация
Единая классификация синдрома Вискотта-Олдрича отсутствует. В клинической практике распространено использование балльной системы, в основе которой лежит утверждение, что у всех больных имеется тромбоцитопения, у большей части – иммунодефицитное состояние, а остальные симптомы могут отсутствовать. С учетом этих параметров выделяют три формы заболевания:
- Легкий СВО. Характеризуется отсутствием экземы или легкой, поддающейся лечению экземой, редкими инфекциями. Оценивается в 1-2 балла.
- Классический среднетяжелый СВО. Проявляется рецидивами инфекционных болезней и экземы, умеренными аутоиммунными реакциями. Соответствует 3-м и 4-м баллам.
- Классический тяжелый СВО. Пациенты страдают от рекуррентных инфекций, тяжелой экземы, аутоиммунных патологий и злокачественных новообразований. Паллиативное лечение малоэффективно. Выраженность синдрома – 5 баллов.
Симптомы
Клинические признаки тромбоцитопении обнаруживаются с рождения. У младенцев на поверхности кожи видна петехиальная сыпь – небольшие красные пятна, образовавшиеся по причине разрыва мелких кровеносных сосудов и медленной сворачиваемости крови. Выявляются экхимозы – подкожные кровоизлияния пурпурного и голубовато-черного диаметром от 3 мм. Стул содержит примеси крови. Наблюдаются частые кровотечения из носа, кровавая рвота. Снижение свертываемости крови отмечается при инвазивных медицинских процедурах, например, после забора крови для анализа.
Экзема обычно проявляется с детства, но может отсутствовать на протяжении всей жизни. У малышей до года она схожа с себорейным или пеленочным дерматитом. Возможно развитие генерализованной формы, при которой поражается кожа всего тела ребенка, или локальной, характеризующейся высыпаниями на конечностях. В старшем возрасте экзема нередко ограничивается областями в локтевых сгибах, вокруг кистей рук, под коленными суставами, в складках кожи шеи. У некоторых больных сыпь отсутствует или проявляется крайне редко и слабо, не требует лечения.
Иммунологические нарушения характерны для большинства пациентов. Снижение защитных функций организма приводит к частым отитам, пневмониям, кандидозам, менингитам, энтероколиту, герпесу и кожным инфекционным патологиям. Развиваются хронические формы инфекций с частыми рецидивами, эффективность стандартной терапии низкая. У взрослых возникают аутоиммунные заболевания – больные подвержены гемолитической анемии, васкулитам, тромбоцитопенической пурпуре, воспалительным поражениям почек и кишечника. При классическом тяжелом СВО у подростков и молодых людей формируются злокачественные новообразования, наиболее частым вариантом является неходжкинская лимфома.
Осложнения
При СВО отмечается высокий риск летального исхода. В 59% случаев причиной смерти становятся инфекционные заболевания. Среди них преобладают тяжелые пневмонии и сепсис (заражение крови). На фоне инфекций усиливается геморрагический синдром, а интенсивное расчесывание зон, пораженных экземой, провоцирует развитие грибковых и бактериальных болезней кожи. Около 21% больных погибают в результате внутренних кровотечений. Жизнеугрожающими являются внутричерепные, желудочно-кишечные и внутрилегочные кровоизлияния. У 12% пациентов причиной ранней гибели становится онкопатология, наиболее распространены лимфомы и лейкозы.
Диагностика
Симптомы тромбоцитопении у детей с синдромом Вискотта-Олдрича проявляются сразу после рождения, но диагноз подтверждается на первом-втором году жизни. Первичная диагностика осуществляется неонатологами и педиатрами при участии генетиков. В ходе дифференциальной диагностики исключается тромбоцитопеническая пурпура, наследственная тромбоцитопения с талассемией и X-сцепленный врожденный дискератоз. Проводится различение с лейкоплакией, атрезией слезных желез, анемией и ненаследственной тромбоцитопенией. Комплексное обследование включает следующие процедуры:
- Опрос. В беседе с родителями выясняется наличие тромбоцитопений и тяжелых рецидивирующих инфекций среди родственников мужского пола, смертей мальчиков в раннем возрасте из-за инфекций, кровоизлияний и рака крови. Жалобы включают кожную сыпь, кровотечения, частые инфекционные болезни.
- Физикальное обследование. При осмотре отмечаются петехии, экхимозы, проявления атопического дерматита, инфекционные очаги на коже. Методом пальпации определяется увеличение размеров лимфоузлов, печени и селезенки (лимфаденопатия, гепатоспленомегалия).
- Лабораторные исследования. Анализы крови являются наиболее информативными методами диагностики. Выполняется ряд тестов:
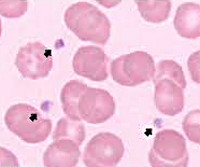
- Клинический анализ крови. Диагностируется тромбоцитопения с уменьшением размеров тромбоцитов. Этот признак уникален, позволяет дифференцировать СВО с другими видами тромбоцитопений.
- Исследование иммунного статуса. С раннего возраста в иммунограмме обнаруживается лимфоцитопения с наиболее выраженным снижением количества CD8 лимфоцитов. Выявляется нарушение реакций гиперчувствительности замедленного типа, снижение показателя В-лимфоцитов, снижение уровня иммуноглобулинов M и G, повышение концентрации иммуноглобулинов A и E.
- Исследование WASP. Экспрессия белка определяется в клеточных культурах. Результат позволяет с большой вероятностью подтвердить диагноз и составить прогноз заболевания. Полное отсутствие производства WASP отмечается при тяжелых формах синдрома.
- Молекулярно-генетический анализ. Обнаружение мутации гена WAS выполняется методом ПЦР с последующим секвенированием продуктов реакции. Наличие дефектного гена подтверждает предполагаемый диагноз. В отдельных случаях характер мутации учитывается при составлении прогноза.
Лечение синдрома Вискотта-Олдрича
Терапия проводится методом трансплантации гемопоэтических стволовых клеток или костного мозга. Пересадка биоматериала здорового человека позволяет полностью устранить гематологический и иммунологический дефекты. При подборе гистосовместимого донора эффективность такого лечения достигает 84-90%. До внедрения трансплантации ГСК в медицинскую практику большинство пациентов доживали лишь до 6-6,5 лет.
Дополнительно назначается паллиативная терапия, которая представлена внутривенным введением иммуноглобулина, профилактическим применением противовирусных и противомикробных лекарств. При выраженном геморрагическом синдроме может быть проведена спленэктомия – хирургическое удаление селезенки. После процедуры отмечается увеличение количества и размера тромбоцитов. При острых бактериальных инфекциях показано лечение антибиотиками широкого спектра действия.
К новым разработкам в лечении СВО относится генная терапия с использованием лентивирусов. Суть метода заключается в заборе стволовых аутологичных клеток у пациента, последующей коррекции генетического дефекта в этих клетках с применением лентивирусного вектора и введении модифицированного материала в организм. В процессе терапии осуществляется уничтожение клеток дефектной иммунной системы. Проводятся экспериментальные исследования данного метода, получены сообщения о его высокой эффективности.
Прогноз и профилактика
Современные методы лечения позволили значительно увеличить продолжительность и повысить качество жизни больных. При комплексном подходе к лечению прогноз благоприятный. Профилактика синдрома невозможна, поскольку заболевание является наследственным. Для расчета вероятности рождения больного ребенка необходимо медико-генетическое консультирование супружеских пар из группы риска. Для предупреждения осложнений рекомендуется строго соблюдать правила гигиены, исключить контакты с инфекционными больными, избегать травматизации, использовать специальные гипоаллергенные средства для ухода за кожей ребенка, придерживаться диеты, исключающей попадание аллергенов с пищей.
Источник
