Третьей ступенью лечения хронического болевого синдрома
ПРО ПАЛЛИАТИВ использует cookie для статистики и аналитики, чтобы сделать сайт максимально удобным. Оставаясь на сайте, вы подтверждаете свое согласие на использование файлов cookie.
Содержание
Терапия слабой боли — I ступень ВОЗ
Терапия умеренной боли — II ступень лестницы обезболивания ВОЗ
Терапия сильной боли — III ступень лестницы обезболивания ВОЗ
Представляем фрагмент брошюры для врачей «Обезболивание в паллиативной помощи. Практическое руководство для врача», подготовленной благотворительным фондом «Вера». Полная версия брошюры доступна для скачивания по ссылке.
Терапия слабой боли — I ступень лестницы обезболивания ВОЗ
- В каждом конкретном случае необходимо соотносить возможные риски с пользой.
- Парацетамол может быть назначен всем пациентам, если он эффективен и к нему нет противопоказаний; парацетамол усиливает действие опиоидов, но гепатотоксичен.
- При деменции препарат выбора для обезболивания — парацетамол, в случае его неэффективности пациента переводят на морфин (НПВС и трамадол не рекомендуются).
- НПВС показаны при боли, имеющей в своем патогенезе воспалительный компонент (например, при болях в костях). НПВС высокоэффективны, но обладают серьезными побочными эффектами: способствуют образованию язв ЖКТ, усиливают почечную, печеночную недостаточность, повышают риск развития бронхоспазма, гипертонии, инфаркта миокарда и инсульта (особенно у пожилых пациентов).
- Пациенты, получающие глюкокортикоиды, уже находятся в группе высокого риска развития осложнений со стороны ЖКТ; одновременный прием аспирина также значительно повышает риск кровотечения.
- Пациенты, получающие паллиативную помощь, могут иметь недиагностированную почечную недостаточность, прогрессирующую в ходе лечения, в связи с чем необходим мониторинг функции почек; НПВС при этом следует использовать с осторожностью.
- Новые НПВС, селективно ингибирующие циклооксигеназу-2 (ЦОГ-2), могут применяться один раз в день, что позволяет снизить общий объем потребляемых препаратов.
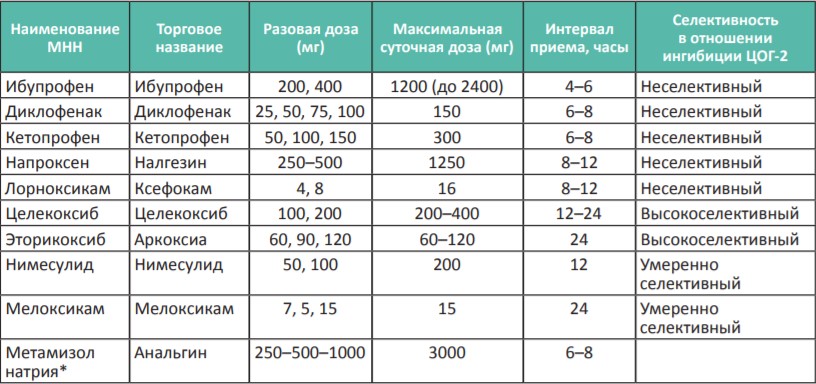
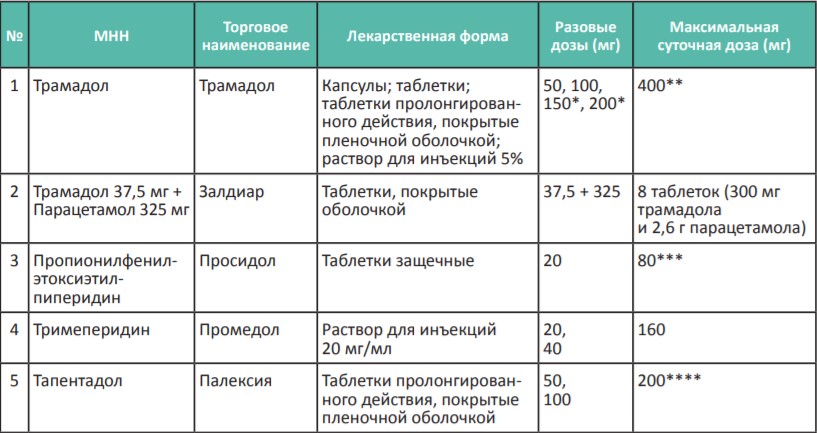
Таблица 1. Нестероидные противовоспалительные препараты для терапии слабой боли (I ступень лестницы обезболивания ВОЗ)
* Анальгин (метамизол натрия) — нет однозначных данных об отнесении данного препарата к НПВС, его назначают при непереносимости других НПВС и парацетамола, не следует сочетать с другими НПВС в течение длительного времени.
Терапия умеренной боли — II ступень лестницы обезболивания ВОЗ
В качестве второй ступени лестницы обезболивания ВОЗ рекомендует кодеин в дозе 30–60 мг 4 раза в день, назначае мый одновременно с парацетамолом. В России нет кодеина в дозировках, необходимых для лечения умеренной боли. Поэтому основным слабым опиоидным анальгетиком является трамадол или трамадол в сочетании с парацетамолом. Максимальная суточная доза трамадола составляет 400 мг, у пациентов старше 65 лет — 300 мг. К слабым опиоидам также относятся отечественные препараты: тримеперидин (промедол) и пропионилфенилэтоксиэтилпиперидин (просидол), которые в 2–3 раза слабее морфина. С 2018 года для клинического применения появился новый опиоидный анальгетик тапентадол (палексия), который также в 2–3 раза слабее морфина и назначается для терапии умеренной боли в дозах 50–200 мг/сут.

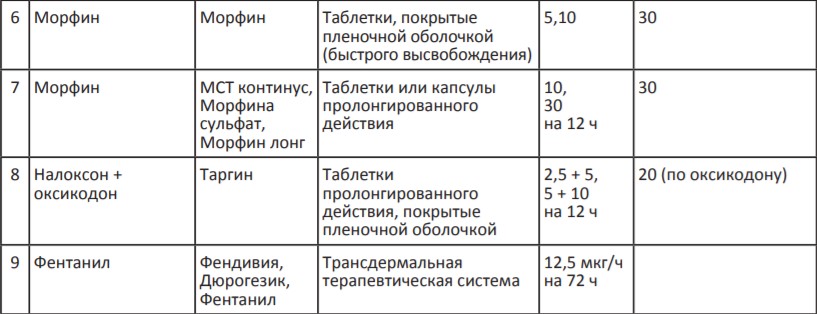
Таблица 2. Опиоидные анальгетики для терапии умеренной боли (II ступень лестницы обезболивания ВОЗ)
* 150, 200 мг только для таблеток трамадола продленного действия.
** Для пациентов старше 65 лет максимальная суточная доза трамадола 300 мг.
*** При умеренной боли рекомендуется не превышать разовую дозу 20 мг и суточную дозу 80 мг, хотя при сильной боли препарат может использоваться в более высоких дозах (см. Таблицу 3).
**** Для умеренной боли максимальная суточная доза тапентадола до 200 мг, тогда как при сильной боли она составляет 600 мг (см. Таблицу 3).
Комментарии
- Доказано, что из-за генетических особенностей метаболизма у 8–10% людей трамадол не эффективен, но может задерживаться в организме, вызывая тошноту, заторможенность и т.п.
- Трамадол и тапентадол нельзя сочетать с антидепрессанами из-за опасности возникновения серотонинового синдрома.
- При плохой переносимости трамадола следует назначать более сильные опиоиды: просидол до 80 мг/сут, тапентадол до 200 мг/сут. Либо можно сразу назначить сильные опиоиды в низких дозах: морфин быстрого или замедленного высвобождения в таблетках или капсулах (от 10 до 30 мг/сут), налоксон+оксикодон в таблетках замедленного высвобождения (5–20 мг/сут по оксикодоу) или ТТС фентанила 12,5 мкг/ч, если пациент не может проглотить таблетку (см. Таблицу 2 и 3).
- Эффективность трамадола следует признать недостаточной, если его разовая доза 100 мг (в капсулах или таблетках быстрого высвобождения) действует менее 4–6 часов на фоне приема НПВС и других адъювантных средств. Длительность действия трамадола в таблетках пролонгированного действия 100 мг и 200 мг должна быть не меньше 12 часов.
- При недостаточной эффективности трамадола следует переходить на обезболивание более сильными опиоидными анальгетиками. Превышать суточную дозу трамадола 400 мг (300 мг у пожилых пациентов) нецелесообразно.
- Как правило, после неэффективности 400 мг трамадола стартовая доза перорального морфина продленного действия составляет 60 мг/сут (1 таблетка 30 мг — 2 раза в сутки), ТТС фентанила 25 мкг/час, налоксон+оксикодон в таблетках продленного действия 40 мг/сут по оксикодону (по 20 мг — 2 раза в сутки), тапентадола 150–200 мг/сут.
Терапия сильной боли — III ступень лестницы обезболивания ВОЗ
В России для терапии сильной хронической боли применяются сильные опиоидные анальгетики, которые представлены в Таблице 3. Возможно назначение четырех неинвазивных препаратов: морфин быстрого и замедленного высвобождения (капсулы и таблетки), комбинированный препарат налоксон+оксикодон, ТТС фентанила и тапентадол.
Важно
Внимание! Предельно допустимое количество наркотического препарата, разрешенное к выписке на 1 рецепт, определено Приложением 1 Приказа МЗ РФ № 1175н
Изменения в порядке назначения и оформления рецептурных бланков на наркотические лекарственные препаратыПрофессор Василий Падалкин – об актуальных нормативных актах, регламентирующих применение наркотических обезболивающих, и изменениях в них
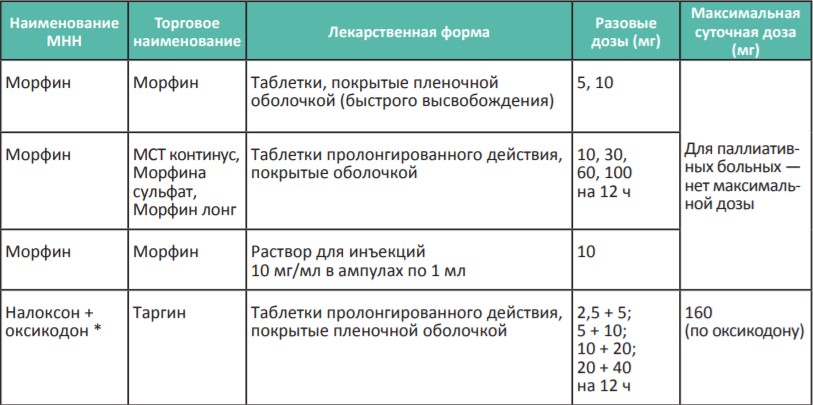
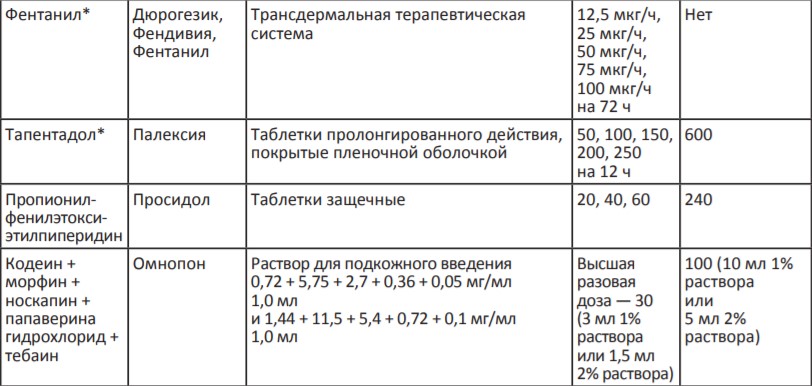
Таблица 3. Опиоидные анальгетики для терапии сильной боли (III ступень лестницы обезболивания ВОЗ)
*Налоксон + оксикодон, тапентадол и ТТС фентанила выписываются на рецептурном бланке формы N148-1/у-88.
Читайте дальше: «Нейропатическая боль»
Горячая линия помощи неизлечимо больным людям
Если вам или вашим близким срочно необходимо обезболивание, помощь хосписа, консультация по уходу или поддержка психолога.
8-800-700-84-36
Круглосуточно, бесплатно
Портал «Про паллиатив» — крупнейший информационный проект в стране, посвященный помощи неизлечимо больным людям и их родным Мы помогаем родственникам тяжелобольных людей разобраться в том, как ухаживать за ними дома, как добиться поддержки от государства и как пережить расставание, а медикам — пополнять свои знания о паллиативной помощи.
Почему это важно
Источник
23 апреля 2019 г.
Просмотров: 1916
Согласно определению Международной ассоциации по изучению боли (IASP), к хронической относят боль, которая сохраняется более 3 месяцев. Это достаточно типичная ситуация для онкологического больного. При прогрессировании опухолевого процесса хроническая боль отягощает жизнь пациента и окружающих его людей, представляет серьезную медицинскую и социальную проблему. У онкологических пациентов болевые ощущения не являются временными или преходящими, в них нет биологической целесообразности, они не играют защитной роли. Возникшая у онкологического пациента боль ведет к дезадаптации, к ненормальному восприятию болевых импульсов и сопровождается различными нарушениями функции центральной нервной системы (ЦНС).
Клиническая картина болевого синдрома зависит от локализации очага поражения, патогенетического типа боли, индивидуального порога болевой чувствительности, предшествующего болевого опыта.
Этиология
Выделяют следующие основные причины хронической боли у онкологических больных:
- боль, вызванная самой опухолью (поражение костей, мягких тканей, кожи, внутренних органов, органов пищеварительной системы, окклюзия сосудов и др.);
- боль при осложнениях опухолевого процесса (патологический перелом, некроз, изъязвление, воспаление, инфицирование тканей и органов, тромбозы);
- боль при паранеопластических синдромах (артро-, нейро- и миопатии);
- боль как следствие астенизации (пролежни, трофические язвы, запор);
- боль, обусловленная противоопухолевым лечением:
- при осложнениях хирургического лечения рака (фантомная боль, боли при спайках, рубцах, отеках);
- при осложнениях химиотерапии (мукозиты, полинейропатия, генерализованная миалгия, асептический некроз, артралгии);
- при реакциях и осложнениях лучевой терапии (поражение кожи и слизистых оболочек, костей, фиброз, неврит, плексит, миелопатия и др.).
Типы боли и механизм их развития
Выделяют три патогенетических типа боли: ноцицептивный, нейропатический и психогенный. При ноцицептивном типе боли происходит раздражение специфических периферических болевых рецепторов (ноцицепторов), которые расположены во всех органах и тканях: в коже, слизистых оболочках, стенках полых органов, капсулах паренхиматозных органов, в костях и надкостнице.
Повреждения, сопровождающие опухоли, приводят к деструкции клеточных мембран, в результате этого запускается цепь гистохимических реакций с высвобождением тканевых альгогенов, к числу которых в настоящее время относят более 30 различных субстанций. Важнейшими из них принято считать простагландин Е2 (ПГЕ2), гистамин, серотонин и другие биоактивные вещества. В патологическом очаге также активны альгогены, поступающие из плазмы. К ним относятся брадикинин и каллидин. Как плазменные, так и тканевые альгогены взаимодействуют с соответствующими структурами на поверхности болевых рецепторов,резко повышая их чувствительность.
Особенность формирования ноцицептивной боли при онкологическом процессе — способность болевых рецепторов активироваться не только при взаимодействии с воспалительными альгогенами, но и при воздействии на них специфических опухолевых факторов, что способствует усилению потока болевых импульсов. При этом ноцицепторы взаимодействуют как с продуктами метаболизма опухолевых клеток, так и с факторами повреждения или воспаления тканей. На ноцицепторы при онкологической боли воздействуют внеклеточные ионы водорода Н+, эндотелин 1, интерлейкины разных типов и фактор некроза опухоли.
В результате этих разнообразных и частых воздействий генерируются болевые импульсы. По афферентным нервным волокнам болевой импульс поступает в задние рога спинного мозга, откуда по спиноталамическому тракту — в вышележащие отделы ЦНС, ядра таламуса. В дальнейшем вся сенсорная болевая информация поступает в нейроны серого вещества проекционных зон коры больших полушарий, где происходят ее обобщение, обработка и анализ (перцепция), после чего организм осознает боль и степень опасности произошедшего повреждения.
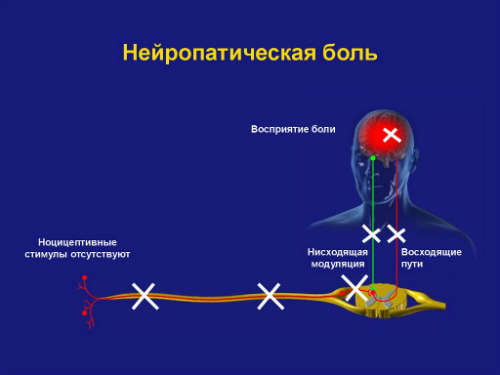
Нейропатическая боль имеет принципиальное отличие от ноцицептивной в механизмах формирования. Нейропатическая боль у онкологических пациентов может возникать как результат повреждений на разных уровнях нервной системы — от периферических нервов до нейронов коры головного мозга.
При повреждении головного или спинного мозга развивается центральная нейропатическая боль. При повреждениях структур периферической нервной системы (корешков спинномозговых нервов, нервных сплетений, периферических нервов) развивается периферическая нейропатическая боль.
Нейропатическая боль у онкологических пациентов часто гетерогенна, так как может иметь одновременно несколько причин, например, компрессия нервов (79%), деафферентационное повреждение нервов (16%), симпатически усиленная боль (5%). Симпатически усиленная боль — каузалгия, которая проявляется локальной вазодилатацией, гипертермией, повышенным потоотделением, трофическими расстройствами, извращенными сенсорными реакциями.
Опухоли, неудержимо разрастаясь в объеме, способны сдавливать структуры периферической нервной системы либо прорастать непосредственно в нервные сплетения, корешки и ветви периферических нервов, вызывая боль, нарушая сенсорную и моторную функции. Длительно существующая опухолевая компрессия, как и инфильтрация нервных структур, приводит к повреждению волокон нерва, вызывая дегенеративные изменения и деафферентацию (централизацию) боли.
Нейропатическая боль у онкологического больного может сопровождаться разнообразной неврологической симптоматикой, в которой присутствуют симптомы усиления чувствительности: жгучая или простреливающая боль высокой интенсивности, гиперестезия, гипералгезия, боль в ответ на неболевое раздражение (аллодиния), симптомы выпадения или ослабления сенсорных ощущений.
Психогенная боль возникает в ответ на индивидуальное эмоционально значимое переживание (депрессия, стресс, страх, истерия, бред, боли, галлюцинации и т.п.). Эти эмоциональные проявления могут вызывать изменения в симпато-адреналовой системе, системе выработки гипофизарных гормонов, что ведет к дисбалансу в работе висцеральных систем.
Лекарственная терапия хронической онкологической боли
Основным методом симптоматического лечения хронической боли онкологического генеза является системная фармакотерапия. Принципы медикаментозного лечения хронической боли включают следующие основные положения:
- подход к назначению лечения должен быть индивидуализированным;
- выбор препарата осуществляется в зависимости от патофизиологического типа и ее интенсивности;
- лечение осуществляется «по восходящей» в соответствии с «анальгетической лестницей ВОЗ»;
- преимущество отдается неинвазивным путям введения препаратов (пероральному и трансдермальному) и соответствующим лекарственным формам анальгетиков;
- препараты следует назначать в фиксированное время суток, «по часам», а не «по требованию»;
- препараты следует назначать в адекватных дозах;
- необходимо предотвращать развитие нежелательных эффектов и бороться с ними при их возникновении.
При лечении ноцицептивной боли ВОЗ рекомендует трехступенчатую схему использования анальгетиков («анальгетическую лестницу ВОЗ»). На первой ступени обезболивания, при наличии слабой боли, назначают препараты неопиоидного ряда, ненаркотические анальгетики (парацетамол,метамизол) или НПВП. При усилении боли и недостаточной эффективности ненаркотических анальгетиков и НПВП к ним добавляют сначала слабые (трамадол, кодеин, дигидрокодеин), а затем сильные опиоиды (бупренорфин, морфин, оксикодон, фентанил). Также при наличии тех или иных симптомов или при развитии нежелательных явлений от применения анальгетиков в терапию включаются адъювантные средства.
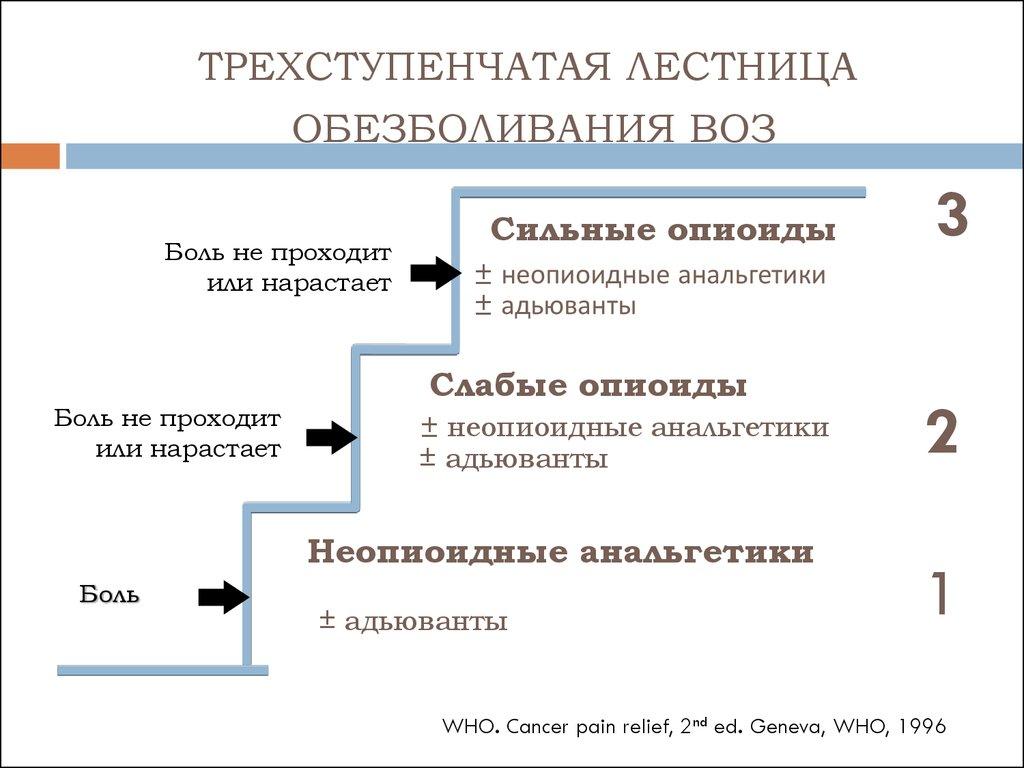
«Анальгетическая лестница ВОЗ»
1-я ступень НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
2-я ступень СЛАБЫЙ ОПИАТ + НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
3-я ступень СИЛЬНОДЕЙСТВУЮЩИЙ ОПИАТ + НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
В целом такая тактика лечения хронической боли позволяет достичь удовлетворительного обезболивания у 77-90% онкологических больных. В России зарегистрированы основные лекарственные препараты как из группы НПВП, так и из группы опиоидов для лечения хронической боли, рекомендуемые ВОЗ.
По мнению экспертов ВОЗ, для длительной терапии хронической боли анальгетики следует использовать в удобных для пациентов неинвазивных формах, предназначенных для введения: внутрь, трансбуккально, подъязычно, трансдермально, ректально.
Для длительной плановой терапии предпочтительны в лекарственные формы продленного действия (депо-формы).
К 1-й ступени «лестницы обезболивания» ВОЗ относят препараты из группы ненаркотических анальгетиков (парацетамол, метамизол) и препараты из группы НПВП (кеторолак, диклофенак, кетопрофен, лорноксикам, нимесулид, мелоксикам, целекоксиб).
Применение НПВП показано на всех этапах терапии боли у онкологических больных. У больных с опухолями и/или метастазами, поражающими мягкие ткани и кости, всегда развивается выраженное перифокальное воспаление. В начале 70-х годов ХХ века было установлено, что болеутоляющее, жаропонижающее и противовоспалительное действие НПВП обусловлено подавлением синтеза простагландинов. НПВП снижают продукцию простагландинов за счет ингибирования фермента циклооксигеназы (ЦОГ).

На сегодня выделяют три изоформы ЦОГ. Считают, что избирательное угнетение ЦОГ-2 приводит к подавлению воспаления и боли. В то же время сохранение активности ЦОГ-1 определяет репаративные процессы в желудке, кровоток в почках. Было отмечено, что парацетамол и метамизол слабо влияют на синтез простагландинов в периферических тканях, но подавляют продукцию простагландинов в ЦНС. В последние годы появились сведения о том, что в ЦНС имеется третий, отличный от первых двух тип ЦОГ, названный ЦОГ-3. Ингибирование ЦОГ-3 головного мозга сопровождается подавлением боли и снижением температуры тела при лихорадке.
Все НПВП могут вызывать осложнения со стороны желудочно-кишечного тракта (ЖКТ): диспепсию, язвы, кровотечения и перфорацию верхних и нижних отделов ЖКТ, железодефицитную анемию.
Все НПВП могут вызывать осложнения со стороны сердечно-сосудистой системы (ССС): дестабилизацию артериальной гипертензиии сердечной недостаточности, повышают риск «кардиоваскулярных катастроф» (инфаркт миокарда, ишемический инсульт) и летальности.
Все НПВП могут оказывать негативное влияние на функцию почек и печени (особенно при наличии заболеваний последних), а в ряде случаев вызывать серьезные нефро- и гепатотоксические реакции.
Препараты группы противопоказаны при эрозивно-язвенных поражениях желудочно-кишечного тракта (ЖКТ) в стадии обострения, состояниях гипокоагуляции (в том числе при гемофилии, геморрагическом диатезе, тромбоцитопении), при бронхиальной астме, тяжелой хронической сердечной недостаточности, гиповолемии, тяжелой почечной и печеночной недостаточности, состояниях, сопровождающихся гиперкалиемией, могут вызвать обострение и осложнения воспалительных заболеваний кишечника (ВЗК).
НПВП могут вызывать кожные реакции и бронхоспазм. Риск развития осложнений со стороны указанных органов и систем существенно отличается при использовании различных НПВП. Для предотвращения осложнений необходим учет факторов риска и выбор наиболее безопасного НПВП.
Для снижения риска развития НПВП гастропатии необходимо дополнительное назначение препаратов из группы ингибиторов протонной помпы и применение низких доз аспирина для снижения риска кардиоваскулярных осложнений. В настоящее время НПВП классифицируются по степени селективности ингибирующей активности в отношении разных изоформ ЦОГ.
В клинике «Медицина 24/7» работает круглосуточный хоспис для онкологических больных. Весь коллектив клиники работает на то, чтобы продлить жизнь человека и устранить болезненные симптомы. Наши врачи назначают и проводят паллиативное лечение для облегчения состояния пациента, а также подбирают наиболее подходящую схему обезболивания. Наши медсестры и санитарки готовы обеспечить достойный уход пациенту на терминальной стадии рака.
Литература:
- Исакова М.Е. Болевой синдром в онкологии. — М.: Практическая медицина, 2011. — 384 с.
- Каприн А.Д., Абузарова Г.Р., Хороненко В.Э. и др. Фармакотерапия хронического болевого синдрома у онкологических пациентов. Медицинская технология. — М.: МНИОИим. П.А. Герцена, 2015. — 48 с.
- Машфорт М.Л., Купер М.Г., Кохен М.Л. и др. Боль и аналгезия. Руководство для практикующих врачей / Перевод сангл. А.Н. Редькин; ред. рус. изд. Бунятян А.А., НасоновЕ.Л., Никода В.В. — М.: Литтерра, 2004. — 488 с.
- Новиков Г.А., Осипова Н.А. Лечение хронической боли онкологического генеза: учебное пособие. Москва. — 83 с.
- Новиков Г.А. Контроль симптомов в паллиативной медицине. — М.: ГЭОТАР-Медиа, 2013. — 248 с.
- Осипова Н.А., Абузарова Г.Р., Петрова В.В. Принципы клинического применения наркотических и ненаркотических аналгетических средств при острой и хронической боли. Методические указания. Практическое руководство для врачей. М., 2005. — 79 с.
- Штрибель Х.В. Терапия хронической боли. Практическое руководство / Пер. с нем.; ред. Осипова Н.А., ДаниловаА.Б., Осипова В.В. — М.: ГЭОТАР-Медиа, 2005. — 303 с.
- Ahmedzai S.H., Leppert W., Janecki M., Pakosz A., LomaxM., Duerr H., Hopp M.
- Long-term safety and efficacy of oxycodone/naloxoneprolonged-release tablets in patients with moderate-to-severechronic cancer pain. Support Care Cancer. 2015 Mar; 23 (3):823-30.
- Caraceni A., Hanks G., Kaasa S. et al. Use of opioid analgesicsin the treatment of cancer pain: evidence-basedrecommendations from the EAPC // Lancet Oncol. 2012 Feb;13 (2): e 58-68.
- Mystakidou K., Parpa E., Tsilika E. et al. Pain management ofcancer patients with transdermal fentanyl: a study of 1828 stepI, II, & III transfers. // J. Pain. 2004; 5: 119–13212. Skaer T.L. Transdermal opioids for cancer pain. // HealthQual. Life Outcomes. 2006 Mar 31; 4: 2413. World Health Organization. Cancer pain relief: with a guide toopioid availability. 2. Geneva: WHO; 1996.14. Zech D.F., Grond S., Lynch J., Hertel D., Lehmann K.A.Validation of World Health Organization guidelines forcancer pain relief: A 10-year prospective study. Pain. 1995;63: 65–76.
Источник: Научно-практический журнал «Паллиативная медицина и реабилитация» № 1. 2018.
Источник
