Гийена барре синдром патологическая анатомия
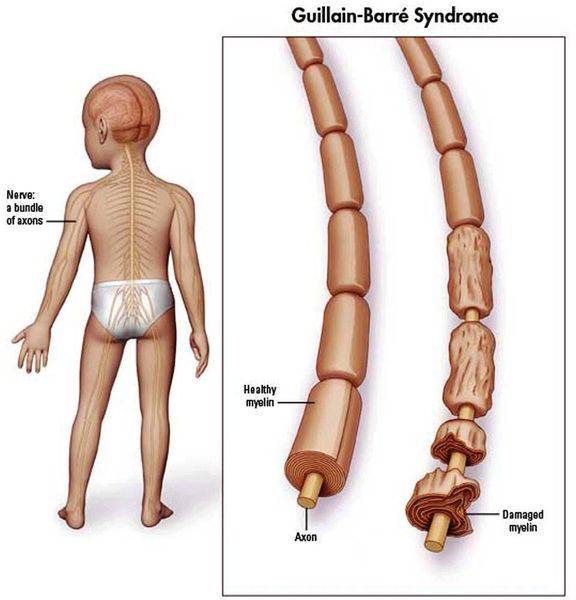
Синдром Гийена-Барре (СГБ) — острая воспалительная демиелинизирующая полирадикулоневропатия аутоиммунной этиологии. Характерный признак заболевания — периферические параличи и белково-клеточная диссоциация в ликворе (в большинстве случаев). Диагноз синдрома Гийена-Барре устанавливается при наличии нарастающей слабости и арефлексии в более чем 1 конечности. При этом следует исключить другие неврологические заболевания, сопровождающиеся периферическими парезами: полиомиелит, острый период стволового инсульта, токсические поражения ЦНС и др. Лечение пациентов с синдромом Гийена-Барре проводится в стационаре, т. к. больному может потребоваться ИВЛ.
Общие сведения
Синдром Гийена-Барре (СГБ) — острая демиелинизирующая воспалительная полиневропатия аутоиммунной этиологии. Характерный признак заболевания — периферические параличи и белково-клеточная диссоциация в ликворе (в большинстве случаев). В настоящее время в рамках СГБ выделяют четыре основных клинических варианта:
- классическая форма СГБ — острая воспалительная демиелинизирующая полирадикулоневропатия (до 90% случаев)
- аксональная форма СГБ — острая моторная аксональная невропатия. Характерный признак данной формы СГБ — изолированное поражение двигательных волокон. При острой моторно-сенсорной аксональной невропатии поражаются как двигательные, так и чувствительные волокна (до 15%)
- синдром Миллера-Фишера — форма СГБ, характеризующаяся офтальмоплегией, мозжечовой атаксией и арефлексией при слабовыраженных парезах (до 3%)
Помимо вышеуказанных форм синдрома Гийена-Барре, в последнее время выделяют еще несколько атипичных форм заболевания — острую сенсорную невропатию, острую пандизавтономию, острую краниальную полиневропатию, встречающиеся довольно редко.
Клиническая картина синдрома Гийена-Барре
Первыми проявлениями синдрома Гийена-Барре являются, как правило, мышечная слабость и/или сенсорные расстройства (чувство онемения, парестезии) в нижних конечностях, которые, спустя несколько часов (суток) распространяются на верхние конечности. В некоторых случаях заболевание манифестирует болями в мышцах конечностей и пояснично-крестцовой области. Очень редко первым проявлением становятся поражения ЧН (глазодвигательные расстройства, нарушение фонации и глотания). Степень двигательных нарушений при синдроме Гийена-Барре значительно варьируется — от минимальной мышечной слабости до тетраплегии. Парезы, как правило, симметричные и больше выражены в нижних конечностях.
Типична гипотония и существенное снижение (либо полное отсутствие) сухожильных рефлексов. В 30% случаев развивается дыхательная недостаточность. Расстройства поверхностной чувствительности проявляются в виде легкой или умеренной гипо- или гиперкинезии по полиневритическому типу. Приблизительно у половины пациентов наблюдаются расстройства глубокой чувствительности (иногда вплоть до полной ее утраты). Поражения ЧН, выявляемые у большинства больных, проявляются парезом мимических мышц и бульбарными нарушениями. Из вегетативных нарушений наиболее часто наблюдаются сердечные аритмии, артериальная гипертензия, расстройство потоотделения, нарушение функций ЖКТ и тазовых органов (задержка мочи).
Диагноз синдрома Гийена-Барре
При сборе анамнеза необходимо обратить внимание на наличие провоцирующих факторов, так как более чем в 80% случаев развитию СГБ предшествуют те или иные заболевания и состояния (перенесенные инфекции ЖКТ, верхних дыхательных путей, вакцинация, оперативные вмешательства, интоксикация, опухоль). Неврологическое обследование направлено на выявление и оценку выраженности основных симптомов синдрома Гийена-Барре — чувствительных, двигательных и вегетативных расстройств.
Необходимо проведение общеклинических исследований (общий анализ мочи, общий анализ крови), биохимического анализа крови (газовый состав крови, концентрация электролитов сыворотки), исследования ликвора, серологических исследований (при подозрении на инфекционную этиологию заболевания), а также электромиографию, результаты которой имеют принципиальное значение для подтверждения диагноза и определения формы СГБ. В тяжелых случаях заболевания (быстрое прогрессирование, бульбарные нарушения) следует проводить суточное мониторирование АД, ЭКГ, пульсовую оксиметрию и исследование функции внешнего дыхания (спирометрия, пикфлоуметрия).
Для подтверждения диагноза необходимо наличие прогрессирующей мышечной слабости более чем в одной конечности и отсутствие сухожильных рефлексов (арефлексия). Наличие стойких тазовых нарушений, выраженной стойкой ассиметрии парезов, полиморфноядерных лейкоцитов, а также четкого уровня расстройств чувствительности должны вызывать сомнения в диагнозе «синдром Гийена-Барре». Кроме того, существует ряд признаков, абсолютно исключающих диагноз СГБ, среди них: недавно перенесенная дифтерия, симптомы интоксикации свинцом либо доказательства интоксикации свинцом, наличие исключительно сенсорных нарушений, нарушение обмена порфиринов.
Дифференциальный диагноз
В первую очередь синдром Гийена-Барре невролог дифференцирует от иных заболеваний, которые также проявляются периферическими парезами (полиомиелит), а также других полиневропатий. Полиневропатия при острой перемежающейся порфирии может напоминать синдром Гийена-Барре, но, как правило, сопровождается разнообразной психопатологической симптоматикой (галлюцинации, бред) и выраженными абдоминальными болями. Симптоматика, схожая с признаками СГБ, возможна при обширных инсультах ствола головного мозга с развитием тетрапареза, который в острый период принимает черты периферического. Основные отличия миастении от СГБ — вариабельность симптоматики, отсутствие чувствительных расстройств, характерные изменения сухожильных рефлексов.
Лечение синдрома Гийена-Барре
Все пациенты с диагнозом «синдром Гийена-Барре» подлежат госпитализации в стационар с отделением интенсивной терапии и реанимации. Приблизительно в 30% случаев СГБ в виду развития тяжелой дыхательной недостаточности возникает необходимость в ИВЛ, продолжительность которой определяют индивидуально, ориентируясь на ЖЁЛ, восстановление глотания и кашлевого рефлекса. Отключение от аппарата ИВЛ проводят постепенно с обязательным этапом перемежающейся принудительной вентиляции.
В тяжелых случаях с выраженными парезами особое значение для предупреждения осложнений, связанных с длительной обездвиженностью пациента (инфекции, пролежни, тромбоэмболии легочной артерии), имеет правильный уход. Необходима периодическая (не менее одного раза в 2 часа) смена положения пациента, уход за кожей, контроль над функциями мочевого пузыря и кишечника, пассивная гимнастика, профилактика аспирации. При стойкой брадикардии с угрозой развития асистолии может потребоваться установка временного электрокардиостимулятора.
В качестве специфической терапии синдрома Гийена-Барре, направленной на купирование аутоиммунного процесса, в настоящее время применяют пульс-терапию иммуноглобулинами класса G и плазмаферез. Эффективность каждого из методов сравнительно одинакова, поэтому их одновременное применение считается нецелесообразным. Мембранный плазмаферез значительно уменьшает выраженность парезов и продолжительность ИВЛ. Проводят, как правило, 4-6 сеансов с интервалом в один день. В качестве замещающих сред используют 0,9% раствор натрия хлорида или декстран .
Следует помнить о противопоказаниях к проведению плазмафереза (инфекции, нарушения свертываемости крови, печеночная недостаточность), а также о возможных осложнениях (нарушение электролитного состава, гемолиз, аллергические реакции). Иммуноглобулин класса G, как и плазмаферез, уменьшает продолжительность пребывания на ИВЛ; его вводят внутривенно ежедневно в течение 5 дней в дозе 0,4 г/кг. Возможные побочные эффекты: тошнота, головные и мышечные боли, лихорадка.
Симптоматическая терапия при синдроме Гийена-Барре проводится для коррекции нарушений кислотно-основного и водно-электролитного баланса, коррекции уровня артериального давления, профилактики тромбоза глубоких вен и тромбоэмболии. Оперативное вмешательство может понадобиться для трахеостомии в случае продолжительной ИВЛ (более 10 суток), а также гастростомии при тяжелых и длительных бульбарных нарушениях.
Прогноз при синдроме Гийена-Барре
У большинства пациентов с диагнозом «синдром Гийена-Барре» наблюдается полное функциональное восстановление в течение 6-12 месяцев. Стойкая резидуальная симптоматика сохраняется приблизительно в 7-15% случаев. Частота рецидивов СГБ составляет около 4%, летальность — 5%. Возможные причины смерти — дыхательная недостаточность, пневмония или другие инфекции, тромбоэмболия легочной артерии. Вероятность летального исхода в большой степени зависит от возраста пациента: у детей в возрасте до 15 лет она не превышает 0,7%, в ВТО время как у пациентов старше 65 лет достигает 8%.
Профилактика синдрома Гийена-Барре
Специфических методов профилактики синдрома Гийена-Барре не существует. Однако следует уведомить пациента о запрете на прививки в течение первого года от дебюта заболевания, так как любая прививка способна вызвать рецидив заболевания. Дальнейшая иммунизация разрешена, при этом должна быть обоснована ее необходимость. Кроме того, развившийся в течение 6 месяцев после какой-либо вакцинации синдром Гийена-Барре — сам по себе является противопоказанием к применению данной вакцины в будущем.
Источник
Дата публикации 26 февраля 2018Обновлено 23 июля 2019
Определение болезни. Причины заболевания
Синдром Гийена-Барре (ГБС) — острое аутоиммунное заболевание периферической нервной системы, характеризующееся мышечной слабостью. Это расстройство охватывает группу острых нарушений периферической нервной системы. Каждый вариант характеризуется особенностями патофизиологии и клинического распределения слабости в конечностях и черепных нервах.

У 70% пациентов с ГБС наблюдалось предшествующее инфекционное заболевание перед появлением неврологических симптомов.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы синдрома Гийена — Барре
Симптомы ОРВИ или расстройства желудочно-кишечного тракта отмечаются у 2/3 пациентов. Первыми симптомами ГБС являются парестезии пальцев конечностей, за которыми следует прогрессирующая слабость мышц нижних конечностей и нарушения походки. Болезнь прогрессирует в течение нескольких часов или дней, возникает слабость верхних конечностей и развиваются паралич черепных нервов. Параличи обычно симметричны и носят, конечно, периферический характер. У половины пациентов боль может быть первоначальной жалобой, что затрудняет диагноз. Атаксия и боль чаще встречаются у детей, чем у взрослых. Задержка мочи наблюдается у 10%-15% больных. Поражение вегетативных нервов проявляются головокружениями, гипертонией, чрезмерным потоотделением и тахикардией.
При объективном обследовании выявляется восходящая мышечная слабость, а также арефлексия. Сухожильные рефлексы нижних конечностей отсутствуют, но рефлексы верхней конечности могут вызываться. Мышечная слабость может задействовать и респираторные мышцы. Поражение черепных нервов отмечается в 35-50%, вегетативная нестабильность в 26%-50%, атаксия — в 23%, дизестезия — в 20% случаев.[1]
Наиболее распространенными признаками вегетативной дисфункции являются синусовая тахикардия или брадикардия и артериальная гипертония. У пациентов с тяжелой вегетативной дисфункцией наблюдаются изменения периферического вазомоторного тонуса с гипотензией и лабильностью артериального давления.
Нечастые варианты клинического течения болезни включают лихорадку в начале неврологических симптомов, тяжелую сенсорную недостаточность с болью (миалгии и артралгии, менингизм, корешковая боль), дисфункции сфинктеров.
Возможность ГБС должна рассматриваться у любого пациента с быстрым развитием острой нервно-мышечной слабости. На ранней стадии ГБС следует отличать от других заболеваний с прогрессирующей симметричной мышечной слабостью, включая поперечный миелит и миелопатию, острую токсическую или дифтеритическую полиневропатию, порфирию, миастению и нарушения электролитного обмена (например, гипокалиемия).
Патогенез синдрома Гийена — Барре
Нейрофизиологические процессы, лежащие в основе ГБС, подразделяются на несколько подтипов. Наиболее распространенные подтипы включают:
- острую воспалительную демиелинизирующую полирадикулопатию;
- острую двигательную аксональную невропатию;
- острую моторную и сенсорную аксональную нейропатию;
- синдром Миллера-Фишера, как вариант ГБС, характеризуется триадой признаков: офтальмоплегия, атаксия и арефлексия.
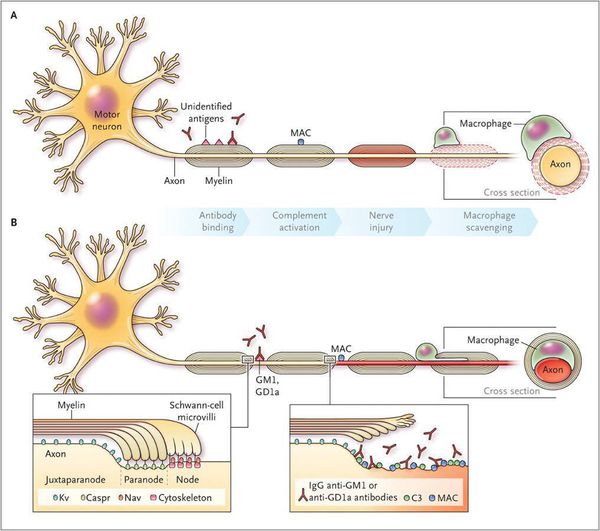
Считается, что ГБС развивается вследствие выработки антител против белка инфекционного агента, которые перекрестно реагируют с ганглиозидами нервных волокон человека. Аутоантитела связываются с миелиновыми антигенами и активируют комплемент, с формированием мембранно-атакующего комплекса на внешней поверхности клеток Шванна. Повреждение оболочек нервных стволов приводит к нарушениям проводимости и мышечной слабости (на поздней стадии может происходить и аксональная дегенерация). Демиелинизирующее поражение наблюдается по всей длине периферического нерва, включая нервные корешки.
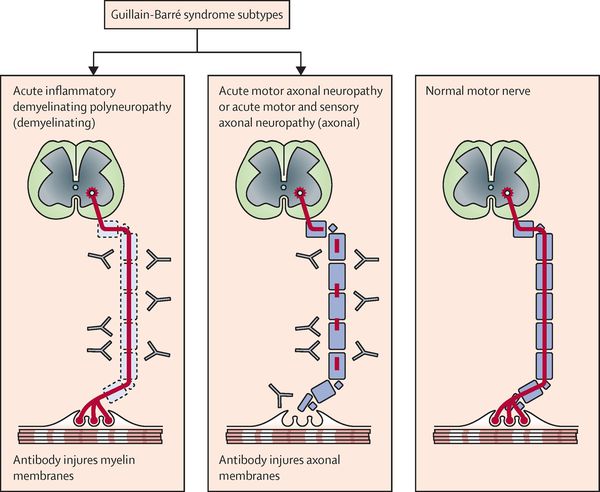
Поражаются все типы нервов, в том числе вегетативные, моторные и сенсорные волокна. Вовлечение двигательных нервов происходит значительно чаще, чем сенсорных.
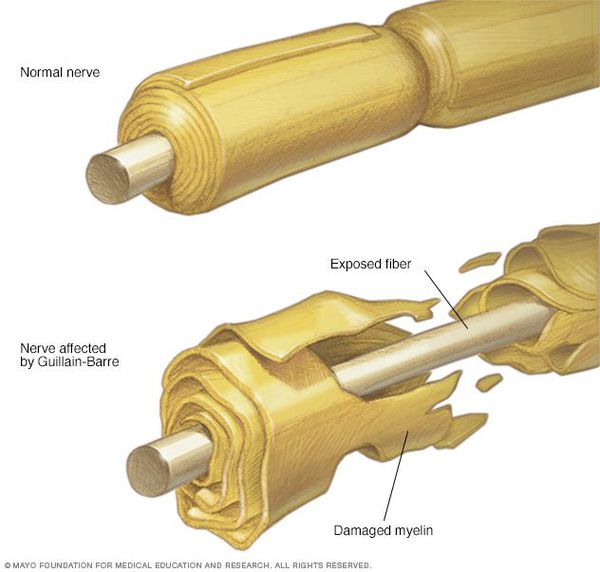
Осложнения синдрома Гийена — Барре
Пациенты с ГБС подвержены риску опасных для жизни респираторных осложнений и вегетативных нарушений.
Показания для перевода в отделение интенсивной терапии включают:
- быстрое прогрессирование моторной слабости с поражением респираторных мышц;
- вентиляционную дыхательную недостаточность;
- пневмонию;
- бульбарные расстройства;
- тяжелую вегетативную недостаточность.
Осложнения проводимого лечения, требующие интенсивной терапии, включают перегрузку жидкостью, анафилаксию на введение внутривенного иммуноглобулина или гемодинамические нарушения при проведении плазмафереза.
У 15%-25% детей с ГБС развивается декомпенсированная дыхательная недостаточность, которая требует механической вентиляции легких.[2] Респираторные нарушения чаще встречается у детей с быстрым прогрессированием заболевания, слабостью верхних конечностей, вегетативной дисфункцией и поражениями черепных нервов. Интубация трахеи может потребоваться у больных для защиты дыхательных путей, проведения механической вентиляции легких. При ГБС быстрое прогрессирование, двусторонний паралич лицевого нерва и вегетативная дисфункция предопределяют повышенную вероятность интубации. Необходимо планирование ранней интубации для минимизации риска осложнений и необходимости проведения экстренной интубации.
Вегетативная дисфункция повышает риск эндотрахеальной интубации. С другой стороны, дисавтономия может увеличить риск гемодинамических реакций на препараты, используемые для индукции анестезии во время интубации.
Признаки, указывающие на необходимость механической вентиляции легких:[4]
- вентиляционная дыхательная недостаточность;
- увеличение потребности в кислороде для поддержания SpO2 выше 92%;
- признаки альвеолярной гиповентиляции (PCO2 выше 50 мм. рт. ст.);
- быстрое снижение жизненной емкости на 50% по сравнению с исходным уровнем;
- невозможность кашля
Вегетативная дисфункция является основным фактором смертности при ГБС. Фатальный сердечно-сосудистый коллапс из-за вегетативной дисфункции наблюдается у 2%-10% тяжелобольных пациентов.[3] Мониторинг частоты сердечных сокращений, артериального давления и электрокардиограммы следует продолжать до тех пор, пока пациенты нуждаются в респираторной поддержке. Чрескожная кардиостимуляция может потребоваться при выраженной брадикардии. Гипотония корректируется восполнением объема циркулирующей крови (ОЦК), и, если пациент невосприимчив к восполнению ОЦК, применяются α-агонисты, такие как норадреналин, мезатон, адреналин.
При нестабильной гемодинамике непрерывная регистрация артериального и центрального венозного давления должна проводиться для контроля объема инфузионной терапии.
Артериальная гипертензия может возникать, но это осложнение не требует специального лечения, если оно не осложняется отеком легких, энцефалопатией или субарахноидальным кровоизлиянием.
Диагностика синдрома Гийена — Барре
Инструментальная диагностика
Люмбальная пункция
При люмбальной пункции результаты СМЖ обычно показывают повышенный уровень белка (> 45 мг/дл), без плеоцитоза (<10 клеток/мм3) (белково-клеточная диссоциация). Иногда уровень белка может оставаться нормальным, при умеренном повышении количества клеток (10-50 клеток/мм3). Цитоз выше, чем 50 клеток/мм3, свидетельствует против диагноза ГБС. В ряде случаев могут быть необходимы повторные люмбальные пункции для уточнения диагноза.
Нейрофункциональная диагностика
ЭНМГ (Электронейромиография) — единственный инструментальный метод диагностики, позволяющий подтвердить диагноз ГБС и уточнить характер патологических изменений (демиелинизирующий или аксональный) и их распространенность.[3]
Игольчатая электромиография характеризуется наличием признаков текущего денервационно-реиннервационного процесса при полинейропатии. Исследуют дистальные мышцы верхних и нижних конечностей (например, переднюю большеберцовую мышцу, общий разгибатель пальцев), а при необходимости и проксимальные мышцы (например, четырёхглавую мышцу бедра).
ЭНМГ-исследование у больных с ГБС зависит от клинических проявлений:
- при дистальных парезах исследуются длинные нервы на руках и ногах: не менее четырех двигательных и четырех чувствительных (двигательные и чувствительные порции срединного и локтевого нервов; малоберцовый, большеберцовый, поверхностный малоберцовый и икроножный нервы с одной стороны).
Оценка основных ЭНМГ- параметров:
- моторные ответы (дистальная латентность, амплитуда, форма и длительность), наличие блоков проведения и дисперсии ответов; анализируется скорость распространения возбуждения по моторным волокнам на дистальных и проксимальных участках.
- сенсорные ответы: амплитуда и скорость проведения возбуждения по сенсорным волокнам в дистальных отделах.
- поздних ЭНМГ-феноменов (F-волн): анализируются латентность, форма и амплитуда ответов, величина хронодисперсии, процент выпадений.
- при проксимальных парезах обязательным является исследование двух коротких нервов (подмышечного, мышечно-кожного, бедренного и др.) с оценкой параметров моторного ответа (латентности, амплитуды, формы).
Первые признаки денервационного процесса появляются через две-три недели после начала заболевания, признаки реиннервационного процесса — через месяц.
Лечение синдрома Гийена — Барре
Общее поддерживающее лечение и уход
Пациенты, требующие интенсивной терапии, требуют тщательного общего ухода. Запор наблюдается более чем в 50% случаев пациентов с ГБС в результате динамической непроходимости кишечника.
При боли применяют парацетамол. Катадолон и трамадол применяют при выраженном болевом синдроме. При нейропатической боли эффективны карбамазепин и габапентин.
В лечении ГБС предпринимаются различные виды иммуномодулирующей терапии.[1][2]
Внутривенный иммуноглобулин назначают в виде ежедневной инфузии (в дозе 0,4 гр/кг/день) в течение 5 дней в первые 2 недели болезни. Второй курс иммуноглобулина может потребоваться 5%-10% пациентов, при отрицательной динамике после первоначального улучшения. Механизм действия внутривенного иммуноглобулина, вероятно, многофакторный и, как полагают, включает модуляцию активации комплемента, нейтрализацию идиотипических антител, подавление воспалительных медиаторов (цитокины, хемокины).
Побочные эффекты иммуноглобулина включают головную боль, миалгию и артралгию, гриппоподобные симптомы, лихорадку. У пациентов с дефицитом IgA может развиться анафилаксия после первого курса внутривенного иммуноглобулина.
Плазмаферез способствует удалению антител, вовлеченных в патогенез ГБС. В течение каждого сеанса 40-50 мл/кг плазмы заменяют смесью 0,9% раствора хлорида натрия и альбумина. Проведение плазмафереза приводит к сокращению времени выздоровления и снижению потребности в искусственной вентиляции. Эти преимущества очевидны, если плазмаферез проводится в течение первых двух недель после начала болезни. Осложнения, связанные с плазмаферезом, включают гематому в области венопункции, пневмоторакс после катетеризации подключичной вены и сепсис. Плазмаферез противопоказан пациентам с тяжелой гемодинамической нестабильностью, кровотечением и сепсисом.
Комбинация плазмафереза и иммуноглобулина не показала клинических преимуществ.
Кортикостероиды не должны использоваться при лечении ГБС, т. к. не ускоряют выздоровление, не уменьшают вероятность ИВЛ и не влияют на долгосрочный результат.[2]
Прогноз. Профилактика
ГБС остается серьезным заболеванием, несмотря на улучшение результатов лечения. По сравнению со взрослыми, у детей чаще отмечается более благоприятное течение заболевания, с полным, а не частичным выздоровлением. Причинами неблагоприятного исхода при ГБС являются дыхательная недостаточность, осложнения искусственной вентиляции легких (пневмония, сепсис, острый респираторный дистресс-синдром и тромбоэмболические осложнения), остановка сердца, вторичная по отношению к дисавтономии.
Восстановление обычно начинается через две-четыре недели после прекращения прогрессирования симптомов. Среднее время от начала заболевания до полного выздоровления составляет 60 дней. Данные относительно долгосрочного исхода ГБС ограничены. 75% – 80% пациентов полностью выздоравливают. Около 20% пациентов не могут ходить через полгода.
Младшая возрастная группа (менее 9 лет), быстрое прогрессирование и максимальная мышечная слабость, потребность в искусственной вентиляции легких являются важными предикторами длительного двигательного дефицита.[4]
Источник
