Комплексное лечение больных с синдромом диабетической стопы


Введение
Сахарный диабет (СД) — хроническое заболевание, сопровождающееся развитием сосудистых осложнений. По данным ВОЗ, в настоящее время в мире СД болеют 285 млн человек. Прогнозы показывают, что к 2025 г. количество больных СД достигнет 380 млн человек, а к 2035 г. — 600 млн. В настоящее время в России количество больных СД составляет 3 121 318 человек, из них 40–60% уже имеют поздние осложнения [1–3]. Известно, что СД является фактором риска для множества хронических заболеваний и одной из ведущих причин инфарктов, инсультов, почечной недостаточности, слепоты, долго не рубцующихся ран и ампутации нижних конечностей [4]. Если сегодня осложнения СД ежегодно являются причиной не менее 1,6 млн смертей в мире [5], то через 10 лет эта цифра удвоится. В России смертность от СД 1 типа составляет 2,1 на 100 тыс. населения, при СД 2 типа — 60,3 на 100 тыс. [1].
Лидирующее положение среди всех осложнений СД принадлежит синдрому диабетической стопы (СДС), встречающемуся у 20–80% больных в возрасте от 20 до 75 лет. Актуальность медико-социальной проблемы СД связана с высокой прогрессирующей распространенностью, инвалидизацией и возрастающей смертностью этих больных [1, 2, 6, 7].
В связи с актуальностью лечения хирургической инфекции больных СД СДС выделен в качестве самостоятельной нозологии (доклад исследовательской группы ВОЗ 1997 г. по теме «Сахарный диабет»). СДС — это патологическое состояние стоп больного СД, которое возникает на фоне поражения периферических нервов, сосудов, кожи и мягких тканей, костей, суставов и проявляется острыми и хроническими язвами, костно-суставными поражениями и гнойно-некротическими процессами.
Чаще всего осложнениям СДС предшествуют язвенные поражения. Наибольшая частота язв стоп зафиксирована в возрасте 45–64 лет, язвенно-некротические формы, нередко приводящие к ампутациям, развиваются в 15% случаев СДС [6].
Лидирующей причиной нетравматических ампутаций нижних конечностей является СДС, составляющий 50–70%. Гнойно-некротические процессы на стопе развиваются еще чаще, достигая 15% у больных СД [8, 9]. Длительно незаживающие язвы или раны становятся причиной развития гнойно-воспалительных осложнений, повторных госпитализаций и оперативного лечения [9–11]. В результате хирургического лечения у больных с СДС остаются различные раневые дефекты, которые переходят в длительно незаживающие язвы [12].
Факторы, влияющие на результат лечения язвенных и раневых дефектов стоп при СДС (ишемия, нейропатия, инфекция), имеют невысокое прогностическое значение [3, 13–16].
Лечение инфицированных ран ног составляет ¼ всех диабетических госпитализаций в США и Великобритании. Ориентировочная стоимость первичного лечения СДС в США составляет 4595 долл. и почти 28 тыс. долл. в течение 2 лет после постановки диагноза [17].
В результате консервативного лечения добиться первичного заживления язвенного дефекта удается в 63–81% случаев, необходимость ампутации при длительном лечении на различных уровнях конечности возникает у 14–24% пациентов, летальность достигает 5–13%. Эти цифры говорят об актуальности проблемы повышения эффективности лечения больных СД, имеющих хронические раны и язвы нижних конечностей [17, 18].
На заживление язвенных дефектов стоп у больных СД влияет множество факторов: периферическая нейропатия (сенсорная, моторная, автономная); факторы, предрасполагающие к нарушению макроциркуляции: метаболизм (нарушение липидного обмена, гипергликемия, повышение уровня свободных радикалов, гиперкоагуляция, гиперинсулинемия, протеинурия), зависимость от конституции (возраст, пол, ожирение, наследственность), курение, хроническая почечная недостаточность (гемодиализ), прием таких лекарственных препаратов, как β-блокаторы, тиазидные диуретики; нарушение микроциркуляции; инфекция; длительность течения СД; наличие длительно незаживающего язвенного дефекта; предшествующая ампутация [12, 14, 19]. Частота заживления в зависимости от типа дефектов варьирует от 57 до 94% [20].
Большинство авторов придерживаются консервативного подхода к лечению СДС, однако длительность такой терапии составляет долгие месяцы. По мнению многих авторов, стандартные схемы местной медикаментозной терапии раневых и язвенных дефектов малоэффективны. Требуется всесторонняя оценка эффективности использования современных перевязочных средств для местной терапии хронических ран и язв у больных с СДС [5, 6, 12, 17, 18].
Разнообразные клинические исследования показали высокую эффективность препаратов на основе ионизирующего серебра в лечении гнойно-некротических осложнений при СДС. Местная терапия в лечении хронических ран и язв сульфатиазолом серебра основана на высокой противомикробной активности в отношении грамположительных и грамотрицательных бактерий, различных резистентных к антибиотикам микроорганизмов, активизации регенераторных процессов в ране [18, 21, 22]. В России единственным препаратом с данным действующим веществом является Аргосульфан® [23].
Улучшение результатов комплексного консервативного лечения раневых и язвенных дефектов стопы при СД в настоящее время связывают с сохранением опорной функции пораженной конечности.
Цель работы — оценить эффективность местного лечения сульфатиазолом серебра раневых и язвенных дефектов у больных с СДС перед реконструктивными пластическими операциями.
Материал и методы
В исследование включили 120 пациентов, у которых воспалительный процесс на стопе в результате комплексного лечения имел благоприятное течение с формированием анатомических и функциональных дефектов, находящихся во второй и третьей стадиях раневого процесса.
Основную группу составили 58 (48,3%) пациентов, которым назначали сульфатиазол серебра в монотерапии. 62 (51,7%) пациента, которым назначали антибактериальные и дезинфицирующие мази на водорастворимой основе, составили контрольную группу. Сульфатиазол серебра наносили на поверхность раны или язвы тонким слоем 2–3 мм под окклюзионную повязку 1 р./сут.
В исследуемых группах СД 2 типа выявлен у 94 пациентов (78,3%), СД 1 типа — у 26 больных (21,7%). Средние сроки заболевания до момента диагностики СД составили 7,6+2,3 года. Возраст пациентов варьировал от 15 до 84 лет, основная часть больных (72,6%) — трудоспособного возраста (от 25 до 65 лет). Женщин было 63,3% (76 больных), мужчин — 36,7% (44 больных). Средний возраст — 55,6±3,8 года. В обеих группах большинство составили пациентыс нейроишемической формой СДС (НИФ СДС) — 87 человек (72,5%), нейропатическая форма СДС отмечена у 33 (27,5%) пациентов. Сопутствующая патология в виде ишемической болезни сердца, цереброваскулярной болезни, патологии опорно-двигательного аппарата, ожирения наблюдалась у 45% больных.
Со 2-й степенью поражения стопы по F.W. Wagner наблюдали 52 (43,3%) больных, с 3-й степенью — 68 больных (56,7%). Средняя площадь поражения составила 38,35+11,5 см2.
Комплексная консервативная терапия включала антибактериальные препараты, аналоги простагландина Е1, антикоагулянты или низкомолекулярные гепарины, разгрузку пораженной конечности и местное лечение. Всем пациентам, как оперированным по поводу осложнений СДС, так и получавшим консервативное лечение, назначали инсулинотерапию. Для лечения использовали инсулин короткой и средней продолжительности действия.
В клинической практике применялась классификация University Texas San Antonio (UTSA) (Frykberg R.G., Zvonis T., Armstrong D.G., 2006) (табл. 1), которая связывает глубину поражения с ишемией и инфекцией. UTSA-классификация используется во многих международных диабетических центрах, т. к. учитывает все важные элементы патогенеза диабетической язвы: инфекцию, ишемию и глубину гнойно-некротического процесса.

У всех больных при первичной хирургической обработке гнойного очага проводили посев отделяемого на микрофлору, определяли уровень микробной обсемененности и чувствительность микрофлоры к антибиотикам. Повторяли посевы из раны через каждые 3–5 сут, а также во время повторных хирургических обработок, перед выполнением кожно-пластической операции.
Одновременно с посевом при необходимости осуществляли микроскопическое исследование мазков-отпечатков из глубины раны, окрашенных по Граму.
Результаты исследования
Реконструктивным сосудистым операциям подверглись 52 (43,3%) пациента с НИФ СДС: из них 37 (30,8%) проведена реваскуляризация пораженной нижней конечности путем баллонной ангиопластики, 10 (8,3%) — стентирование пораженных артерий. Только медикаментозная коррекция критической ишемии проводилась у 5 (4,2%) пациентов.
При первичных бактериологических исследованиях получена полимикробная флора с преобладанием грамположительных бактерий (Staphylococcus aureus, Streptococcus spp.), бактерий семейства Enterobacteriaceae (E. coli, Klebsiella spp. и др.) и анаэробов, обсемененность ран составила 105–108 КОЕ/г у 87% больных. Моноинфекции, представленные грамположительными бактериями (Staphylococcus aureus, Streptococcus spp.), выявлены в 13% случаев.
После проведения курса противовоспалительной антибактериальной терапии совместно с местным лечением микробиологическая картина менялась в обеих группах исследуемых (табл. 2).

Мы изучили качественный и количественный состав микрофлоры после комплексного лечения, перед выполнением кожной пластики, опираясь на данные, полученные до и во время выполнения пластического закрытия раны. Количество Pseudomonas spp. до кожной пластики составило 10,7%, Proteus spp. — 2,4%, Acinetobacter spp. — 8,3%, Klebsiella spp. — 3,1%, анаэробы не определялись. Как видно, количество в посевах грамотрицательной флоры заметно преобладало. Так, Pseudomonas spp. высевалась у 14,1% оперированных из основной группы, Proteus spp. — у 3,7%, Acinetobacter spp. — у 10,4%, Klebsiella spp. — у 5,2%, анаэробы не определялись. Число посевов с отрицательным результатом увеличилось до 27,4%. Микробные ассоциации были выявлены только у 8% больных. Результаты бактериологического анализа у больных контрольной группы оценивали на момент полного разрешения гнойно-воспалительного процесса. После купирования воспалительного процесса уровень микробной обсемененности раневой поверхности в большинстве случаев не превышал 105 микробных тел в 1 г ткани и в среднем составлял lg 3,86+1,04.
В 1-е сут стационарного лечения у 80 больных (66,7%) преобладал воспалительный тип цитограммы. С начала использования в местной терапии сульфатиазола серебра очищение раневых и язвенных дефектов от некрозов и появление воспалительного типа цитограммы у больных основной группы отмечено на 4,8+0,8 сут (р<0,05). Сульфатиазол серебра поддерживал на поверхности раневых и язвенных дефектов умеренно влажную среду. У пациентов в основной группе появление грануляций отмечено к 9,6+0,9 сут (р<0,05) лечения. У пациентов группы сравнения сроки формирования грануляционной ткани были значительно дольше и составили 13,4+1,4 сут (р<0,01).
У пациентов группы сравнения, получавших стандартную местную терапию, воспалительный тип цитограммы зарегистрирован на 7,5+0,6 сут (р<0,05) стационарного лечения. По мере разрешения воспалительного и ишемического процесса, при комплексном консервативном лечении цитологическая картина менялась. На фоне лечения гнойно-воспалительного процесса сменялись фазы раневого процесса — из первой во вторую. К моменту проведения кожной пластики у 83 (69,2%) больных наблюдались регенераторные типы цитограмм, у 37 (30,8%) больных выявлен воспалительно-регенераторный тип (р<0,048) (табл. 3).
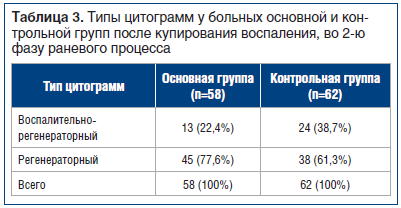
После купирования воспаления, очищения раневых и язвенных дефектов у 13,8% (n=8) больных в основной группе язвенные и раневые дефекты зажили самостоятельно в сроки 28,8+7,5 сут (р<0,05). В группе сравнения у 22,5% больных (n=14) сроки заживления ран и язв составили 54,8+4,7 сут (р<0,05). Средняя площадь раневых дефектов достигла 11,8+3,5 см2.
Остальным 81,7% (n=98) пациентов с раневыми и язвенными дефектами разной локализации на стопе были выполнены реконструктивно-восстановительные операции.
Пластика раны с помощью только местных тканей выполнена 39 (39,8%) больным. Пластика местными тканями с перемещением кожных лоскутов выполнена большинству пациентов — 27 (27,5%). Остальным 14 (14,3%) больным закрывали дефекты с помощью ротационных кожных лоскутов, дермотензии. Средняя площадь дефекта составила 30,25+9,6 см2. Оптимальными условиями для пластики местными тканями мы считали кровоток магистрального и измененного магистрального типа; показатели тканевой перфузии краев раны — более 1 пф. ед., ТсрО2 ≥ 30 мм рт. ст.
Пластика раневых и язвенных дефектов свободным кожным лоскутом выполнена 18 (18,4%) больным. Площадь раневого дефекта в среднем составила 14+8,4 см2.
При изолированной андрогензависимой дермопатии полное приживление свободного кожного лоскута отмечено у 15 (83,3%) из 18 больных. Лизис до 50% площади кожи выявлен у 2 (11,1%) пациентов, лизис больше 50% площади лоскута — у 1 (5,5%). Частичное отторжение кожного лоскута наблюдалось у 2 (11,1%) больных.
Несмотря на развитие осложнений в ближайшем послеоперационном периоде, хороший результат лечения был отмечен у 93 (77,5%) пациентов. В результате пластики местными тканями удалось сформировать плотный рубец, что позволило сохранить опорную функцию стопы у 32 (82,0%) из 39 больных, у которых применялся данный способ кожной пластики.
Вторичные дефекты сформировались у 14 (14,2%) больных. Нагноение раны выявлено у 5 (5,1%) больных, расхождение швов — у 4 (4,0%), ишемия лоскута с развитием краевого некроза — у 4 (4,0%), полный некроз лоскута — у 1 (1,0%) пациента. Частичное заживление ран, не требующее повторной кожной пластики, отмечено у 7 (7,1%) больных. Из них 5 (5,1%) пациентов выписаны с открытыми дефектами, которые самостоятельно зажили в сроки от 7 до 23 дней.
Количество осложнений, развившихся в раннем послеоперационном периоде, зависело от степени компенсации микрокровотока. При компенсированном кровотоке нам удалось получить малое количество осложнений, которые были отмечены у 3 (3,0%) больных, при субкомпенсированном кровотоке — большее количество осложнений, при котором отмечалось худшее заживление ран и приживление лоскутов, — у 16 (16,3%) больных.
В группе больных, получавших сульфатиазол серебра, отмечено сокращение сроков стационарного лечения перед кожно-пластическими операциями на 3,8+0,5 сут, уменьшение площади раневых и язвенных дефектов.
У 2 (1,6%) больных, получавших сульфатиазол серебра, отмечено появление аллергической реакции в виде крапивницы и зуда, что послужило поводом для отмены данного препарата у больных.
Заключение
Развитие осложнений после кожно-пластических операций связано с пролонгированной ишемией. Местное применение сульфатиазола серебра в комплексном лечении язвенных и раневых дефектов стопы, развившихся в результате тяжелых гнойно-некротических поражений на фоне СДС, ускорило регенераторно-репаративный процесс в ранах, сократило сроки госпитализации, позволило в ранние сроки подготовить раны и язвы к пластике, восстановить опорную функцию конечности. Это создает предпосылки для скорейшей физической и социальной реабилитации больного и значительно снижает затраты на лечение.
Благодарность
Компания «Валеант» поддерживала техническую редакцию статьи и обеспечивала взаимодействие между авторами настоящей публикации.
Источник
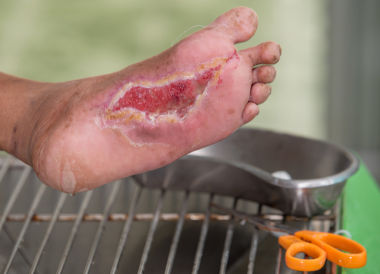 Для цитирования. Кисляков В.А., Оболенский В.Н., Юсупов И.А. Синдром диабетической стопы: комплексный подход к лечению // РМЖ. 2015. No 12. С. 768–770.
Для цитирования. Кисляков В.А., Оболенский В.Н., Юсупов И.А. Синдром диабетической стопы: комплексный подход к лечению // РМЖ. 2015. No 12. С. 768–770.
Распространенность и экономические аспекты
В XXI в. сахарный диабет (СД) стал ведущим неинфекционным заболеванием. Каждые 10 с в мире становится на 2 больных СД больше – это 7 млн в год. По мнению экспертов Всемирной организации здравоохранения, СД занимает 1-е место среди заболеваний, приводящих к инвалидности, и 3-е – по смертности [1–4].
Согласно исследованиям Эндокринологического научного центра (ЭНЦ), в России распространенность СД достигает 10–12 млн человек (7–8% населения страны). Наиболее высокая распространенность СД среди взрослого населения крупных городов. При этом соотношение мужчин и женщин – 1:3. В половине случаев СД 2-го типа выявляется на 5–7-м году от начала заболевания, и у 20–30% выявляются специфические осложнения: катаракта, ретинопатия, нефропатия, нейропатия, синдром диабетической стопы (СДС), ишемическая болезнь сердца, артериальная гипертония и др. [5–8].
СДС приводит к гнойно-некротическим поражениям стоп с последующей потерей нижних конечностей – к самой высокой инвалидизации. Окончательные цифры распространенности СДС в настоящее время неизвестны. Тем не менее установлено, что у 15% больных СД развиваются патологические изменения в стопах или голеностопном суставе [9–13].
В последние годы широко обсуждаются не только клинические, но и экономические, социальные аспекты профилактики и лечения СДС, методы клинико-экономического анализа и, прежде всего, учет всех затрат, связанных с лечением СДС [1, 14].
На 18-м конгрессе Международной федерации диабета (МФД) были представлены, в частности, данные о распространенности язвенных дефектов при СДС в странах Балканского региона – 7,5%. Диагноз СД впервые ставится во время хирургического вмешательства у 15–19% больных, подвергающихся ампутации. Специалисты МФД считают, что вероятная частота ампутаций при СД составляет 5–24 на 100 000 населения в год, или 6–8 на 1000 больных в год, а в эпидемиологически неблагоприятных регионах достигает 24 на 1000 больных в год. В России, согласно данным государственного регистра, эти показатели колеблются от 0,76 до 18,2 и в среднем составляют 6,4 случая на 1000 больных [3, 4, 11, 15].
Расходы на лечение СДС в развитых странах составляют около 12–15% от всех затрат на лечение СД, в развивающихся странах они могут составлять до 40% от общего объема финансовых ресурсов, выделяемых на СД. Подсчитано, что на проведение одной ампутации в зарубежных странах тратится более 10 000 долл. Общие затраты на лечение СДС в среднем составляют 13 179 долл. и меняются в зависимости от степени тяжести по классификации Wagner в пределах от 1892 долл. при I степени до 27 721 долл. при IV–V степени тяжести. Лечение СДС на фоне хронической артериальной недостаточности нижних конечностей обходится в 4,5 раза дороже, чем при сохранном периферическом кровотоке. Ежегодная стоимость лечения язвенных поражений стоп при СДС в США составляет 5 млрд долл. прямых медицинских затрат и 400 млн долл. косвенных медицинских затрат. Кроме того, в США зафиксировали, что 77% людей старше 75 лет после ампутации не способны вернуться в собственный дом и им нужна дополнительная помощь и поддержка социальных групп [8, 16–18].
Анализ работы отделения диабетической стопы ЭНЦ показал, что при своевременно начатой адекватной терапии СДС понижается риск хирургических вмешательств и тяжелых осложнений: у 98% больных с нейропатической инфицированной формой СДС можно избежать хирургического вмешательства; у 60% с нейроишемической формой – проведения ампутаций на уровне голени и бедра; у 25% с критической ишемией – предотвратить высокие ампутации на уровне бедра; на 50% уменьшить частоту образования язв стоп в группе высокого риска [4, 5, 13].
Летальность среди больных СД, перенесших высокую ампутацию конечности по поводу гангрены, в течение последующих 5 лет достигает 68%, в ближайшие 3 нед. – 22%, в течение года – 11–41%, через 3 года – 20–50%, через 5 лет – от 39–68%. Частота ипсилатеральных ампутаций через год после первой ампутации – до 24%, через 2 года – 30%, через 5 лет – 49% и контралатеральных ампутаций через год после первой ампутации – до 12%, через 2 года – 23%, через 5 лет – 28-51%. Рецидивы язв на стопах через 1, 3, 5 лет составили 44, 61, 70% соответственно. Рецидивирующие деструктивные поражения ухудшают проблемы лечения, реабилитации, социальной помощи, увеличивая экономические затраты [19–23].
Если распространенность СД, а соответственно и СДС будет увеличиваться с той же скоростью, что и сейчас, то к 2025 г. экономический ущерб составит от 213 до 396 млрд долл. в год. 75% прироста заболевания придутся на развивающиеся страны. По данным немецких исследователей, общая стоимость лечения больных СД в Германии составляет приблизительно 5 млрд. евро, а средняя стоимость лечения 1 пациента – 5000 евро в год. Ежегодные общие затраты в России на лечение нейроишемической формы СДС составляют 56,2 млн долл., при этом затраты на ампутации достигают 14,4 млн долл. [2, 5, 17].
По оценке главного экономиста Morgan Stanley Эльги Бартш, сочетание двух факторов – СД и ожирения – снизит среднегодовые темпы роста валового внутреннего продукта (ВВП) в странах Организации экономического сотрудничества и развития (ОЭСР) в 2015–2035 гг. с 2,3 до 1,8%, в странах БРИКС (Бразилия, Россия, Индия, Китай, Южно-Африканская Республика) – с 4,5 до 4,2%. Согласно прогнозам ОЭСР, среднегодовые темпы роста ВВП России составят 2,8%. При сохранении нынешнего уровня потребления сахара гражданами страны этот показатель снизится до 2%. Согласно результатам исследования, проведенного фармацевтической компанией «Ново Нордиск», «Инвестиции в лечение сахарного диабета в России», ежегодные прямые затраты, связанные с СД в России, составляют 12,5 млрд долл. США. При этом 42% объема этих средств расходуется на лечение осложнений, которые выявляются у 40–50% людей в момент постановки диагноза. Соответственно диагностика заболевания на ранних стадиях позволит российскому обществу сэкономить более 1,5 млрд долл. США из средств, выделяемых на здравоохранение [13].
Принципы терапии
По мнению большинства авторов, в лечении пациентов с синдромом диабетической стопы должны участвовать квалифицированные эндокринолог, гнойный хирург, сосудистый хирург, ортопед, специально обученный средний медицинский персонал, а комплексное лечение должно включать общие и местные методы (рис. 1) [24–26].
Тактика комплексного лечения зависит от формы заболевания [14, 15, 18, 19, 21, 27]. Мы, как и ряд специалистов, выделяем следующие клинические формы СДС.
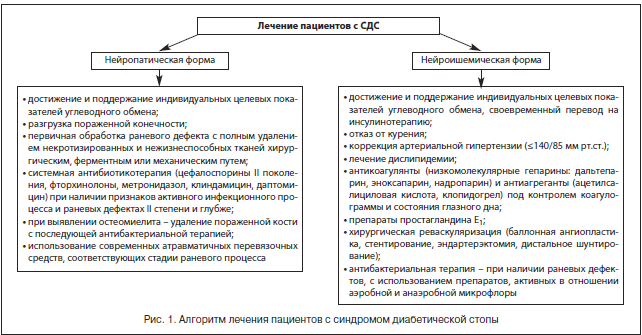
1. Нейропатическая форма:
– без остеоартропатии;
– с остеоартропатией – «сустав Шарко».
2. Нейроишемическая форма с учетом других характеристик.
К общим принципам терапии пациентов с СДС относятся коррекция факторов риска, компенсация углеводного обмена и поддержание целевых показателей углеводного обмена, компенсация сопутствующих заболеваний, системная антибактериальная, антитромботическая, вазопротекторная терапия в сочетании с адекватным обезболиванием.
К местным принципам лечения относятся: обеспечение полной разгрузки пораженной области с помощью разгрузочного полубашмака, индивидуальной разгрузочной повязки, костыля, сложной ортопедической обуви, кресла-каталки; контроль раневой инфекции, заключающийся в первичной обработке раны и местном лечении раны с правильным выбором повязки в зависимости от фазы течения раневого процесса; хирургическое лечение гнойно-некротического очага стопы с закрытием ран и/или формированием культи пораженной стопы при помощи реконструктивных и пластических операций; восстановление магистрального артериального кровотока в сосудах нижних конечностей.
Перспективным является применение L-лизина эсцината в комплексном лечении язвенных и гнойно-некротических поражений при СДС. Эффективность препарата объясняется его противоотечным действием, связанным со снижением проницаемости сосудистой стенки и улучшением венозного оттока. L-лизина эсцинат обладает стабилизирующим действием на мембраны клеток, снижает активность лизосомальных ферментов, принимающих непосредственное участие в воспалительном процессе. Кроме того, препарат блокирует эффекты фосфолипазы А2, которая является ключевым веществом в развитии воспалительной реакции, связанной с повреждением мембран клеток различными факторами при ишемии, инфекции и травме. Стабилизация фосфолипазы А2 способствует снижению активности простагландинов, что также приводит к уменьшению воспалительного ответа. Доказано также влияние L-лизина эсцината на такие медиаторы воспаления, как гистамин, серотонин, которые выделяются из тромбоцитов, тучных клеток и создают основу для классической воспалительной реакции. Комплексный эффект препарата L-лизина эсцината апробирован в нейрохирургической, неврологической, травматологической практике, ангиологии и флебологии [26–31].
Мы регулярно применяем L-лизина эсцинат по 10 мл в разведении на 50 мл физиологического (0,9%) раствора внутривенно капельно в течение 10 дней у пациентов с нейропатической формой СДС в послеоперационном периоде, с трофическими язвами на фоне нейропатических отеков и у больных с язвами на фоне венозной недостаточности (СЕАР 2-3). Отмечаем благоприятное течение послеоперационного периода, более раннее уменьшение отеков, снижение болевого синдрома, нейропатических болей, заживление язв. Рекомендуем применение L-лизина эсцината для лечения язвенных и гнойно-некротических поражений при СДС в амбулаторной и стационарной практике.
Заключение
СД является серьезным заболеванием, способным привести к тяжелым социально-экономическим и демографическим последствиям. Вопрос о влиянии СДС на качество жизни остается малоизученным. Неизвестны долговременные затраты, связанные с лечением рецидивов язв, проведением повторных ампутаций и увеличением расходов на социальное обслуживание. Кроме того, неучтенными остаются непрямые затраты вследствие утраты человеком из-за болезни профессиональных и социальных функций, что наносит обществу материальный и духовный ущерб.
Опыт других стран, например США, показал, что мультидисциплинарный подход, ранняя диагностика и обучение больных позволяют снизить количество язв стопы и ампутаций на 49–85% и существенно уменьшить расходы государства. Использование программ по профилактике осложнений и обучению больных СД приводит к уменьшению количества ампутаций почти в 2 раза, а экономический эффект от внедрения программ обучения составил 10 млн долл. [2, 5, 9, 11, 13, 21].
Учитывая вышеизложенное, 20 апреля 2015 г. в Кремле Президент РФ Владимир Путин подписал Закон о ратификации соглашения о сотрудничестве стран СНГ в борьбе с ростом заболеваемости сахарным диабетом [18], что в сочетании с грамотным ведением пациентов с СДС может улучшить прогноз как для этих пациентов, так и для больных СД в целом.
Источник
