Лечение хронического болевого синдрома при остеоартрозе
Что это?
Остеоартрозом называют группу заболеваний суставного хряща и околосуставных тканей (рис. 1), в которых происходят дегенеративные нарушения. В основе остеоартроза лежит поражение гиалинового хряща, подлежащей (субхондральной) кости, синовиальной оболочки и капсулы сустава, околосуставных связок и мышц.
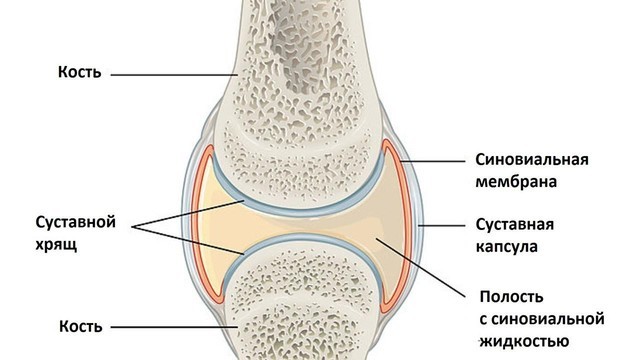 Рисунок 1. Строение сустава. Поверхность костей внутри сустава покрыта хрящом, что помогает снижать трение. Суставная капсула прикреплена к костям и состоит из соединительной ткани. Внутри полость сустава заполнена суставной жидкостью. Источник: OpenStax College
Рисунок 1. Строение сустава. Поверхность костей внутри сустава покрыта хрящом, что помогает снижать трение. Суставная капсула прикреплена к костям и состоит из соединительной ткани. Внутри полость сустава заполнена суставной жидкостью. Источник: OpenStax College
При остеоартрозе снижается плотность и эластичность хряща, происходит его истончение, разволокнение, растрескивание с образованием эрозий. Суставная поверхность прилежащей кости уплотняется и утолщается, суставная щель между хрящами сужается, формируются костные разрастания – остеофиты, похожие на шипы (рис. 2).
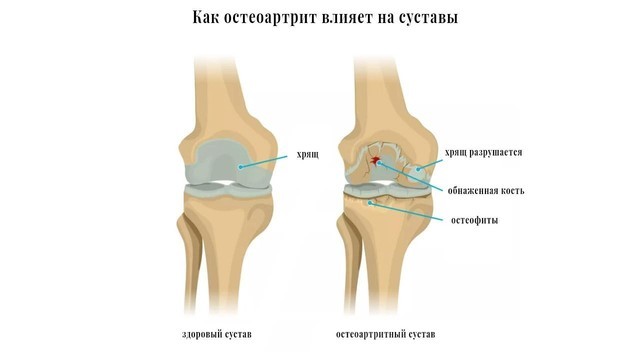 Рисунок 2. Остеоартроз (остеоартрит) коленного сустава. Межсуставное пространство сужено, хрящ разрушен, на кости образовались наросты. Источник: drugwatch.com
Рисунок 2. Остеоартроз (остеоартрит) коленного сустава. Межсуставное пространство сужено, хрящ разрушен, на кости образовались наросты. Источник: drugwatch.com
Они травмируют капсулу сустава, вызывая воспаление ее внутренней синовиальной оболочки (синовит). В результате возникает боль в суставе, он увеличивается и деформируется, а главное – не может полноценно работать.
Чем остеоартроз отличается от артроза?
Согласно Международной классификации болезней, которой руководствуются врачи всего земного шара, термины «остеоартроз» и «артроз» рассматриваются как синонимы. Приставка «остео» в диагнозе говорит о том, что болезнь уже затронула кость. На начальных стадиях артроза кость может быть еще не деформирована.
Не следует путать артроз и артрит. При остеоартрозе происходит разрушение сустава, следствием которого может стать воспаление затронутой области. Артрит – это всегда воспаление, вызванное инфекцией, аутоиммунным процессом или травмой.
В чем причины заболевания?
Внешними причинами остеоартроза могут быть:
- травмы – переломы, повреждение связочного аппарата суставов, вывихи, растяжение связок;
- избыточная нагрузка на суставы из-за обуви на высоких каблуках, занятий спортом (прыжки, бег, тяжелая атлетика) и тяжелым физическим трудом, статичной (сидя или стоя) работы;
- операции на суставах.
Гораздо больше внутренних причин формирования остеоартроза. Это:
- лишний вес;
- эндокринные заболевания: сахарный диабет, нарушение работы щитовидной и паращитовидной желез, ранний климакс и дефицит гормонов в менопаузе (эстрогенов);
- воспалительные заболевания суставов инфекционного происхождения (бактериальные, вирусные);
- аутоиммунная патология (ревматоидный артрит, красная волчанка, ревматизм, псориаз);
- генетические факторы: дисплазии хрящевой ткани, дефицит белка коллагена 2 типа, синдром гипермобильности суставов, гемофилия (из-за нарушения свертывания крови происходят повторные кровоизлияния в суставы);
- нарушение обмена мочевой кислоты (подагра), кальция, меди (болезнь Вильсона-Коновалова);
- нарушения осанки;
- нарушения кровоснабжения суставов из-за варикозной болезни вен нижних конечностей, атеросклероза сосудов.
Кто в группе риска?
Учитывая причины заболевания, в группе риска по остеоартрозу находятся:
- люди старше 45 лет с избыточным весом, ведущие малоподвижный образ жизни;
- женщины, особенно в период естественной или хирургической менопаузы;
- пациенты с перенесенными травмами опорно-двигательного аппарата;
- работники тяжелого физического труда и определенных профессий (водители, продавцы, бухгалтеры, спортсмены).
Формы заболевания
Остеоартроз бывает локализованным (поражается менее трех суставов) и генерализованным (три и более сустава). В патологический процесс могут вовлекаться любые сочленения, но чаще всего:
- Кисти с характерными утолщениями межфаланговых и пястно-фаланговых суставов – узлами Гебердена и Бушара,
- Сустав большого пальца ног (первый плюснефаланговый), где появляется «косточка»,
- Межпозвоночные суставы шейного и поясничного отделов позвоночника,
- Коленные суставы (гонартроз),
- Тазобедренный сустав (коксартроз),
- Голеностопный сустав,
- Плечевой сустав,
- Височно-нижнечелюстной сустав.
При первичном (идиопатическом) остеоартрозе причина разрушения хряща и всего сустава в целом не установлена. Вторичные остеоартрозы, напротив, имеют свою причину: травмы, нарушения обмена кальция и мочевой кислоты, неврологические расстройства, воспалительные процессы в суставах.
Стадии болезни
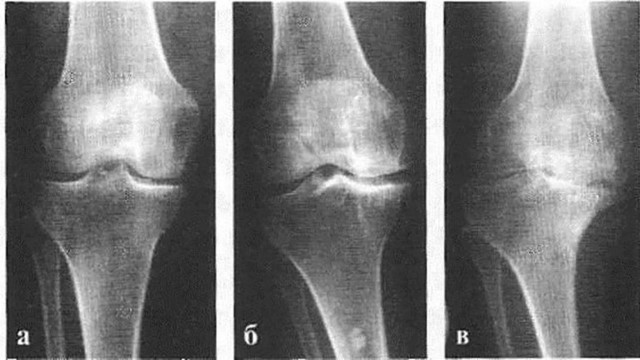
Различают три (иногда – 4 и даже 5) стадии остеоартроза.
Начальная стадия
Болит сустав лишь при чрезмерных нагрузках, но после отдыха перестает. Рентгенологическое исследование показывает незначительное уменьшение просвета суставной щели. Разрастание костной ткани отсутствует либо незначительно .
Стадия остеофитов
Хрящи и мениски начинают разрушаться, боль возникает при обычной физической нагрузке и сама не проходит, снимается анальгетиками. Сустав увеличивается, нарушается его форма и подвижность. Размер суставной щели на рентгеновском снимке заметно уменьшен, видны явные костные разрастания. Поверхность сустава изменена (на снимке – просветления в кости).
Тяжелый артроз
Беспокоят постоянная боль, стойкая деформация суставов с нарушением оси конечности, резкое ограничение подвижности. Из-за вынужденного бездействия в определенных группах мышц развивается атрофия, может измениться длина конечности. При рентгенологическом исследовании суставная щель не визуализируется. Поверхность сустава изменена, видно обширное разрастание остеофитов, наблюдаются явные кистозные просветления в кости.
 Рисунок 3. Стадии остеоартроза на рентгеновском снимке: а – начальная стадия, б – стадия остеофитов, в – тяжелая стадия. Классификация Натальи Сергеевны Косинской. Источник: injectran.ru
Рисунок 3. Стадии остеоартроза на рентгеновском снимке: а – начальная стадия, б – стадия остеофитов, в – тяжелая стадия. Классификация Натальи Сергеевны Косинской. Источник: injectran.ru
Симптомы остеоартроза
Ведущим симптомом заболевания выступает боль в области одного или нескольких суставов.
Боль в суставах при остеоартрозе возникает:
- в начале движения – «стартовая» боль;
- в ночное время – при запущенных стадиях остеоартроза.
Боль начинается постепенно, усиливается после нагрузок и в конце дня, уменьшается в покое.
Нарушение функции суставов проявляется ограничением подвижности, хрустом, изменением походки, чувством «заклинивания» вплоть до полной невозможности движения – блокировки.
Деформация возникает за счет отека суставной сумки, разрастания остеофитов. При нарушении формы коленных суставов образуется Х- или О-образная деформация ног (рис. 4). При остеоартрозе пястно-фалангового сустава большого пальца стопы формируется пресловутая «косточка», которая уродует ногу и причиняет дискомфорт.
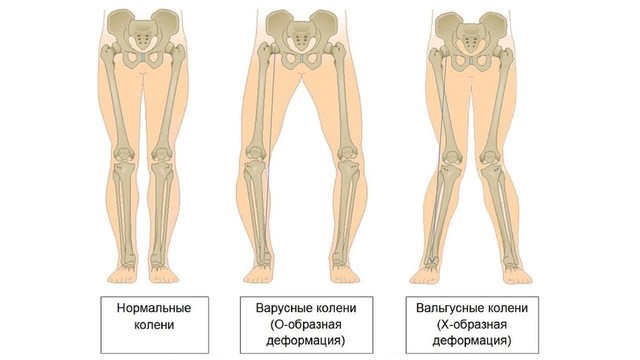 Рисунок 4. Деформация ног при остеоартрозе. Источник: СС0 Public Domain
Рисунок 4. Деформация ног при остеоартрозе. Источник: СС0 Public Domain
Диагностика
Осмотр при подозрении на остеоартроз осуществляет врач-ревматолог, в отдельных случаях может потребоваться консультация других специалистов, например, эндокринолога, хирурга, травматолога-ортопеда или инфекциониста. Диагноз ставится после анализа симптомов, осмотра, рентгенологического исследования и лабораторных тестов.
О возможности наличия артроза говорят:
- наличие характерных симптомов (боль в суставах, которая усиливается при нагрузке, скованность ощущается в основном в вечернее время),
- преклонный возраст пациента.
Дополнительные исследования требуются, чтобы исключить другие заболевания со схожими признаками, например, переломы и ревматоидный артрит.
Лечение
Лечение при остеоартрозе направлено на устранение болевого синдрома, снижение нагрузки на пораженный сустав, сохранение его подвижности и предупреждение прогрессирования патологии. Обычно лечение проводят комплексно и не требуется госпитализация пациента в стационар.
Компоненты комплексного лечения: медикаментозная терапия, местные средства (наружные с анальгетиками и противовоспалительными компонентами и введение лекарств в полость пораженного сустава), физиотерапия, массаж и ЛФК, диетотерапия, хирургическое лечение.
Медикаментозное лечение
Прием лекарственных препаратов при остеоартрозе направлен на устранение боли и нарушений метаболизма в хрящах и костной ткани (табл. 1).
| Таблица 1. Медикаментозное лечение остеоартроза. | |
| Группа препаратов | Особенности использования |
| Парацетамол | Назначают при слабой и умеренной боли без признаков воспаления. Максимальная суточная доза не должна превышать 3 г, разовая – 0,35–0,5 г. Допускается применение препарата длительностью до 2 лет. Нельзя принимать парацетамол при болезнях печени и алкогольной зависимости. |
| Нестероидные противовоспалительные средства (НПВС): диклофенак, ибупрофен, аспирин, индометацин, мелоксикам, нимесулид и др. | Назначают при воспалении суставов в минимально эффективных дозах, коротким курсом (до 14 дней). НПВС способны провоцировать появление эрозий и язв в желудке и повышать риск кровотечений. Опасны сочетания НПВС со стероидными гормонами, средствами для разжижения крови (антикоагулянтами), поскольку повышается риск желудочно-кишечных, носовых, маточных и других кровотечений. Для предупреждения таких осложнений необходимо назначать НПВС в сочетании с препаратами омепразола. Наименьшими рисками кровотечений ЖКТ обладают коксибы (рофекоксиб, целекоксиб). Для лечения только коленных и тазобедренных суставов может использоваться диацереин – НПВС, у которого есть хондропротекторное действие. В отличие от других НПВС, он применяется длительно, но частый побочный эффект препарата в виде диареи требует прекращения лечения. |
| Трамадол | Трамадол – опиоидный анальгетик строгого учета (можно приобрести только по рецепту врача). Назначают при выраженном болевом синдроме, который не устраняется приемом парацетамола и НПВС на протяжении 5–7 дней. Применяется коротким курсом – 5–7 дней. |
| Хондроитин сульфат и глюкозамин | Симптоматические средства замедленного действия. Эффект наступает на 8–12-й неделе лечения. Прием длительный – до 2 лет с перерывами на 2–4 месяца. В отличие от НПВС эти средства более безопасны и лучше переносятся пациентами. |
| Пиаскледин | Препарат для комплексного лечения остеоартроза коленных и тазобедренных суставов на любой стадии. В его составе – соединения авокадо и сои. Пиаскледин активирует выработку собственного коллагена 2 типа, стимулирует регенерацию глюкозамина, хондроитина и блокирует выработку веществ, которые вызывают разрушение хряща. Препарат применяют внутрь в капсулах по 300 мг 1 раз в сутки, длительно. |
Местные средства
Есть 2 основные методики местного лечения: введение препаратов в полость сустава и местное применение дермальных пластырей, мазей, кремов и гелей, которые содержат НПВС.
Наиболее эффективный метод лечения – введение в полость сустава глюкокортикостероидных гормонов. Они применяются только при неэффективности негормональных средств для устранения боли и купировании синовита (выпота в полость сустава). Обезболивающий эффект при внутрисуставном введении стероидов длится от 1 недели до 3 месяцев. Не рекомендуется более 2–3 инъекций в год в полость одного сустава.
Для улучшения выработки синовиальной жидкости, улучшения состояния хрящевой и костной ткани в полость сустава вводят гиалуроновую кислоту и собственную плазму, обогащенную тромбоцитами (РRР-терапия).
Эффект гиалуроновой кислоты объясняется повышением вязкости синовиальной жидкости, питания хряща, удержанием влаги в нем, стимуляцией синтеза коллагена. Нежелательные последствия применения гиалуроновой кислоты – аллергические реакции, инфекционные осложнения, короткий период действия.
Гели полимерного происхождения действуют подобно гиалуроновой кислоте, но влияние их на структуры сустава длится не менее 6–12 месяцев, аллергические реакции не возникают.
РRР-терапия заключается в получении плазмы после центрифугирования венозной крови в количестве 7–10 мл. Плазма (жидкость желтоватого цвета над сгустком крови) набирается в шприц и вводится в полость сустава (3–5 процедур с интервалом в неделю). Эффект связан с тромбоцитарными факторами роста, которые могут способствовать регенерации хряща.
Физиотерапия, массаж, гимнастика
Физиотерапия снижает лекарственную нагрузку на организм пациента, улучшает кровообращение в тканях суставов и уменьшает боль. Наиболее эффективные процедуры:
- электрофорез с НПВС, гидрокортизоном, димексидом, хлоридом кальция;
- импульсные токи низкой частоты (ДДТ);
- электромагнитные поля (УВЧ-терапия, индуктотермия);
- ультразвуковое лечение с гидрокортизоном, НПВС (фонофорез);
- аппликации озокерита, парафина, лечебных грязей;
- ванны радоновые, йодобромные, скипидарные, сульфидные.
Основные противопоказания для физиолечения – новообразования, повышение температуры, эпилепсия, перенесенные инфаркты и инсульты, нарушения сердечного ритма и наличие кардиостимулятора, психозы, заболевания крови и кровотечения, тяжелое состояние пациента.
Нужен ли массаж при остеоартрозе?
Один из источников боли и ограничения движений у пациентов с остеоартрозом – спазм околосуставных мышц. Курс массажа поможет устранить его. Массаж улучшает самочувствие за счет релаксирующего действия и уменьшения боли. Противопоказан при синовите.
Лечебная физкультура
Дозированная физическая нагрузка не реже 3 раз в неделю по 35–40 минут уменьшает боль, препятствует прогрессированию остеоартроза и атрофии околосуставных мышц, устраняет лишний вес (в комплексе с диетой). Лучше, если комплекс упражнений разработает инструктор с учетом локализации и степени остеоартроза. Предпочтительны занятия в воде и плавание, ходьба по ровной поверхности, упражнения на растяжение мышц (при отсутствии синовита).
Важно! Физическую нагрузку на пораженные суставы нужно дозировать, чтобы не вызвать обострение заболевания.
Диета
При остеоартрозе нельзя переедать, злоупотреблять солью, жирной пищей и углеводами.
Добавляйте в рацион продукты, которые содержат желатин для образования коллагена (холодец, желе, домашний мармелад), ягоды и несладкие фрукты, овощи, рыбий жир, нежирные молочные продукты.
Хирургия
При неэффективности комплекса лекарственной и физиотерапии, ЛФК, стойком болевом синдроме и необратимой деформации суставов с ограничением подвижности, пациенту могут предложить операцию по замене сустава (эндопротезирование, рис. 5).
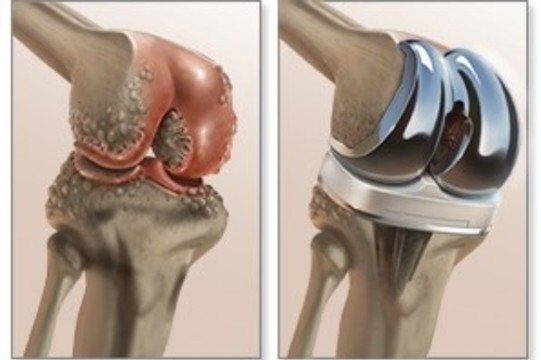 Рисунок 5. Эндопротезирование коленного сустава. Источник
Рисунок 5. Эндопротезирование коленного сустава. Источник
Эффективны ли народные способы лечения?
Народные методы лечения направлены на согревание или охлаждение тканей околосуставного аппарата, снижение отечности, рефлекторное уменьшение боли. Существуют сотни народных рецептов применения горчицы, горького перца, капусты и лопуха, петрушки, меда, скипидара. Однако эффективность этих средств сомнительна.
Прогноз
Остеоартроз – заболевание необратимое и прогрессирующее. Для жизни прогноз благоприятный, а для трудоспособности и дальнейшего самообслуживания – не всегда. На третьей стадии остеоартроза коленных или тазобедренных суставов ограничивается способность к самостоятельному передвижению, возникает необходимость использования дополнительных средств опоры (трости, костылей, ходунков).
Возможные осложнения
Заболевание грозит утратой трудоспособности и инвалидизацией.
Профилактика
Для профилактики развития и прогрессирования остеоартроза нужно следовать рекомендациям врачей. Также важно:
- Поддерживать нормальную массу тела, а при лишнем весе снижать индекс массы тела до 25 и меньше.
- Систематически заниматься физическими упражнениями без чрезмерной нагрузки на пораженные суставы – плавание, упражнения в воде, езда на велосипеде, ходьба, гимнастика в положении сидя и лежа.
- Соблюдать принципы рационального питания.
- Лечить травмы опорно-двигательного аппарата, предупреждать спортивные травмы.
Пациентам с остеоартрозом следует в повседневной жизни использовать ортопедические изделия: стельки, ортезы, наколенники при нестабильности связочного аппарата и для разгрузки пораженных суставов. Обувь нужна не сдавливающая, удобная, на широком низком каблуке.
Заместительная гормональная терапия против остеоартроза
Некоторые специалисты считают, что риск развития остеоартроза у женщин после менопаузы можно снизить с помощью заместительной гормональной терапии.
Целью такой терапии является замена утраченной гормональной функции яичников и предотвращение климактерических расстройств. В настоящее время степень влияния приема эстрогенов на развитие артроза суставов у женщин продолжают исследовать.
Заключение
Остеоартроз – распространенное заболевание, риск развития которого растет с возрастом. Если беспокоят болезненные ощущения в суставах, следует как можно скорее обратиться к врачу. На первых стадиях остеоартроз может почти не вызывать дискомфорта, однако суставы в это время уже начинают разрушаться. Чтобы снизить риск остеоартроза, необходимо следить за весом и рационом.
Источники
- О.Ю. Майко. Оценка эффективности терапии с использованием препарата хондроитина сульфата у больных остеоартрозом в амбулаторных условиях // Лечащий врач. -2019
- Michelle J. Lespasio and all. Hip Osteoarthritis: A Primer // The Permanente Journal. -2018. -№ 22. -С. 17-84. doi: 10.7812/TPP/17-084
- Kimberly Holland. Arthrosis vs. Arthritis: What’s the Difference?// Healthline. -2014
- Беневоленская Л. И., Бржезовский М. М. Эпидемиология ревматических болезней. – М.: Медицина, 1988. – 237 с. – ISBN 5-225-01653-7
Источник
Вряд ли можно получить от ревматолога какой-то другой ответ на вопрос, какой диагноз на амбулаторном приеме он ставит чаще всего, кроме как диагноз остеоартроза (ОА). О том, что это один из самых часто выставляемых диагнозов, можно услышать и от врачей общей практики, ортопедов, хирургов, неврологов. Действительно, именно ОА – самое часто регистрируемое заболевание суставов независимо от популяции (примерно 4 из 5 больных ревматическими заболеваниями – больные ОА). ОА – заболевание, основу которого составляет поражение всех компонентов сустава, включая хрящ, субхондральную кость, синовиальную оболочку, связки, капсулы, окружающие сустав мышцы. Основной клинический признак заболевания – боль, которая вкупе с постепенно формирующейся деформацией суставов приводит к нарушению их функции и, как следствие, к инвалидизации. Особенно часто, в т.ч. по данным эпидемиологических исследований, проведенных в России, поражаются коленные и тазобедренные суставы, вовлечение которых является основной причиной снижения качества жизни и развития нетрудоспособности [1]. Социальную значимость ОА может подчеркнуть тот факт, что только в США ежегодно проводится около 250 тыс. операций по эндопротезированию тазобедренных суставов и около 500 тыс. подобных операций на коленных суставах, причем потребность в них неуклонно растет [2].
Независимо от наличия или отсутствия факторов риска (как правило, у больного выявляются одновременно несколько факторов риска ОА: например, пожилой возраст, женский пол при ОА коленных суставов, наследственная предрасположенность, травмы, профессиональные занятия спортом, ожирение, различные заболевания, например, сахарный диабет или гипотиреоз) лечение заболевания проводится по схожим принципам и преследует 2 основные цели: уменьшение боли и предотвращение развития функциональной недостаточности суставов (при ее нарушении – восстановление их функции).
Существующие рекомендации по лечению ОА основываются на оптимизации симптоматической терапии заболевания и включают в себя немедикаментозное лечение: увеличение физической активности, снижение массы тела, коррекцию плоскостопия, разгрузку суставов при помощи ортезов и трости и т.д., что может привести к уменьшению интенсивности боли. Но, к сожалению, часто этого недостаточно, и возникает потребность в медикаментозном лечении.
До настоящего времени препараты, способные полностью остановить прогрессирование ОА, не разработаны, а средства, обладающие свойством замедлять процессы деструкции хондроцитов, не всегда могут существенно уменьшить основные симптомы болезни (боль и воспаление) даже при длительном применении. Эти препараты классифицируются как медленно действующие препараты, модифицирующие симптомы болезни (влияние на клинические проявления ОА, прежде всего на боль, может быть достигнуто не раньше чем через несколько недель, а то и месяцев от начала терапии), хотя предполагается, что они обладают и структурно-модифицирующим эффектом. Поэтому одним из основных медикаментозных методов лечения ОА остается применение препаратов, эффект которых позволяет быстро уменьшить боль и симптомы воспаления. К препаратам первой линии медикаментозной терапии ОА относят, таким образом, анальгетики (парацетамол) и нестероидные противовоспалительные препараты (НПВП).
Парацетамол имеет как ряд преимуществ (минимальное в сравнении с действием НПВП влияние на желудочно-кишечный тракт (ЖКТ) и сердечно-сосудистую систему), так и ряд ограничений, осложняющих его применение при ОА. С одной стороны, эффективность парацетамола при назначении больным с легкой или умеренной болью была показана довольно давно, но с другой, анальгетическое действие парацетамола уступает таковому НПВП [3, 4]. В связи с этим интересны данные недавно проведенного метаанализа, демонстрирующего, что применение парацетамола у больных ОА ни в отношении аналгезии, ни в отношении функциональной активности, ни в отношении скованности суставов не было клинически значимым [5].
Следует отметить, что безопасность парацетамола в отношении ЖКТ не абсолютна. Применение препарата в дозе 3 г/сут увеличивает независимый относительный риск госпитализаций, обусловленный перфорацией или язвенным кровотечением, в 1,2 раза [5]. Наибольшего эффекта у взрослых парацетамол достигает в дозе 1000 мг, и дальнейшее ее увеличение не усиливает аналгезию, но увеличивает токсичность [6], при этом длительность аналгетического действия составляет всего 3–4 ч, что предопределяет необходимость приема препарата несколько раз в день. Однако терапевтическое окно у препарата очень узкое, и даже небольшая передозировка может привести к развитию побочных эффектов, включая тяжелые поражения печени и почек, особенно если передозировка происходит неоднократно [7–9]. Это обусловлено действием метаболитов парацетамола, образующихся в печени и почках, которые могут накапливаться при его передозировке, вызывая повреждения тканей. Риск поражения печени при приеме парацетамола многократно возрастает при употреблении алкоголя, недостатке глутатиона любого генеза, параллельном приеме ряда препаратов, метаболизируемых при помощи ферментов цитохрома P450 (карбамазепин, барбитураты, фентонин и многие другие). В этих случаях для развития поражения печени может быть достаточно даже минимальных доз препарата.
НПВП больным ОА рекомендуется назначать максимально короткими курсами с целью купирования боли при недостаточной эффективности аналгетиков (парацетамол), наличии экссудативных явлений и скованности в суставах. И выбор в пользу НПВП при назначении симптоматической терапии ОА часто бывает безальтернативным. Как и при ОА, НПВП широко используются при лечении неспецифических болей в спине. Эффективность применения НПВП имеет максимальный уровень доказательности в сравнении с эффективностью других методов терапии.
Лечение боли при ОА должно быть первостепенной задачей не только исходя из необходимости улучшения качества жизни, социальной адаптации, восстановления сниженных функциональных возможностей. Доказано, что хроническая боль является практически при любых заболеваниях фактором, влияющим негативно на продолжительность жизни, в т.ч. и у больных ОА, причем боль при ОА даже более опасна, чем при тяжелых коморбидных заболеваниях [10, 11]. Можно предположить, что адекватное обезболивание может уменьшать такие ассоциации, но при этом прием любого НПВП сопряжен с рисками развития побочных эффектов. Естественно, что принципиально важным является назначение лекарственных препаратов, обеспечивающих достаточный анальгетический и противовоспалительный эффекты при максимально хорошей переносимости, тем более что при ОА индивидуальные различия в эффективности НПВП встречаются довольно часто.
Основное терапевтическое действие НПВП обусловлено блокадой ферментов циклооксигеназы-1 (ЦОГ-1) и циклооксигеназы-2 (ЦОГ-2), что приводит к снижению синтеза простагландинов, индуцирующих развитие воспаления. Механизмы действия всех НПВП схожи, считается, что и эффективность отдельных препаратов сопоставима, тем не менее далеко не все исследования это подтверждают. Например, по данным M. Bianchi, применение нимесулида больными ОА приводило к более выраженному и быстрому аналгетическому эффекту, чем применение целекоксиба [12]. Авторы статьи показали, что причиной этого могут быть эффекты нимесулида, не связанные с ЦОГ. Оказалось, что, как после однократного, так и после повторного приема, под действием нимесулида существенно снижалась концентрация в синовиальной жидкости субстанции Р и интерлейкина-6 (ИЛ-6), а при приеме целекоксиба отмечалось только снижение уровня ИЛ-6 и лишь на 14-й день терапии. Переносимость препаратов не отличалась и была оценена как хорошая. Нимесулид, назначаемый в дозе 100 мг/сут в течение 7-ми дней больным ОА коленных суставов, превосходил по выраженности аналгетического эффекта целекоксиб (200 мг/сут) и рофекоксиб (25 мг/сут) [13]. Опрос, проведенный по завершении исследования, показал, что больные, принимавшие нимесулид и рофекоксиб, согласны были использовать эти препараты и дальше, среди больных, принимавших целекоксиб, желающих продолжать прием было меньше.
Влияние НПВП на хрящ также может быть разным – например, нимесулид, в отличие от индометацина, не оказывает на него повреждающего действия и даже способен ингибировать коллагеназу в синовиальной жидкости [14, 15]. В другом сравнительном исследовании (препарат сравнения – напроксен) была показана способность препарата ингибировать синтез ИЛ-6, фактор некроза опухоли-α и фермент урокиназы, что может быть важными факторами, уменьшающими деградацию хряща [16]. Наконец, нимесулид способен подавлять продукцию супероксидных анионов и оказывать антиоксидантное действие, что является благоприятным фактором, влияющим на хрящ [17].
Короткий курс терапии нимесулидом был эффективнее, чем курс диклофенака при ОА коленных суставов, по данным Q. Gui-Xin et al., при лучшем профиле безопасности нимесулида [18]. Сравнение 10-дневного курса терапии ибупрофеном, принимаемым в дозе 1800 мг/сут, и нимесулидом (200 мг/сут) при болях в нижней части спины продемонстрировало, что прием и того, и другого препарата приводил к купированию боли в большинстве случаев, но прием нимесулида характеризовался лучшим эффектом при более редких случаях развития нежелательных явлений (при применении нимесулида они регистрировались в 1,5 раза реже) [19]. Показано, что при лечении боли в нижней части спины, причиной которой нередко бывает спондилоартроз, с успехом можно применять различные НПВП, но переносимость при приеме препаратов с преимущественным подавлением ЦОГ-2 (нимесулид, коксибы) намного лучше, а частота нежелательных явлений – ниже, чем у неселективных к ЦОГ-2 препаратов [20].
Но именно небезупречная безопасность НПВП является основной проблемой, возникающей при их назначении. Результаты небольших рафинированных сравнительных исследований в отношении рисков развития нежелательных явлений при приеме НПВП не всегда могут отражать реальную картину, потому особый интерес представляет анализ крупных баз данных. Одно из наиболее значительных подобных исследований было проведено на основании анализа огромной базы данных (около 1,2 млн человек), включавшей всех жителей одного из районов Италии [21]. В исследуемую группу включали всех жителей, постоянно проживавших в районе не менее 1 года, которым были назначены различные НПВП в период с 2001 по 2008 г. включительно. Принципиально важно, что из исследования не исключали какие-либо группы больных. Каждого участника наблюдали от начала приема НПВП до наступления конечной точки – госпитализации по причине развития осложнений со стороны верхних отделов ЖКТ. В анализ, проведенный методом «случай – контроль», было включено 2735 пациентов с осложнениями со стороны верхних отделов ЖКТ (в 86,9% случаев это было кровотечение) и 27 011 пациентов, составивших группу контроля, в возрасте 20–89 лет. Проведение логистической регрессии показало, что при применении всего трех препаратов (нимесулида, целекоксиба и эторикоксиба) относительный риск развития осложнений был меньше (2,0): например, относительный риск язвенного кровотечения при применении нимесулида был в 2 раза меньше, чем при приеме диклофенака и ибупрофена.
Еще одним потенциально опасным явлением, связанным с приемом НПВП, является поражения печени. Данные статистики свидетельствуют, что подобные осложнения развиваются крайне редко, но, учитывая, что они могут приводить к внутрипеченочному холестазу и острой почечной недостаточности, заслуживают отдельного обсуждения. Наиболее крупное эпидемиологическое исследование, основанное на сравнительной оценке рисков гепатотоксичности отдельных НПВП показало, что суммарный относительный риск развития гепатопатий был равен 1,4, а индивидуальная частота разнилась довольно широко: для нимесулида она составила 35,3 на 100 тыс. человеко-лет, а для ибупрофена – 44,6 [22]. По другим данным поражения печени развиваются не чаще, чем у 1 из 10 тыс. больных, принимающих нимесулид [23]. Не меняет отношения к гепатоксичности нимесулида и подробный анализ последних данных, опубликованных в обзоре, посвященном 25-летию нимесулида, где приводятся факты, подтверждающие, что гепатотоксичность препарата не отличается от таковой у других НПВП [24]. Интересно, что и попытки замены нимесулида на другие НПВП не только не способствовали снижению риска гепатотоксичности, но и привели к выраженному росту случаев желудочно-кишечных кровотечений [25].
Комбинированная терапия боли при ОА может включать также физиолечение, в т.ч. местное применение тепловых и холодовых процедур, чрескожную стимуляцию, санаторно-курортное лечение, лечебную физкультуру, локальную терапию (мази и гели с НПВП, используемые коротким курсом, «отвлекающие» мази, например, с капсаицином). Большое значение может иметь динамическое наблюдение врачом больного. Иногда, при превалировании сопутствующих мышечно-тонических синдромов, применяют миорелаксанты центрального действия, при наличии стойкого синовита возможно (при отсутствии противопоказаний) использование локальных инъекций глюкокортикоидов.
Остается надеяться, что возможности терапии боли при ОА, включая НПВП нимесулид (Найз®), физиотерапию, будут расширяться, и течение заболевания без лечения, а также необходимость проводить хирургическое вмешательство останутся в прошлом.
Литература
1. Галушко Е.А., Большакова Т.Ю., Виноградова И.Б. и др. Структура ревматических заболеваний среди взрослого населения России по данным эпидемиологического исследования // Научно-практическая ревматология. 2009. № 1. С. 11–17.
2. Kim S. Changes in surgical loads and economic burden of hip and knee replacements in the US: 1997–2004 // Arthritis Rheum. 2008. Vol. 59. Р. 481–488.
3. Bradley I.D., Brandt K.D., Katz B.P. et al. Comparison of an antiinflammatory dose of ibuprofen. an analgesic dose of ibuprofen, and acetaminophen in the treatment of patients with osteoarthritis of the knee// N Engi J Med. 1991. Vol. 325. Р. 87–91.
4. Towheed T.E., Maxwell L., Judd M.G. et al. Acetaminophen for osteoarthritis. Cochrane Database Syst Rev. 2006 Jan 25. Vol. 1. CD004257.
5. Zhang W., Nuki G., Moskowitz R.W. et al. OARSI recommendations for the management of hip and knee osteoarthritis: part III: Changes in evidence following systematic cumulative update of research published through January 2009 // Osteoarthritis Cartilage. 2010. Vol. 18 (4). Р. 476–499.
6. Skoglund L.A., Skjelbred P., Fyllingen G. Analgesic efficacy of acetaminophen 1000 mg, acetaminophen 2000 mg, and the combination of acetaminophen 1000 mg and codeine phosphate 60 mg versus placebo in acute postoperative pain // Pharmacotherapy. 1991. Vol. 11. Р. 364–369.
7. Schiodt F.V., Rjehling F.A., Casey D.L., Lee W.M. Acetominophen toxicity m an urban country hospital // N Engi J Med. 1997. Vol. 337. Р. 1112–1117.
8. Larson A.M., Polson J., Fontana R.J., Davern T.J., Lalani E., Hynan L.S., Reisch J.S., Schiodt F.V., Ostapowicz G., Shakil A.O., Lee W.M. Acetaminophen-induced acute liver failure: results of a United States multicenter, prospective study // Hepatology. 2005. Vol. 42. Р. 1364–1372.
9. Craig D.G.N., Bates C.M., Davidson J.S. Martin K.G., Hayes P.C., Simpson K.J. Staggered overdose pattern and delay to hospital presentation are associated with adverse outcomes following paracetamol-induced hepatotoxicity // Br J Clin Pharmacol. 2011. Vol. 73 (2). Р. 285–294.
10. Torrance N., Elliott A.M., Lee A.J., Smith B.H. Severe chronic pain is associated with increased 10 year mortality. A cohort record linkage study // Eur J Pain. 2010. Vol. 14 (4). Р. 380–386.
11. Pincus T., Sokka T. Abstract presented during the American College of Rheumatology. 2005, Scientific Sessions. San Diego, California.
12. Bianchi M., Broggini M., Balzarini P. et al. Effects of nimesulide on pain and synovial fluid concentrations of substance P, interleukin-6 and interleukin-8 in patients with knee osteoarthritis: comparison with celecoxib // Int J Clin Pract. 2007 Aug. Vol. 61 (8). Р. 1270–1277.
13. Bianchi M., Broggini M. A randomised, double-blind, clinical trial comparing the efficacy of nimesulide, celecoxib and rofecoxib in osteoarthritis of the knee // Drugs. 2003. Vol. 63. Suppl 1. Р. 37–46.
14. Barracchini A., Franceschini N., Amicosante G. et al. Can non-steroidal anti-inflammatory drugs act as metalloproteinase modulators? An in-vitro study of inhibition of collagenase activity // J. Pharm. Pharmacol. 1998. Vol. 50. Р. 1417–1423.
15. Hentrotin Y.E., Labasse A.H., Simonis P.E. et al. Effects of nimesulide and sodium diclofenac on interleukin-6, interleukin-8, proteoglycans and prostaglandin E2 production by human articular chondrocytes in vitro // Clin. Exp. Rheumatol. 1999. Vol. 17.Р. 151–160.
16. Pelletier J.P., Mineau F., Fernandes J.C. et al. Two NSAIDs, nimesulide and naproxen, can reduce the synthesis of urokinase and IL-6 while increasing PAI-1, in human OA synovial fibroblasts // Clin Exp Rheumatol. 1997. Vol. 15. Р. 393–398.
17. Bennett A. Overview of nimesulide // Rheumatology. 1999. Vol. 38 (Suppl 1). Р. 1–3.
18. Gui-Xin Q., Macciocchi A. Trial on the efficacy and tolerability of nimesulide versus diclofenac in the treatment of osteoarthritis of the knee // Helsinn Healthcare. 1997. Report No. TSD 7530.
19. Pohjolainen T., Jekunen A., Autio L., Vuorela H. Treatment of acute low back pain with the COX–2–selective anti–inflammatory drug nimesulide: results of a randomized, double–blind comparative trial versus ibuprofen // Spine. 2000. Vol. 25 (12). Р. 1579–1585.
20. Aho M., Kokki H., Nikanne E. Nimesulide versus ibuprofen for postoperative tonsillectomy pain // Clin Drug Invest. 2003. Vol. 23 (10).
21. J. Castellsague, Pisa F., Rosolen V. Risk of upper gastrointestinal complications in a cohort of users of nimesulide and other nonsteroidal anti-inflammatory drugs in Friuli Venezia Giulia, Italy // Pharmacoepidemiol Drug Saf. 2013. Vol. 22 (4). Р. 365–375.
22. Traversa G., Bianchi C., Da Cas R. et al. Cohort study of hepatotoxity associated with nimesulide and other non-steroidal anti-inflammatory drugs // BMJ. 2003. Vol. 327. P. 18–22.
23. Boelsterli U. Nimesulide and hepatic adverse affects: roles of reactive metabolites and host factors // Int. J. Clin. Pract. 2002. Suppl. 128. P. 30–36.
24. Mattia C., Ciarcia S., Muhindo A., Coluzzi F. Nimesulide: 25 years later // Minerva Med. 2010. Vol. 101 (4). P. 285–293.
25. Venegoni M., Da Cas R., F. Menniti-Ippolito, Traversa G. Effects of the European restrictive actions concerning nimesulide prescription: a simulation study on hepatopathies and gastrointestinal bleedings in Italy // Ann Ist Super Sanità. 2010. Vol. 46 (2). Р. 153–157.
Источник
