Синдром множественных эндокринных неоплазий 1 типа
В статье представлен клинический случай синдрома множественной эндокринной неоплазии 1-го типа
Синдром множественной эндокринной неоплазии (МЭН) – генетически детерминированная патология с аутосомно-доминантным типом наследования, проявляющаяся доброкачественными или злокачественными опухолями (гиперплазией) двух и более эндокринных желез [1–3]. Синдром МЭН характеризуется высокой степенью пенетрантности, которая к 20-летнему возрасту составляет 50%, к 40 годам – 95% [4, 5]. Риск развития синдрома МЭН в семьях с данной патологией составляет около 75%. В 50% случаев синдром развивается спорадически, т. е. обусловлен вновь возникшей (de novo) мутацией в половых или соматических клетках. Риск развития синдрома МЭН у ребенка со спорадической формой составляет 50%.
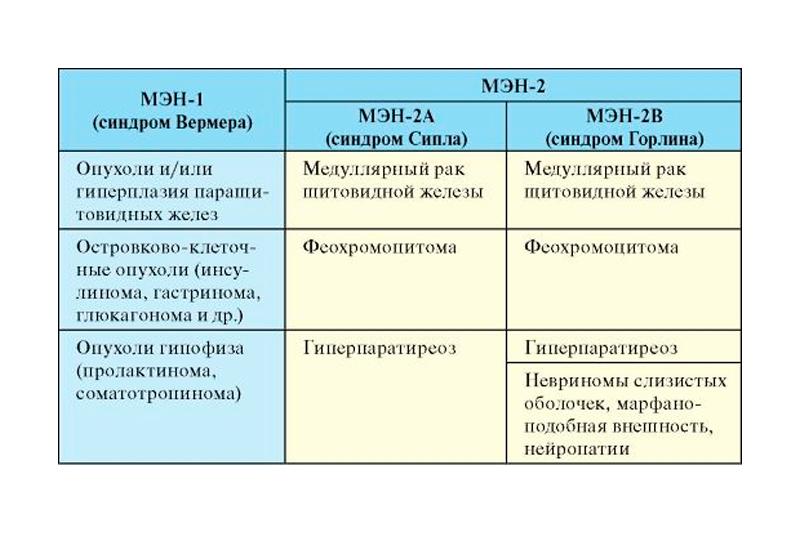
Выделяют несколько типов синдрома МЭН, которые отличаются генетической основой, локализацией и сочетанием поражения внутренних органов. Синдром МЭН 1–го типа (МЭН1) – синдром Вермера – наиболее часто характеризуется наличием патологии околощитовидных желез (гиперплазии или аденомы), нейроэндокринной опухолью (НЭО) поджелудочной железы и опухолью аденогипофиза. Для синдрома МЭН 2-го типа характерно наличие медуллярного рака щитовидной железы как постоянного признака, сочетание которого с феохромоцитомой и паратиромой относят к синдрому МЭН 2А типа (синдром Сиппла), а при сочетании феохромоцитомы с множественными ганглионейромами слизистой оболочки желудочно-кишечного тракта – МЭН 2Б типа (синдром Горлина). Различают также синдром МЭН 4-го типа, который характеризуется наличием паратиромы, опухолей аденогипофиза, репродуктивных органов, почек и надпочечников [6, 7].
Синдром МЭН1 наследуется аутосомно-доминантно, но может возникать и спорадически. Распространенность синдрома составляет до 15–30 случаев на 100 000 населения [8]. Причиной развития синдрома является мутация в гене – супрессоре опухолей, расположенном на 11-й хромосоме (11q13). Ген кодирует белок менин, регулирующий пролиферацию клеток. Синдром МЭН1 чаще манифестирует в молодом возрасте (20–25 лет) первичным гиперпаратиреозом, который характеризуется более мягким течением, при этом высокой частотой рецидивов после паратиреоидэктомии (50% от 8 до 12 лет после операции) и морфологически проявляется гиперплазией трех или четырех паращитовидных желез [1]. Первичный гиперпаратиреоз выявляется в 90% случаев синдрома МЭН1 к 40 годам.
В 30–80% случаев синдрома МЭН1 встречаются энтеропанкреатические опухоли, вырабатывающие различные гормоны: соматостатин, грелин, вазоактивный интестинальный пептид, серотонин, кальцитонин, нейротензин, гастрин, хромогранин А или Б, инсулин, проинсулин, глюкагон. Они характеризуются мультицентрическим ростом, чаще манифестируют после 40 лет.
Опухоли гипофиза при синдроме МЭН1 в 2 раза чаще встречаются у мужчин, чем у женщин. Среди опухолей гипофиза при синдроме МЭН1 наиболее часто встречаются пролактиномы (60%), а также опухоли, секретирующие гормон роста (25%). Реже встречаются макроаденомы, которые характеризуются агрессивным ростом и низкой чувствительностью к терапии. Менее чем в 5% случаев встречаются нефункциональные опухоли, кортикотропиномы [2].
При синдроме МЭН1 также могут диагностироваться опухоли, расположенные в бронхах и тимусе. Опухоли тимуса чаще являются нефункциональными, характеризуются агрессивным ростом и преимущественно встречаются у курильщиков [3]. У женщин чаще наблюдаются карциноиды бронхов, которые могут секретировать соматостатин, серотонин, кортикотропин и гормон роста. Липомы при синдроме МЭН1 могут располагаться подкожно, ретроперитонеально, висцерально и плеврально [4]. У 20–40% больных встречаются опухоли надпочечников, чаще всего доброкачественные (аденомы, диффузная или узловая гиперплазия) и гормонально неактивные [4].
Ожидаемая продолжительность жизни больных с синдромом МЭН1 снижена. Благоприятный прогноз имеется при раннем выявлении синдрома и своевременном лечении, что предотвращает инвалидизацию. У больных с множественными злокачественными опухолями (глюкагономой, инсулиномой, випомой, гастриномой) прогноз хуже. Смертность составляет 50% у больных старше 50 лет, примерно в половине случаев – вследствие злокачественных НЭО и карциноидных опухолей тимуса [5, 9]. В связи с этим очень важно наблюдение пациентов специалистами различного профиля (гастроэнтерологов, онкологов, хирургов-эндокринологов, радиологов, генетиков), имеющих опыт лечения данного заболевания.
Клинический случай
Больная М., 35 лет, в 2016 г. обратилась к кардиологу консультативно-диагностического отделения МОНИКИ им. М.Ф. Владимирского в связи повышением артериального давления максимально до 200/100 мм рт. ст., которое стало отмечаться с 20-летнего возраста. При лабораторном обследовании впервые была выявлена гиперкальциемия, больную направили на консультацию к эндокринологу. При проведении лабораторных исследований для уточнения наиболее вероятных причин гиперкальциемии отмечалось повышение паратгормона (ПТГ) до 69,6 пг/мл (референсные значения 15,0–65,0) и 10,1 пмоль/л (реф. зн. 1,26–7,58). При двухкратном повторном исследовании общего кальция крови было подтверждено его повышение до 2,63 и 2,69 ммоль/л (реф. зн. 2,10–2,55), а также выявлено снижение неорганического фосфора до 0,64 ммоль/л (реф. зн. 0,87–1,45). В биохимическом анализе крови исследовались общий белок, альбумин, щелочная фосфатаза, уровень которых был в пределах референсных значений, а также креатинин – 72 мкмоль/л (реф. зн. 44–80) с расчетом скорости клубочковой фильтрации по формуле Коккрофта – Голта, которая составила 93 мл/мин. Также при определении кальция в суточной моче была отмечена гиперкальциурия – 8,8 ммоль/сут (реф. зн. 0–6,2). У больной диагностирован первичный гиперпаратиреоз.
У пациентки исследован витамин D сыворотки крови 25(ОН)D, уровень которого составил 18,9 нг/мл, что говорит о его дефиците. Несмотря на наличие легкой гиперкальциемии, под контролем общего кальция крови и ПТГ был назначен препарат колекальциферола в стандартной насыщающей дозе 7000 МЕ/сут курсом 8 нед. После восполнения дефицита витамина D (до 31,3 нг/мл) показатели кальция крови и ПТГ оставались в исходных пределах.
Дальнейшее обследование с применением инструментальных методов диагностики было направлено на поиск возможных костных и висцеральных проявлений первичного гиперпаратиреоза и визуализацию паращитовидных желез.
Была проведена двухэнергетическая рентгеновская абсорбциометрия, при которой выявлено незначительное снижение минеральной плотности кости (по Z-критерию) по сравнению с возрастной нормой только в проксимальном отделе бедра – 1,4SD (neck), при отсутствии в анамнезе переломов и деформаций скелета. При эзофагогастродуоденоскопии диагностированы дистальный катаральный эзофагит и гастродуоденит. В проекции хвоста поджелудочной железы выявлено гипоэхогенное округлое образование неоднородной структуры размером 10×8 мм по данным ультразвукового исследования брюшной полости и почек. Компьютерная томография органов брюшной полости и забрюшинного пространства с контрастированием также выявила объемное образование в хвосте поджелудочной железы, размеры которого составили 14,5×14,5×15 мм, кроме этого были отмечены признаки гиперплазии левого надпочечника.
Ультразвуковое исследовании щитовидной и паращитовидных желез показало наличие гипоэхогенного округлого образования с четкими контурами размером 6×4×4 мм позади нижнего полюса левой доли щитовидной железы, что трактовалось как вероятное образование левой нижней паращитовидной железы, требующее дифференцирования с лимфатическим узлом. На мультиспиральной компьютерной томографии шеи и средостения с контрастированием вдоль задне-нижнего контура левой доли щитовидной железы также выявлено образование неправильной округлой формы размером 6,0×6,1 мм, что было расценено как вероятная аденома паращитовидной железы. В переднем средостении, кпереди от восходящей части аорты и легочного ствола, определялось мягкотканное образование неправильной округлой формы с четкими контурами, не реагирующее на контрастное усиление, размером 17×40×21 мм, прилежащее к восходящему отделу аорты и легочному стволу. При сцинтиграфии с однофотонной эмиссионной томографией шеи и средостения определялся очаг гиперфиксации радиофармпрепарата по заднему контуру левой доли щитовидной железы на уровне ее нижней трети, что расценено как аденома левой нижней околощитовидной железы.
Учитывая молодой возраст больной, подтвержденный первичный гиперпаратиреоз, а также выявленное образование поджелудочной железы, было высказано предположение о наличии синдрома МЭН1 и рекомендовано скрининговое обследование родственников первой линии родства. Проведены диагностические тесты для исключения первичного гиперпаратиреоза как наиболее частого проявления предполагаемой наследственной патологии. У матери выявлено повышение общего кальция до 3,09 ммоль/л (реф. зн. 2,1–2,55) и ПТГ 78,4 пг/мл (реф. зн. 12–65); у родного брата – кальций ионизированный составил 1,22 ммоль/л (реф. зн. 1,03–1,23), ПТГ – 6,91 пмоль/л (реф. зн. 1,6–6,9). В настоящее время проводится дальнейшее обследование родственников.
Продолжено обследование больной для исключения гормональной активности выявленного образования поджелудочной железы, гиперфункции коры надпочечников, а также других возможных проявлений синдрома МЭН1 при отсутствии каких-либо специфических жалоб и симптомов. При магнитно-резонансной томографии гипофиза с контрастированием патологии не выявлено. Несмотря на это, гормональное обследование включило определение гормонов аденогипофиза: адренокортикотропного гормона, тиреотропного гормона, пролактина, а также инсулиноподобного фактора 1 (ИРФ-1), кортизола крови – отклонений от референсных значений не выявлено. Указание на подъем артериального давления и вероятная гиперплазия надпочечника послужили показанием к исследованию уровня альдостерона крови и активности ренина плазмы с расчетом альдостерон-ренинового соотношения, а также метилированных катехоламинов в суточной моче (метанефрина и норметанефрина). Повышения данных параметров не выявлено. Уровень исследованного хромогранина А также был в пределах нормальных значений, другие маркеры НЭО по техническим причинам не определялись. Отсутствие отклонений исследуемых лабораторных параметров позволило в настоящее время исключить гормональную активность образования поджелудочной железы и гиперфункцию коры надпочечников.
В дальнейшем больной было проведено генетическое исследование методом полимеразной цепной реакции (ПЦР) в Эндокринологическом научном центре. По результатам ДНК-диагностики (ПЦР, прямое секвенирование экзонов 2–10 гена MEN1) выявлена гетерозиготная замена с.1261Т>С:р.С421R. Мутация в том же кодоне описана при синдроме МЭН1, однако конкретная мутация ранее не была описана.
Таким образом больной был поставлен диагноз: «Множественная эндокринная неоплазия 1-го типа. Первичный гиперпаратиреоз, мягкая форма. Аденома левой нижней околощитовидной железы. Гормонально неактивное образование поджелудочной железы. Образование переднего средостения».
Следует отметить наличие у больной осложненного акушерско-гинекологического анамнеза. Первая неразвивающаяся беременность была прервана на сроке 5 нед. гестации в возрасте 29 лет. Вторая беременность в 32 года завершилась экстренным оперативным вмешательством путем кесарева сечения на сроке 24–25 нед. в связи с тяжелой преэклампсией. Было рекомендовано проведение генотипирования, по результатам которого выявлен полиморфизм, ассоциированный со снижением фибринолитической активности и риском тромбозов в гетерозиготной форме SERPINE1: 4G/5G (PAI1:4G/5G4; Ins/Del G) и полиморфизм, предрасполагающий к тромбозам в гетерозиготной форме MTHFR: C677T (Ala222Val).
Обсуждение
Молодой возраст является одним из абсолютных показаний к оперативному лечению первичного гиперпаратиреоза. Однако неоднозначность современных подходов относительно объема хирургического вмешательства на паращитовидных железах у больных с синдромом МЭН1 и мягкое течение гиперпаратиреоза у данной больной позволили придерживаться в настоящее время консервативной тактики ведения. Возможное планирование беременности должно послужить поводом для повторного решения вопроса о необходимости оперативного лечения в связи с риском утяжеления гиперкальциемии, а сочетание с выявленной генетической предрасположенностью к тромбообразованию требует всестороннего дальнейшего наблюдения с участием специалистов различного профиля.
Заключение
Данное клиническое наблюдение свидетельствует о важности скринингового исследования общего кальция крови при наличии неспецифических проявлений первичного гиперпаратиреоза. Молодой возраст больных с подтвержденным диагнозом первичного гиперпаратиреоза, в особенности сочетающегося с плохо контролируемым течением артериальной гипертензии, является безусловным поводом для проведения диагностического поиска синдрома множественной эндокринной неоплазии. Выявленная мутация гена MEN1 у представленной больной, возможно, способствует менее агрессивному течению заболевания. Выбранная консервативная тактика ведения должна сопровождаться активным динамическим контролем за развитием клинической картины для своевременной оценки показаний к оперативному лечению.
Источник
Синдром множественных эндокринных неоплазий — это группа патологий наследственного характера, при которой развиваются новообразования или гиперпластические изменения эндокринных желез. Совокупность клинических проявлений эндокринных изменений зависит от типа данного синдрома: при МЭН 1 поражаются поджелудочная железа, паращитовидные железы и передняя доля гипофиза; в случае развития МЭН 2А типа — надпочечники и щитовидная железа; при 2В типе МЭН — надпочечники, щитовидная железа, паращитовидные железы и слизистые оболочки. Подразделение типажей является достаточно условным, поскольку они часто пересекаются. Неоплазии могут проявляться
Содержание статьи:
- Множественные эндокринные неоплазии 1 типа
- Множественные эндокринные неоплазии 2А и 2В типов
- Прогноз при синдроме множественных эндокринных неоплазий

Множественные эндокринные неоплазии 1 типа
Характеристика МЭН 1 типа
Совокупность патологических процессов, поражающих переднюю долю гипофиза, паращитовидные железы и поджелудочную железу носят название синдрома Вермера, исходя из имени автора, который впервые описал данное заболевание в 1954г. Чаще всего развивается гиперпаратиреоз — у 90% больных, функционально активные аденомы поджелудочной железы — у 80% случаев и аденомы гипофиза — в 65% случаев. Выделяют спорадические и наследственные формы МЭН 1. Поражения щитовидной железы могут быть в виде коллоидного зоба, аденомы, тиреоидного рака, хронического лимфоцитарного тиреоидита или тиреотоксикоза. Патологические изменения надпочечников обычно представлены аденомами или гиперплазией. Реже встречаются полипы желудка, липомы, опухоли яичек, рак легкого.
Причины МЭН 1 типа
Основная масса случаев развития МЭН 1 типа — это генетически детерминированные патологии, имеющие аутосомно-доминантный тип наследования. Ученые считают, что МЭН 1 типа имеет прямую взаимосвязь с наследованием локуса IIqI3 на XI хромосоме. Для наследственной формы свойственны мутации как в соматических, так и в герминативных клетках, для спорадической — исключительно в соматических. Существует вероятность развития неоплазий нейроэктодермальных клеток, что дает возможность предположения наличия патогенетической связи родственных эктопических гормональных синдромов с МЭН-синдромами.
Очень часто при множественных эндокринных неоплазиях 1 типа нет одновременного проявления всех признаков.
Симптомы МЭН 1 типа
Первым из симптомов множественных эндокринных неоплазий является гиперпаратиреоз, который, как правило, проявляет первые признаки в возрасте около 25-30 лет. На раннем этапе пациенты ощущают тошноту, снижение аппетита, запоры, снижение веса, в некоторых случаях — почечные колики, спровоцированные отложением мелких конкрементов и солей. По мере нарастания симптомов отмечается мышечная слабость проксимальных отделов конечностей, ухудшение памяти, болевые ощущения в костях, полидипсия, полиурия и депрессивные состояния. Иногда при гиперпаратиреозе, развившемся на фоне МЭН 1, возникают судороги и коматозные состояния.
По сравнению с первичным гипапаратериозом, гипапаратериоз при МЭН 1, имеет достаточно мягкое течение. В редких случаях развивается ободковый кератит, кальцификация ушных раковин, хондрокальциноз и др. Множественным эндокринным неоплазиям 1 типа достаточно свойственно явление компрессионных переломов позвонков и остеопороза.
Виды аденом гипофиза при МЭН 1
При МЭН 1 типа аденомы гипофиза могут быть представлены такими видами: соматотропиномами, пролактиномами, кортикотропиномами. Пролактиномы могут стать причиной гиперпролактинемического гипогонадизма, клиническим проявлением которого является галакторея, дисменорея, женское бесплодие и гинекомастии у мужчин. Кортикотропиномы провоцируют развитие болезни Иценко-Кушинга, иногда могут стать причиной гипопитуитаризма. Наличие соматотропиномы приводит к развитию акромегалии, миастении, снижению памяти и часто сопровождается он головными болями.
Среди множественных эндокринных неоплазий 1 типа, поражающих поджелудочную железу, чаще всего встречаются випомы, гастриномы и инсулиномы, реже — соматостатиномы и глюкагономы и др.
Часто инсулиномы имеют множественный характер. Злокачественные инсулиномы встречаются в 3-6% случаев. Клиническим признаком инсулиномы является развитие гипогликемического синдрома. После инсулиномы второй по частоте опухолью поджелудочной железы при синдроме МЭН 1, выступает гастринома. Гастриномы проявляются развитием синдрома Золлингера-Эллисона. Випома относится к числу гормонально-активных опухолей АПУД-системы, которая производит гиперсекрецию вазоактивного интестинального полипептида и вызывает интермиттирующую или постоянную диарею, гипотонию, стеаторею, обезвоживание и кожные высыпания.
Диагностика МЭН 1 типа
Диагноз МЭН 1 типа считается достоверным при наличии не менее 2-х составляющих данного синдрома.
Лабораторная диагностика может выявить гипофосфатемию, увеличение количественного показателя ионизированного кальция, повышение уровня инсулина, гастрина, СТГ, пролактина, паратиреоидного гормона и др. Топическая диагностика новообразований эндокринных желез подразумевает выполнение ЯМР-томографии паращитовидных желез, УЗИ, селективную артериографию, сцинтиографию, МРТ головного мозга, рентгенографию или КТ турецкого седла, ультрасонографию и УЗИ поджелудочной железы.
С целью оценки степени вторичных поражений органов средостения, при МЭН 1 типа применяется забор биологических образцов крови для проведения биохимического анализа, в процессе которого определяются такие показатели: креатинин, мочевина, электролиты, щелочная фосфатаза, глюкоза, остаточный азот и др. Показано также проведение проб мочи по Сулковичу и Зимницкому. К числу диагностических мероприятий при МЭН 1 также относится экскреторная урография, УЗИ почек, ЭКГ, денситометрия, фиброгастродуоденоскопия, рентгенография трубчатых костей, пальцев рук и др.
Лечение МЭН 1 типа
Тактика лечения при множественных эндокринных неоплазиях 1 типа заключается в поэтапном удалении неоплазий. В первую очередь производится паратиреодиэктомия — удаление околощитовидных желез, затем приступают к удалению поджелудочной железы (резекция головки поджелудочной железы, энуклеация, панкреатодуаденальная резекция, дистальная резекция и др.). Если опухоли имеют злокачественный характер, пациенту проводят послеоперационную химиотерапию.
Аденома гипофиза при МЭН 1 типа лечится при помощи хирургического метода, химио- или лучевой терапии.
Множественные эндокринные неоплазии 2А и 2В типов
Характеристика МЭН 2А и 2В типов
Симптомокомплекс множественных эндокринных неоплазий 2А типа подразумевает наличие феохромоцитомы, гиперпаратиреоза медуллярной карциномы щитовидной железы. Впервые данная патология была описана Дж. Сипплом в 1959 году, поэтому в некоторых источниках встречается второе название этого синдрома — синдром Сипла.
При МЭН 2В типа (синдром Горлина), помимо перечисленных выше составляющих, присутствуют нейропатии и патология опорно-двигательного аппарата и невриномы слизистых оболочек.
Причины МЭН 2А и 2В типов
Этиологическим фактором развития синдромов множественных эндокринных неоплазий 2 типов является аутосомно-доминантное наследование мутации RET-протоонкогена в области 10р11.2 в Х хромосоме. У пациентов с МЭН 2А типа процесс мутации происходит в кодонах 768 и 804 в экзоне 11 и в кодонах 609, 618, 620, 634 в экзоне 10. При МЭН 2В типа изменения происходят в 918 кодоне 11 экзона. Процесс мутации RET-протоонкогена провоцирует его активацию, что становится причиной неконтролируемого клеточного роста и неопластической трансформации.
Частота развития множественных эндокринных неоплазий 2 типа составляет 1-10 случаев на 100 тыс. человек.
Симптомы МЭН 2А и 2В типов
Среди ранних симптомов множественных эндокринных неоплазий 2А типа первое место занимает рак щитовидной железы, который исходит из парафолликулярных клеток и секретирует кальцитонин. Спектр симптомов небольшой, треть пациентов могут жаловаться на диарею и иметь карциноидный синдром, связанный с выработкой опухолью вазоактивных пептидов (серотонина, гистамина, простагландинов).
В некоторых случаях карцинома щитовидной железы вырабатывает АКТГ, что является предрасполагающим фактором к развитию синдрома Иценко-Кушинга. В основном медуллярный рак щитовидной железы диагностируется в процессе обследования больных по поводу узлового зоба. Медуллярная карцинома щитовидной железы одинаково часто встречается и у мужчин, и у женщин (соотношение 1:1). Возрастная категория пациентов колеблется в пределах 30-40 лет.
По мере прогрессирования карциномы развивается раковая кахексия, печеночная желтуха, возможны легочные кровотечения. В случае отсутствия терапевтических мероприятий III и IV стадии происходит быстрый летальный исход.
У половины пациентов с МЭН 2А типа выявляется феохромоцитома и, как правило, уже после поражения опухолью щитовидной железы. В большинстве случаев феохромоцитома развивается в совокупности с транзиторной, умеренной или постоянной артериальной гипертензией, гипергидрозом, общей слабостью, полиурией, гиперсаливацией. В случае кризового течения феохромоцитомы — высокий риск развития острой сердечной недостаточности, фибрилляции желудочков, гемморагического инсульта, отека легких. Возможны гипертонические кризы, в процессе которых происходит молниеносное повышение артериального давления, которое может достичь цифр 220/150 и выше. Такие приступы завершаются внезапно, как и начались.
Снижение аппетита, тошнота, почечные колики и боли в эпигастральной области при МЭН 2А типа могут свидетельствовать о наличии гиперпаратиреоза.
Течение МЭН 2А типа может сочетаться с болезнью Гиршпрунга и первичным амилоидозом кожи.
В случае развития синдрома множественных эндокринных неоплазий 2В типа к феохромоцитоме, гиперпаратиреозу и медуллярной карциноме щитовидной железы присоединяется развитие множественных неврином слизистых оболочек и патологии опорно-двигательного аппарата.
У больных с синдромом множественных эндокринных неоплазий 2В типа развивается марфаноподобная внешность, также у них часто встречается воронкообразная деформация грудной клетки, конская стопа, искривление позвоночника, вывихи бедренных костей и арахнодактилия. Невриномы в большинстве случаев локализируются на слизистых ЖКТ, губ, щек и на языке. Они представлены в виде безболезненных бело-розовых узелков величиной 1-3 см. Расстройства пищеварительной системы могут провялятся в качестве запоров, диареи, мегаколона.
Диагностика МЭН 2А и 2В типов
На протяжении периода диагностики пациенту выполняют ряд исследований, среди которых сцинтиография, УЗИ щитовидной железы и надпочечников, определение уровня гормонов (АКТГ, кальцитонина, тиреоглобулина, паратгормона, катехоламинов) и кальция в крови. Генетические исследования дают возможность диагностировать мутацию RET-протоонкогена.
Лечение МЭН 2А и 2В типов
Терапевтические мероприятия, направленные на устранения синдрома множественных эндокринных неоплазий 2 типа подразумевают поэтапное удаление феохромоцитомы — одностороннее или двухстороннее удаление надпочечников. В случае двухсторонней адреналэктомии, с целью профилактики хронической надпочечниковой недостаточности, необходима постоянная заместительная минерало- и глюкокортикоидная терапия.
На следующем этапе производится тиреоидэктомия, при необходимости с лимфодиссекцией. После данного оперативного вмешательства, для профилактики послеоперационного гипотиреоза, рекомендовано применение тироксина. При наличии неоперабельной карциномы щитовидной железы самым корректным способом лечения является химиотерапия.
Хирургическое лечение гиперпаратиреоза при МЭН 2 типа может подразумевать субтотальную паратиреоидэктомию, а иногда тотальный вариант удаления околощитовидных желез в комплексе с аутотрансплантацией тиреоидной ткани в мышцу предплечья.
Неотъемлемой частью диагностики являются дифференциальные анализы. Они особенно актуальны в процессе определения МЭН 2А типа, при медуллярной карциноме необходимо исключить сходство со спорадическими вариантами болезни. Верифицировать диагноз поможет тщательное генетическое обследование.
Прогноз при синдроме множественных эндокринных неоплазий
Наблюдение пациентов в динамике и генетический скрининг больных с синдромом множественных эндокринных неоплазий 1 типа дают возможность выполнить диагностику и контроль за течением данного синдрома, что качественно увеличивает шансы на выздоровление при данной патологии. Множественные злокачественные новообразования поджелудочной железы подразумевают гораздо меньшие шансы на успех.
Множественные эндокринные неоплазии 2 типа также имеют неблагоприятный прогноз, который во многом зависит от наличия метастаз феохромоцитомы и рака щитовидной железы и от операбельности больного.
Немаловажную роль играет субъективное отношение пациента к своему здоровью, а также уровень компетентности и внимательности специалистов. Если больной тщательно и своевременно выполняет рекомендации доктора, это безусловно положительно скажется на его здоровье.
Источник
